修回日期: 2003-09-25
接受日期: 2003-10-27
在线出版日期: 2004-03-15
目的: 探讨Ras蛋白过度表达与胰腺癌和慢性胰腺炎临床病理的关系, 以及K-ras突变在慢性胰腺炎中的临床意义和在胰腺癌诊断中的价值.
方法: 应用EnVision显色系统免疫组化方法分别检测胰腺癌组织(24例)、癌旁组织(77例)、手术切缘正常组织(16例)和慢性胰腺炎(24例)石蜡包埋组织中P21ras的表达情况. 应用聚合酶链反应-单链构象多态性分析(PCR-SSCP)方法分别检测胰腺癌、癌旁组织、手术切缘正常组织、慢性胰腺炎石蜡包埋组织的K-ras突变并进行DNA测序确认.
结果: P21ras在胰腺导管腺癌组织中的表达阳性率为58.3%(14/24), 与慢性胰腺炎胰腺导管增生组织的 P21ras表达阳性率45.8%(11/24)相比, 二者差异无显著性(P>0.05); P21ras在良、恶性胰腺疾病增生性病变中的表达阳性率为36.6%(30/82), 与其在正常胰腺组织中的表达阳性率(0%)相比, 有显著性差异(P<0.05); P21ras蛋白在正常胰腺组织、导管增生性病变、导管不典型增生中的表达阳性率分别为0%、36.6%和78.9%, 呈渐进过程, 而且增生性导管病变与不典型增生相比, P21ras表达阳性率的差异具有显著性(P<0.05). 胰腺癌K-ras12密码子突变率(79%)显著高于慢性胰腺炎(33.3%)(P<0.01), 且在切缘正常组织→癌周导管增生→癌周不典型增生→胰腺癌过程中, 突变率有逐渐上升的趋势. 突变方式以12密码子GGT→GAT、GTT、CGT为主且同1例患者突变方式一致.
结论: P21ras过度表达和K-ras基因突变在胰腺癌发生中起到作用, 但K-ras基因突变作为胰腺癌诊断的分子标志缺乏特异性.
引文著录: 任玥欣, 许国铭, 李兆申, 刘枫. K-ras基因在胰腺癌和慢性胰腺炎中突变和表达异常及其临床意义. 世界华人消化杂志 2004; 12(3): 664-668
Revised: September 25, 2003
Accepted: October 27, 2003
Published online: March 15, 2004
AIM: To investigate frequency and clinical significance of P21ras expression and K-ras mutations in pancreatic diseases and to identify their diagnostic values in pancreatic carcinoma.
METHODS: A total of 117 ductal lesions were identified in the available sections from pancreatic resection specimens of patients with pancreatic diseases, comprising 24 pancreatic ductal adenocarcinoma, 19 peritumoral ductal atypical hyperplasia, 58 peritumoral ductal hyperplasia and 19 normal duct at the tumor free resection margin. 24 ductal lesions were gotten from 24 chronic panctratitis. The expression of P21ras was examined by immunohistochemical method. DNA was extracted. Codon 12 K-ras mutations were examined using the two-step polymerase chain reaction (PCR) combined with restriction enzyme digestion, followed by nonradioisotopic single-strand conformation polymorphism (SSCP) analysis by means of automated DNA sequencing.
RESULTS: The expression level of P21ras in pancreatic carcinoma and chronic pancreatitis was higher than that of normal pancreatic tissue, but the expression of P21ras in ductal hyperplasia neighboring pancreatic carcinoma was similar to that in ductal hyperplasia of chronic pancretitis. P21ras showed a gradual stepwise increase in the frequency of expression ranged from normal pancreatic duct (0%), to hyperplasia duct (36.6%) and to atypical hyperplasia duct (78.9%). The expression level of P21ras of atypical hyperplasia duct was higher than that of hyperplasia duct (P < 0.01). K-ras mutation rate of the pancreatic carcinoma was 79%, which was significantly higher than that in the chronic pancreatitis (33%) (P < 0.01). It was also found that K-ras mutation rate was gradually increased from normal duct at the tumor free resection margin, peritumoral ductal hyperplasia, peritumoral ductal atypical hyperplasia to pancreatic ductal adenocarcinoma. The mutation pattern of K-ras 12 codon of chronic pancreatitis was GGT→GAT, GGT and CGT, which was identical to that in pancreatic carcinoma.
CONCLUSION: Overexpression of P21ras and K-ras mutation may play roles in the malignant transformation of pancreatic ductal cell. K-ras mutation only is not specific enough to diagnose pancreatic carcinoma.
- Citation: Ren YX, Xu GM, Li ZS, Liu F. Aberrant expression and mutations of K-ras gene in pancreatic adenocarcinoma and chronic pancreatitis. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 664-668
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/664.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.664
胰腺癌为一高度恶性肿瘤[1-6], 临床确诊者大多属晚期癌[7-14], 提高早期发现率, 能获得手术切除而提高其生存率. K-ras基因与胰腺癌高度相关, 其第一外显子12密码子的点突变在胰腺导管腺癌组织中高达70-100%, 且是胰腺肿瘤发生的早期事件. K-ras 基因突变可导致基因扩增, mRNA稳定性增加, 而使蛋白表达增高, 产生持续性刺激信号, 使细胞持续生长, 但K-ras突变发生的最早阶段尚不清楚. 而K-ras突变亦可见于良性胰腺疾病及正常胰腺, 对他可作为胰腺癌早期诊断的分子标志提出了疑问. 我们探讨Ras蛋白过度表达与胰腺癌和慢性胰腺炎临床病理的关系, 以及K-ras突变在慢性胰腺炎中的临床意义和在胰腺癌诊断中的价值.
长海医院1996-01/2001-02病理证实良恶性胰腺疾病术后石蜡包埋组织标本: 胰腺导管腺癌组织24例, 癌旁胰腺导管增生组织58例, 癌旁胰腺导管不典型增生组织19例和手术切缘正常胰腺组织16例; 慢性胰腺炎24例, 选择胰腺导管增生组织蜡块, 慢性胰腺炎患者经1-5年随访全部健在且无1例发展为胰腺癌. 7例正常胰腺组织为非胰腺疾病患者尸检标本. 胰腺癌细胞株Patu-8988由德国Marbury市Philips大学分子生物学和分子病理学研究所Elsasser博士惠赠. K-ras P21单抗(鼠抗人)购自Novocastra Laboratories公司.
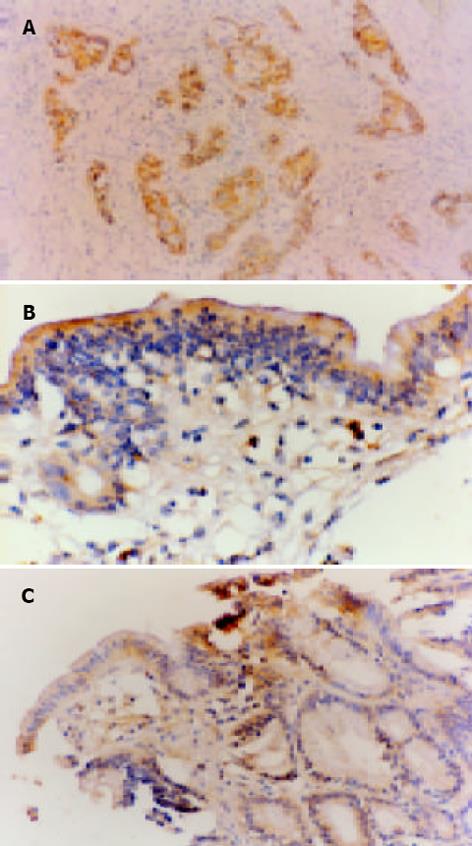
1.2.1 免疫组织化学染色: 采用EnVision显色系统(Dako公司), 染色步骤按说明书方法进行. 以胞质着棕褐色为阳性细胞. 随机观察10个高倍视野, 计数至少300个胰腺癌细胞或胰导管细胞, 按阳性细胞数小于5%(-), 5%-10%(+), 10%-40%(++), 大于40%(+++). 阴性对照: 以PBS代替一抗; 阳性对照: 已知阳性的人胰腺癌石蜡组织切片.
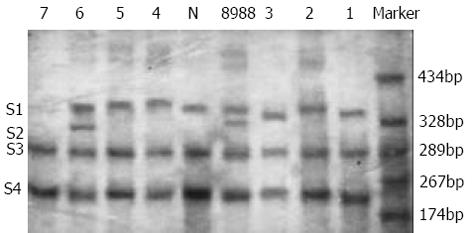
1.2.2 K-ras突变检测: 每份标本一部分切成5 m薄片, HE染色光镜下组织鉴定, 另取10 m薄片3-5片(表面积约1.0 cm2)放入1.5 mL消毒塑料离心管中, 经二甲苯脱蜡乙醇漂洗, 离心后干燥沉淀物. 采用柱离心式小量组织基因组DNA抽提试剂盒(上海华舜生物工程公司), 按说明书操作. 经纯度鉴定后-20 ℃ 保存备用. 半巢式聚合酶链反应(PCR) 引物由上海生工生物工程公司合成, 其序列为R1=5'ACT GAA TAT AAA CTT GTG GTA GTT GGA CCT 3'; R2=5'TCA AAG AAT GGT CCT GGA CC 3'; R3=5'TAA TAT GTC GAC TAA AAC AAG ATT TAC CTC 3'. 配对方式为R1-R2, R1-R3. 半巢式PCR需经两次PCR一次酶切. DNA扩增仪为Perkin-Elmer 9600型, PCR试剂盒购于Promega公司的PCR Core系统. PCR反应总体积50 L, 含4种dNTP 浓度各0.2 mmol/L, MgCl2 1.5 mmol/L, PCR buffer 1×(MgCl2-Free), 引物浓度1 mol/L, 25 ku/ L Taq酶. 每次PCR均设置阴阳性对照各1例, 阳性对照所用模板及引物系Promega公司配给. R1和R2为引物, PCR参数为95 ℃、5 min预变性, 加入Taq酶, 94 ℃ 1 min, 52 ℃ 1 min, 72 ℃ 1.5 min, 循环25次, 最后72 ℃ 5 min. 扩增片段为157 bp, 酶切条件为酶切反应体系50 L中含BstN1(Biolab公司) 0.25 L、BSA0.5 L、Buffer25 L, 60 ℃酶切2 h, 煮沸灭活酶. 取酶切产物2 L用做第2次PCR模板, R1和R3为引物, PCR条件同前, 惟循环次数为30次. 扩增片段为135 bp, 取产物8 L作20 g/L琼脂糖凝胶电泳分析(图2). 单链构象多态性分析(SSCP) 为寻找基因变异, 每一被检样本均在12%非变性聚丙稀酰胺凝胶下进行电泳, 观察SSCP条带情况. 以正常人外周血白细胞DNA扩增产物为阴性对照, 胰腺癌细胞株Patu-8988DNA扩增产物为阳性对照, 电泳前将PCR产物煮沸5 min热变性, 立即置冰浴, 然后经4 ℃、35 V电泳, 电泳21 h, 至二甲苯青距胶底部约0.5 cm, 结束电泳, 以银染显示条带, 照相分析. 对每个样本均经2-3次电泳以保证实验的准确性(图3). DNA测序 所有经PCR-SSCP筛选分析、显示条带异常的胰腺癌和慢性胰腺炎患者的PCR产物经胶回收式纯化、克隆入pUCm-T载体中, 并进行插入片段的序列分析. 测序用PE公司测序试剂盒, 再PE公司ABI PRISM 377DNA测序仪上进行.
统计学处理 应用SPSS统计软件, 采用x2检验、Fisher精确检验和t检验.
P21ras 阳性物呈棕褐色颗粒状, 定位于胞质, 可见于增生性胰腺导管上皮细胞及导管腺癌细胞. 阳性细胞呈散在、灶性或弥漫分布(图1)P21ras在胰腺导管腺癌组织与慢性胰腺炎胰腺导管增生组织中阳性表达率分别为58.3%和45.8%, 二者差异无显著性(P>0.05); P21ras在良恶性胰腺疾病增生性病变中的表达阳性率为36.6%, 与其在正常胰腺组织中的表达阳性率(0%)相比, 有显著性差异(Fisher精确检验 P<0.05); 胰腺癌周胰腺导管增生组织的P21ras表达阳性率(32.8%)与慢性胰腺炎导管增生组织的P21ras表达阳性率(45.8%)相比, 二者差异无显著性(P>0.05); P21ras在正常胰腺组织、导管增生性病变、导管不典型增生中的表达阳性率分别为0%, 36.6%和78.9%, 呈渐进过程.
K-ras12密码子由切缘正常组织→癌周导管增生组织→癌周不典型增生组织→胰腺癌组织的过程中, 突变率有逐渐上升的趋势, 且胰腺癌组突变率明显高于正常胰腺、慢性胰腺炎、切缘正常组织及癌周导管增生组(P<0.01). (表1)突变方式以12密码子GGT→GAT、GTT、CGT为主, 未见13密码子突变(表2). 胰腺癌组织K-ras12密码子突变与各临床病理参数无明显相关性.
| 病理类型 | K-ras12密码子突变方式 | ||
| GAT | GTT | CGT | |
| 胰腺癌 | 8 | 4 | 7 |
| 癌周导管不典型增生 | 7 | 2 | 3 |
| 癌周导管增生 | 10 | 3 | 7 |
| 慢性胰腺炎 | 4 | 2 | 2 |
胰腺癌早期诊断困难, 手术病死率高达5%-10%. 若能早期确诊并根治性切除, 5年生存率可提高至19%-41%[15-18]. 众多研究表明K-ras基因突变是胰腺肿瘤发生的早期事件, 可用于早期诊断胰腺癌. 文献报道胰腺癌K-ras突变率高达70%-100%, 且几乎都集中于第一外显子的12密码子. K-ras12密码子的野生型为GGT, 突变型常见为GAT、GTT、CGT, 此三种类型占所有突变类型的60%-100%. Cerny et al[19]通过亚硝胺诱发叙利亚仓鼠胰腺癌的模型发现, 诱变剂作用下, 胰腺导管腺癌发生之前存在小灶性增生、乳头状增生和原位癌的序列性导管损伤, 其中均可检测到K-ras基因异常, 因而认为K-ras突变是胰腺导管腺癌发生的早期事件. 因此, K-ras突变可能预示着潜在的早期胰腺癌, 具有早期诊断价值. 而Rivera et al[20]在42例慢性胰腺炎患者中筛选出11例存在导管增生的为实验组, 4例无导管增生的为对照组检测K-ras突变, 应用显微切割法(microdissection)在组织切片上精确地切割胰腺导管上皮, 经抽提DNA、PCR扩增、探针杂交、DNA直接测序, 结果, 实验组18% (2/11)的患者存在K-ras突变, 对照组均为阴性, 因而得出: 慢性胰腺炎有胰腺导管增生且存在K-ras突变是慢性胰腺炎向胰腺癌发展的潜在原因. 慢性胰腺炎患者(1991-1999)774例的回顾性分析表明, K-ras12密码子平均突变率为13%(0-60%)[21]. 而最近对2 015例慢性胰腺炎患者的流行病学研究发现, 慢性胰腺炎患者发生胰腺癌的危险性较正常人群显著为高, 而且胰腺癌的发生与慢性胰腺炎病程呈正相关, 经10、20年的随访, 分别有2%和4%的慢性胰腺炎发展为胰腺癌, 从而提出, 慢性胰腺炎倾向于向胰腺癌发展[22]. 一个正常细胞转化为恶性表型之前必须经历多种变化, 有研究发现, 胰腺癌周组织发生胰腺导管增生显著高于非恶性对照组, 与癌变模型极相似, 提出可能由胰腺导管增生向胰腺癌发展. Lüttges et al[23]发现: K-ras突变阳性的胰腺导管腺癌, 其癌旁组织胰腺导管增生亦存在K-ras突变. 因此, 目前认为, 慢性胰腺炎与胰腺导管腺癌的相关性本质上是由于慢性胰腺炎中存在胰腺导管增生, 其被认为是胰腺导管腺癌发生中的一个环节, K-ras突变是此种细胞演进过程中的分子事件. 而基因突变致基因表达水平的改变是细胞癌变的早期事件, 有研究表明P21ras过量表达可能是细胞增生活跃的指标.
本结果显示, 胰腺癌周组织中胰腺导管增生的P21ras阳性表达率(32.8%)与慢性胰腺炎中胰腺导管增生的P21ras表达阳性率(45.8%)相比, 二者差异无显著性, 表明良、恶性胰腺疾病导管增生病变中P21ras过量表达无统计学差异. P21ras在良、恶性胰腺疾病增生性病变中的表达阳性率为36.6%(30/82), 与其在正常胰腺组织中的阳性表达率(0%)相比, 差异显著(Fisher精确检验 P<0.05), 这表明胰腺导管增生性病变与正常胰腺导管的P21ras过度表达有统计学差异. P21ras在正常胰腺组织、导管增生性病变、导管不典型增生中的阳性表达率分别为0%, 36.6%和78.9%, 呈渐进过程, 而且增生性导管病变与不典型增生相比, P21ras表达阳性率的差异具有显著性(P<0.05), 且不典型增生是导管腺癌明确的癌前病变, 这就表明P21ras过度表达在胰腺导管细胞向恶性转变过程中起到作用. P21ras在不典型增生中的阳性表达率(78.9%)与导管腺癌组织(58.3%)相比,差异无显著性(P>0.05), 但趋势是下降的.P21ras阳性表达与K-ras12密码子突变在胰腺导管增生性损伤及慢性胰腺炎导管损伤性病变中密切相关(P<0.05). 因本研究中, 胰腺癌临床分期绝大多数为Ⅱ期以上, 这与以前的研究结果-"基因表达水平的改变是细胞癌变的早期事件"是一致的, 也就解释了以往研究及本研究中ras基因在胰腺癌中高突变率(79.2%)与本实验中的P21ras在胰腺癌组织中较低表达阳性率(58.3%)之间的较大差异. P21ras在胰腺癌各种组织学类型和各临床分期中过量表达的差异无显著性, 表明P21ras过量表达并不能作为判断胰腺癌恶性程度和临床进展的参数.
本研究中胰腺癌K-ras基因突变率(79%)显著高于慢性胰腺炎(33.3%), 表明以K-ras基因为分子标志诊断胰腺癌敏感性较高, 但缺乏特异性. 进一步发现, 切缘正常组织→癌周导管增生组织→癌周不典型增生组织→胰腺癌组织的过程中, K-ras突变率有逐渐升高的趋势, 且发现无K-ras突变的胰腺癌, 其癌旁和手术切缘各种组织均无K-ras突变. 对突变者的PCR产物测序发现, 胰腺癌与慢性胰腺炎K-ras12密码子突变方式均表现为GGT→GAT, GTT, CGT, 且同1例患者突变方式一致. 此虽与苍鼠胰腺癌模型中结果相似, 表明K-ras突变与胰腺导管增生性损伤密切相关, 在胰腺癌发生中起到作用, 但尚需长期随访慢性胰腺炎患者以明确K-ras突变是否提示潜在肿瘤的发生、是否可作为胰腺癌的高危因素. 且因胰腺癌的发生发展与其他肿瘤一样, 是一个多种癌基因和/或抑癌基因的作用失衡而产生的细胞演进过程, 也需探讨p16, DPC4, 和 BRCA2等其他基因突变和信号通路在胰腺癌发生中的作用, 确定另外的分子靶, 与敏感性较高的K-ras突变联合检测, 方能提高诊断价值[24-31].
编辑: N/A
| 1. | Hua Z, Zhang YC, Hu XM, Jia ZG. Loss of DPC4 expression and its correlation with clinicopathological parameters in pancreatic carcinoma. World J Gastroenterol. 2003;9:2764-2767. [PubMed] [DOI] |
| 2. | Wang ZQ, Li JS, Lu GM, Zhang XH, Chen ZQ, Meng K. Correlation of CT enhancement, tumor angiogenesis and pathologic grading of pancreatic carcinoma. World J Gastroenterol. 2003;9:2100-2104. [PubMed] [DOI] |
| 3. | Zhou JH, Zhang HM, Chen Q, Han DD, Pei F, Zhang LS, Yang DT. Relationship between telomerase activity and its subunit expression and inhibitory effect of antisense hTR on pancreatic carcinoma. World J Gastroenterol. 2003;9:1808-1814. [PubMed] [DOI] |
| 4. | Zheng M, Liu LX, Zhu AL, Qi SY, Jiang HC, Xiao ZY. K-ras gene mutation in the diagnosis of ultrasound guided fine-needle biopsy of pancreatic masses. World J Gastroenterol. 2003;9:188-191. [PubMed] [DOI] |
| 5. | Tan ZJ, Hu XG, Cao GS, Tang Y. Analysis of gene expression profile of pancreatic carcinoma using cDNA microarray. World J Gastroenterol. 2003;9:818-823. [PubMed] [DOI] |
| 6. | Tang ZH, Qiu WH, Wu GS, Yang XP, Zou SQ, Qiu FZ. The immunotherapeutic effect of dendritic cells vaccine modified with interleukin-18 gene and tumor cell lysate on mice with pancreatic carcinoma. World J Gastroenterol. 2002;8:908-912. [PubMed] [DOI] |
| 9. | 杨 竹林, 王 群伟, 邓 星辉, 李 代强, 吕 芳, 李 永国. 胰腺癌组织ChAT, GAD65和PKC酶活性的表达. 世界华人消化杂志. 2003;11:1554-1557. [DOI] |
| 10. | 谢 传高, 王 兴鹏, 董 育玮, 杜 勤, 蔡 建庭, 钱 可大. 选择性环氧合酶-2抑制剂Celebrex对胰腺癌PGE2和血管内皮因子表达的影响. 世界华人消化杂志. 2003;11:979-981. [DOI] |
| 15. | Postier RG. Past, present, and future of pancreatic surgery. Am J Surg. 2001;182:547-551. [PubMed] [DOI] |
| 16. | Beger HG, Gansauge F, Leder G. Pancreatic cancer: who benefits from curative resection? Can J Gastroenterol. 2002;16:117-120. [PubMed] [DOI] |
| 17. | Shankar A, Russell RC. Recent advances in the surgical treatment of pancreatic cancer. World J Gastroenterol. 2001;7:622-626. [PubMed] |
| 18. | Lillemoe KD. Current management of pancreatic carcinoma. Ann Surg. 1995;221:133-148. [PubMed] [DOI] |
| 19. | Cerny WL, Mangold KA, Scarpelli DG. K-ras mutation is an early event in pancreatic duct carcinogenesis in the Syrian golden hamster. Cancer Res. 1992;52:4507-4513. [PubMed] |
| 20. | Rivera JA, Rall CJ, Graeme-Cook F, Fernández-del Castillo C, Shu P, Lakey N, Tepper R, Rattner DW, Warshaw AL, Rustgi AK. Analysis of K-ras oncogene mutations in chronic pancreatitis with ductal hyperplasia. Surgery. 1997;121:42-49. [PubMed] [DOI] |
| 21. | Löhr M, Maisonneuve P, Lowenfels AB. K-Ras mutations and benign pancreatic disease. Int J Pancreatol. 2000;27:93-103. [PubMed] [DOI] |
| 22. | Lowenfels AB, Maisonneuve P, Cavallini G, Ammann RW, Lankisch PG, Andersen JR, Dimagno EP, Andrén-Sandberg A, Domellöf L. Pancreatitis and the risk of pancreatic cancer. International Pancreatitis Study Group. N Engl J Med. 1993;328:1433-1437. [PubMed] [DOI] |
| 23. | Lüttges J, Schlehe B, Menke MA, Vogel I, Henne-Bruns D, Klöppel G. The K-ras mutation pattern in pancreatic ductal adenocarcinoma usually is identical to that in associated normal, hyperplastic, and metaplastic ductal epithelium. Cancer. 1999;85:1703-1710. [PubMed] [DOI] |
| 24. | Kubrusly MS, Cunha JE, Bacchella T, Abdo EE, Jukemura J, Penteado S, Morioka CY, de Souza LJ, Machado MC. Detection of K-ras point mutation at codon 12 in pancreatic diseases: a study in a Brazilian casuistic. JOP. 2002;3:144-151. [PubMed] |
| 25. | Moore PS, Sipos B, Orlandini S, Sorio C, Real FX, Lemoine NR, Gress T, Bassi C, Klöppel G, Kalthoff H. Genetic profile of 22 pancreatic carcinoma cell lines. Analysis of K-ras, p53, p16 and DPC4/Smad4. Virchows Arch. 2001;439:798-802. [PubMed] [DOI] |
| 26. | Klump B, Hsieh CJ, Nehls O, Dette S, Holzmann K, Kiesslich R, Jung M, Sinn U, Ortner M, Porschen R. Frequent deletions of tumor suppressor genes in pure pancreatic juice from patients with tumoral or nontumoral pancreatic diseases. Pancreatology. 2002;2:17-25. [DOI] |
| 27. | Fukushima N, Walter KM, Uek T, Sato N, Matsubayashi H, Cameron JL, Hruban RH, Canto M, Yeo CJ, Goggins M. Diagnosing pancreatic cancer using methylation specific PCR analysis of pancreatic juice. Cancer Biol Ther. 2003;2:78-83. [PubMed] [DOI] |
| 28. | Fukushima N, Sato N, Ueki T, Rosty C, Walter KM, Wilentz RE, Yeo CJ, Hruban RH, Goggins M. Aberrant methylation of preproenkephalin and p16 genes in pancreatic intraepithelial neoplasia and pancreatic ductal adenocarcinoma. Am J Pathol. 2002;160:1573-1581. [PubMed] [DOI] |
| 29. | Ohtsubo K, Watanabe H, Yamaguchi Y, Hu YX, Motoo Y, Okai T, Sawabu N. Abnormalities of tumor suppressor gene p16 in pancreatic carcinoma: immunohistochemical and genetic findings compared with clinicopathological parameters. J Gastroenterol. 2003;38:663-671. [PubMed] [DOI] |
| 30. | House MG, Guo M, Iacobuzio-Donahue C, Herman JG. Molecular progression of promoter methylation in intraductal papillary mucinous neoplasms (IPMN) of the pancreas. Carcinogenesis. 2003;24:193-198. [PubMed] [DOI] |
| 31. | Logsdon CD, Simeone DM, Binkley C, Arumugam T, Greenson JK, Giordano TJ, Misek DE, Kuick R, Hanash S. Molecular profiling of pancreatic adenocarcinoma and chronic pancreatitis identifies multiple genes differentially regulated in pancreatic cancer. Cancer Res. 2003;63:2649-2657. [PubMed] |