修回日期: 2003-09-01
接受日期: 2003-09-25
在线出版日期: 2004-03-15
目的: 研究DPC4基因转染对结肠癌血管生成的影响.
方法: 利用脂质体介导转染技术建立表达Smad4蛋白的DPC4+-SW620(PcDNA-DPC4转染的SW620细胞)细胞模型; Western blot检测细胞中Smad4的表达; 利用ELISA法检测细胞上清中VEGF蛋白的表达; 利用RT-PCR检测细胞内VEGF mRNA的表达; 利用皮下注射法建立裸鼠结肠癌移植瘤模型; 利用免疫组织化学S-P法检测裸鼠肿瘤组织中VEGF的表达及微血管密度.
结果: 建立了表达Smad4蛋白的DPC4+-SW620细胞系; DPC4+-SW620细胞, 其Smad4蛋白表达于细胞质及细胞核, 以胞质为主; DPC4+-SW620细胞其Smad4蛋白表达水平明显高于SW620细胞及PcDNA-SW620细胞(PcDNA3.1转染的SW620细胞); DPC4+-SW620细胞其VEGF蛋白、VEGFmRNA水平明显低于SW620细胞及PcDNA-SW620细胞(P<0.05); 成功地建立了裸鼠结肠癌移植瘤模型; DPC4+-SW620组裸鼠肿瘤生长速度慢于SW620细胞组及PcDNA-SW620细胞组(P<0.05); DPC4+-SW620组裸鼠肿瘤重量低于SW620细胞组及 PcDNA-SW620细胞组(P<0.05); DPC4+-SW620组裸鼠肿瘤组织VEGF蛋白、肿瘤组织微血管密度均低于SW620细胞组及PcDNA-SW620细胞组(P<0.05).
结论: DPC4能够抑制裸鼠结肠癌移植瘤的生长.
引文著录: 罗庚求, 李景和, 陈永平, 文继舫, 肖德胜, 胡忠良, 杨晓静, 郑晖. DPC4基因转染对结肠癌血管生成的影响. 世界华人消化杂志 2004; 12(3): 580-584
Revised: September 1, 2003
Accepted: September 25, 2003
Published online: March 15, 2004
AIM: To study the mechanism of transfected DPC4 gene on angiogenesis.
METHODS: SW620 cells were transfected with PcDNA3.1-DPC4 plasmid by using lipofectamine transfecting technique. Expression of Smad4 in DPC4+-SW620 cells was observed by Western blot. The expression of VEGF protein in the cell supernatant was detected by ELISA, and VEGF mRNA by RT-PCR. The model of nude mice inoculated with DPC4+-SW620 cells was established by injecting into flank subcutaneously. The expression of VEGF protein and the microvessel density of tumor tissue in nude mice were detected by immunohistochemical staining (SP method).
RESULTS: DPC4+-SW620 cells expressing Smad4 were harvested; Smad4 protein showed stronger expression in SW620 cells transfected with PcDNA-DPC4 plasmid than that in not-transfected SW620 cells and SW620 cells transfected with blank plasmid, and the positive signal was localized in cytoplasm and nucleus, mainly in cytoplasm; There were lower expression of VEGF protein and mRNA in DPC4+- SW620 cells than that in SW620 cells and PcDNA-SW620 cells (P < 0.05); The model of nude mice inoculated with colon carcinoma cells was established successfully. The tumors of nude mice inoculated with DPC4+-SW620 cells growed more slowly than that inoculated with SW620 cells and PcDNA-SW620 cells. The volume and mass of tumors in nude mice inoculated with DPC4+-SW620 cells were smaller and lighter than those with SW620 cells and PcDNA- SW620 cells (P < 0.05). The expression of VEGF and the microvessel density in DPC4+-SW620 cells were lower than those in SW620 cells and PcDNA-SW620 cells (P < 0.05).
CONCLUSION: The DPC4 gene can suppress the growth of the tumors in nude mice inoculated with DPC4+-SW620 cells; The inhibitory effect of DPC4 on colon carcinoma may be partly mediated by suppressing angiogenesis of tumor.
- Citation: Luo GQ, Li JH, Chen YP, Wen JF, Xiao DS, Hu ZL, Yang YJ, Zheng H. Effect of transfected DPC4 gene on angiogenesis of colon carcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 580-584
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/580.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.580
转化生长因子(transforming growth factor-β, TGF-β)超家族是由许多具有生物学特性的信号分子所组成的大家族[1-5]. DPC4基因表达产物Smad4是TGF-β信号转导通路中关键的核内转录因子. DPC4是侯选的肿瘤抑制基因[6], 其缺失或突变失活与恶性肿瘤细胞丧失对TGF-β的反应性而逃避TGF-β的生长抑制作用密切相关, DPC4的缺失或突变与结肠癌的恶性演进, 如远处转移有关[7-9]. 我们通过DPC4基因转染高转移性的结肠癌细胞株SW620, 获得表达Smad4蛋白的细胞系及通过动物实验建立了人结肠癌裸鼠移植瘤模型, 观察DPC4对VEGF的表达及微血管密度的影响.
SW620细胞株由中南大学湘雅医学院细胞培养中心提供; Balb/c裸鼠由北京中科院动物研究所提供; 空白质粒PcDNA3.1由Joan Massague惠赠, 阳性质粒PcDNA3.1-DPC4由本室肖德胜构建; 限制性内切酶Hind Ⅲ, BamH I, RPMI 1640, neomycine (G418), VEGF和GAPDH PCR引物均由上海生工提供; 脂质体(lipofectamine), Trizol购自Invitrogen公司; 鼠抗人Smad4 Ab-1购自Neomarkers公司; VEGF Ab-1, CD34 Ab-1, SP试剂盒购自北京中山公司; MMV reverse transcription kit, PCR试剂购自Promega 公司; Qiagen plasmid mini kit由Qiagen公司提供; VEGF ELISA kit购自Gibco 公司.
取含PcDNA3.1, PcDNA3.1-DPC4质粒的细菌接种至含LB选择性培基的培养皿, 用无菌牙签挑取菌落至培养液中小量培养, 碱裂解法小量制备质粒, 用Hind Ⅲ, BamH I酶切鉴定, PcDNA3.1及PcDNA3.1-DPC4经酶切电泳后分别出现5.4、5.4和1.7 kb的条带. 再用菌液大量培养, 并用质粒纯化试剂盒提取纯化质粒. 取高转移性结肠癌细胞株SW620培养, 用lipofecta-mine reagent将质粒PcDNA3.1与PcDNA3.1-DPC4分别转染SW620细胞, 转染细胞经G418 0.5 g/L浓度筛选3 d, 以后换0.25 g/L维持筛选至长出细胞克隆, 挑取克隆扩增培养达1×106以上, 用细胞裂解液提取细胞总蛋白质, 用微量BCA法测定蛋白质浓度, 以80×10-6g相同的总蛋白量加样进行Western blot分析以检测各组细胞Smad4蛋白的表达水平.
1.2.1 上清液VEGF水平检测: 分别取未转染SW620细胞组, 空白质粒PcDNA3.1转染细胞组, 阳性质粒PcDNA3.1-DPC4转染细胞组, 用D-Hanks液洗涤, 2.5 g/L胰酶消化, 计数板计数, 用100 mL/L小牛血清重悬成4×108/L, 各取200 L加入到96孔板, 每组设3个平行孔, 于37 ℃, 50 mL/L CO2培养箱培养36 h, 各取100 L上清液按照VEGF ELISA试剂盒说明检测其蛋白分泌水平, 最后用酶标仪测A490值.
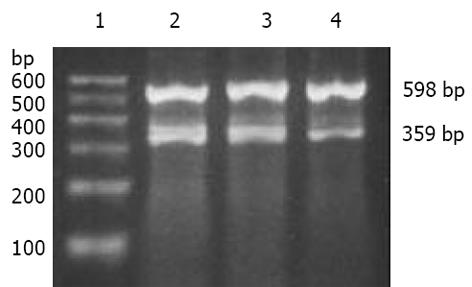
1.2.2 细胞内VEGF基因的表达: 消化培养瓶中细胞, 用100mL/L小牛血清重悬按细胞浓度为1×108/L, 接种至6孔板(每孔1mL), 置37 ℃, 50 mL/L CO2培养箱中培养至80%融合. 将6孔板内上清液去除, 用PBS洗3遍, 滤纸控干, 加Trizol试剂1 mL , 提取总RNA, 用核酸分析仪检测RNA浓度及纯度, 波长A260/A280比值1.7-2.0, 15 g/L琼脂糖凝胶电泳可见3条RNA带, 提示无RNA污染及降解. 取2 g总RNA进行逆转录合成cDNA, 按逆转录试剂盒A3 500操作说明操作, 样品于-20 ℃保存. 取cDNA进行PCR扩增, VEGF及其内参照GAPDH引物序列为VEGF正义5'GGG CAG AAT CAT CAC GAA3', 反义5'AAA TGC TTT CTC CGC TCT 3', 片段长度359 bp; GAPDH正义5'CCACCCATGGCAAATTCCATGGCA 3', 反义5'TCTAGACGGCAGGTCAGGTCCACC 3', 片段长度598 bp. PCR反应条件为预变性95 ℃ 5 min, 94 ℃变性40 s, 54 ℃退火30 s, 72 ℃延伸1 min, 36个循环, 最后72 ℃延伸10 min, 用20 g/L琼脂糖凝胶电泳进行PCR产物鉴定, 用DOC 1 000图像仪扫描, mRNA相对含量用PCR产物VEGF灰度值与GAPDH灰度值的比值表示.
1.2.3 裸鼠成瘤: 裸鼠于无特殊病原体条件(SPF)下饲养. 取雌性、4-5周龄、体质量14-18 g的Balb/c裸鼠12只, 随机分成3组, 每组4只; 将转染DPC4基因、空白载体PcDNA及未转染0.5×1010/L的SW620细胞0.2 mL注射接种于裸鼠腋下. 观察裸鼠成瘤的时间、成瘤率; 待腋下成瘤后每3 d用游标卡尺测量肿瘤最大径(1)和最小径(t), 用公式V=l×t 2×π/6计算肿瘤体积, 绘制生长曲线; 30 d后处死, 拍照并分离肿瘤组织, 称重; 解剖裸鼠, 取肝脏、肺脏、脑、肾脏、胃肠组织及肿瘤组织, 肉眼观察及连续切片显微镜下观察肿瘤及转移情况. 瘤组织石蜡切片, 恒温干燥箱56 ℃ 1 h, 二甲苯脱腊并梯度乙醇水化至水; 30 mL/L H2O2阻断30 min, PBS洗, 微波修复5 min×2, 血清封闭1h; 滴加鼠抗人VEGFAb-1(1: 50), 37 ℃ 30 min, 4 ℃过夜; 滴加羊抗鼠IgG, 湿盒内37 ℃ 30 min, 滴加streptavidin peroxidase湿盒内37 ℃ 30 min; DAB显色. 对照: 用PBS缓冲液代替VEGF Ab-1做阴性对照, 用对VEGF高表达的乳腺癌组织为阳性对照. 另取肿瘤与正常组织交界处的肿瘤组织制片, 用CD34标记血管内皮细胞, 其一抗工作浓度为1: 25. 对照: 用PBS缓冲液代替VEGF Ab-1做阴性对照, 用对CD34高表达的肾癌组织做阳性对照. VEGF蛋白表达均以胞质或细胞膜出现棕黄色颗粒为阳性, 在每张切片上随机选取10个视野, 根据细胞染色强度分为阴性: 细胞无着色(0分), 弱阳性: 黄色(1分), 中度阳性: 棕黄(2分), 强阳性: 棕褐(3分). 计数每一强度的视野数, 根据下列计算公式计算每张切片的平均染色强度, IS (intensity score)=∑{〔0×F0〕+〔1×F1〕+〔2×F2〕+〔3×F3〕}, F =%×10视野. 计算肿瘤内着色的毛细血管和微小血管, 凡呈现棕色单个内皮细胞或内皮细胞群者均作为一个血管计, 但肌层较厚及管腔面积大于8个红细胞直径的血管不计数(N Engl J Med 1991; 324: 1-8). 计数方法, 每张染色切片首先在低倍镜×40选择肿瘤组织内血管密度最高区, 然后在×400倍视野下计数3个视野内的微血管数, 取其平均值.
统计学处理 数据以mean±SD表示, 多组间比较用方差分析(方差齐)或秩和检验(方差不齐), 以P<0.05为差异有显著性.
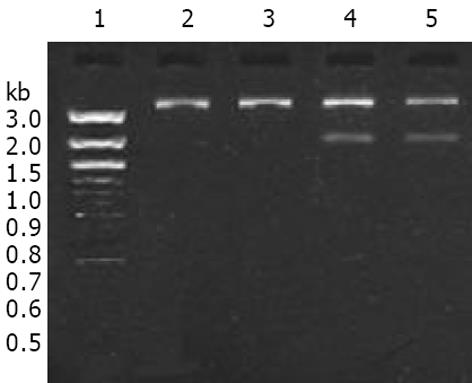
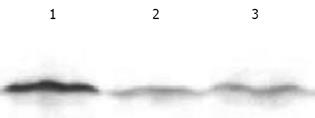
空白质粒PCDNA3.1和阳性质粒PCDNA3.1-DPC4酶切电泳后分别出现5.4 kb的载体片段、5.4 kb的载体片段和1.7 kb的DPC4目的片段, (图1). 基因转染后阳性克隆的Western blot分析表明SW620组和空白质粒PCDNA3.1组DPC4表达弱阳性, 而阳性质粒PCDNA3.1-DPC4组DPC4表达强阳性(图2).
DPC4组较SW620组VEGF浓度明显降低, 差异有显著性(18.2±0.5 vs 158.2±5.5ng/L P<0.05)
RT-PCR重复3次, 经VDS图像分析系统进行灰度扫描, 经单向方差分析, DPC4组SW620组和空白质粒PcDNA组明显降低(图3, P<0.05).
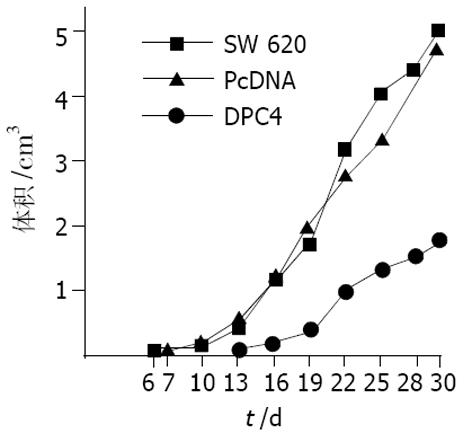
6 d出现明显的肿块, PcDNA3.1空白载体转染组在接种后平均7 d出现明显的肿块, DPC4阳性质粒转染组在接种后出瘤时间明显延迟, 平均为13 d. 出瘤率均为100%, 3组无明显差异. 未转染SW620组有一只裸鼠于13 d死亡, 经解剖发现有灶性肺脓肿、灶性肝坏死, 可能是因为感染导致死亡. 而PcDNA3.1空白载体转染组有一只裸鼠于29 d死亡, 考虑恶病质而死亡, 而DPC4阳性质粒转染组无死亡. 取肿瘤组织, 常规病理切片, 均为低分化腺癌, 无组间差异. 取肝脏、肺脏、脑、肾脏、胃肠组织, 肉眼检查无明显转移灶, 经连续切片显微镜下观察均无肿瘤转移. 待腋下成瘤后每3 d用游标卡尺测量肿瘤最大径(1)和最小径(t), 绘制体积生长曲线(图4). 用重复测量数据的方差分析, 转染PcDNA3.1空白载体组和未转染组肿瘤生长无明显差别, 而转染阳性质粒DPC4组和其余两组肿瘤生长速度明显减慢, 差异有显著性(P<0.001). 裸鼠成瘤后30 d处死, 游离肿瘤并称质量. 经单向方差分析, 转染阳性质粒DPC4组(1.10 g)较转染空白质粒PcDNA组(3.48 g)和未转染组SW620 (3.86 g)裸鼠肿瘤重量明显减轻(P<0.05), 而转染空白质粒PcDNA组和未转染组SW620无显著性差异(P>0.05).
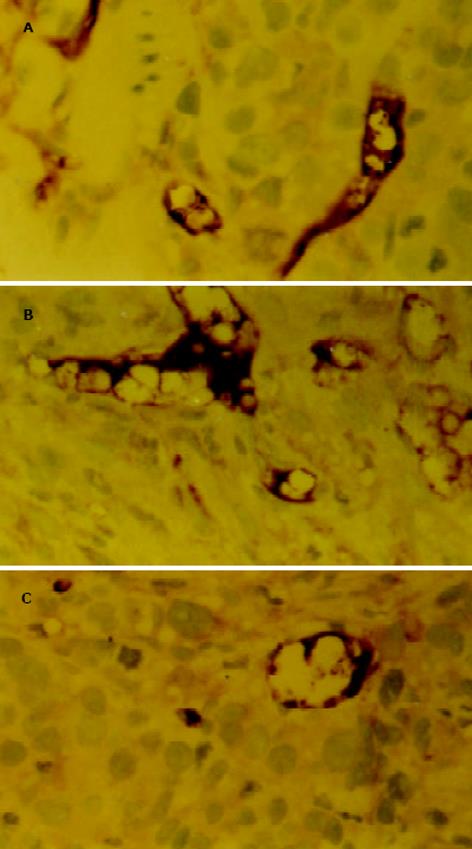
VEGF免疫组化结果经单向方差分析, DPC4组(1.20±0.08)肿瘤组织内VEGF的表达较SW620组(2.30±0.10)和PcDNA组(2.20±0.10)明显降低(P<0.05), 而SW620组和PcDNA组无显著性差异.
DPC4组肿瘤组织内微血管密度(MVD)较SW620组和PcDNA组明显降低(12.5±2.8 vs 28.4±2.3, 27.1±1.6 P<0.05). 而SW620组和PcDNA组无显著性差异(图5).
大肠癌是严重威胁人类健康的常见恶性肿瘤之一[10-17], 其发病率有逐年上升的趋势[18], 而对晚期大肠癌的治疗效果并不理想[19-20], 分子生物学技术的突飞猛进、基因治疗的问世, 将为大肠癌的治疗开辟有效的途径. 应用抑癌基因治疗肿瘤是基因治疗研究的热点[21]. 大肠癌的相关抑癌基因主要有APC, DCC, p53等. DPC4是进展期结肠癌患者同时具有杂和性缺失和突变的基因[22-24]. 我们通过质粒提取, 双酶切鉴定为理想的目的质粒, 转染高转移性结肠癌细胞株SW620, 经G418筛选得到多个细胞克隆, 通过免疫细胞化学和Western- blot 分析选取Smad4表达最强的克隆进行实验. 进一步将未转染SW620组、空白质粒PcDNA-SW620组、阳性质粒DPC4+-SW620组细胞接种于Balb/c裸鼠, 成功地建立了结肠癌裸鼠移植瘤模型. 结果发现, SW620组在接种后平均6 d出现明显的肿块, PcDNA-SW620组在接种后平均7 d出现明显的肿块, 而DPC4+-SW620组在接种后平均13 d才出现明显的肿块, 成瘤时间明显延迟(P<0.05). 三组裸鼠的肿瘤体积随时间生长曲线表明DPC4+-SW620组肿瘤生长速度较SW620组和PcDNA-SW620组明显减慢(P<0.05). 接种30 d后处死裸鼠分离肿块, 结果DPC4+-SW620组肿瘤重量明显轻于其他两组(P<0.05). 以上结果表明, DPC4能够抑制裸鼠结肠癌移植瘤的生长.
DPC4能够对肿瘤的生长起抑制作用, 然而其确切的抑瘤作用机制尚处于探讨之中. TGF-β对肿瘤的抑制作用可分为Smad4依赖型和Smad4非依赖型. TGF-β多数是通过经典的Smad4依赖型通路发挥作用. Fink et al[25]发现Smad4单个等位基因缺失、另一等位基因突变的结肠癌细胞系Vaco-235亦同样表现为对TGF-β的生长抑制作用. DPC4的可能下游目的基因包括VEGF、血小板反应素-1(TSP-1)、P21WAF1、P15、内源性尿激酶型激活子(uPA)、纤溶酶原激活物抑制剂-1(PAI-1)、二聚糖(BGN)、死亡相关蛋白激酶(DAP-kinase)等[26-30].
VEGF是强有力的促血管生成因子, 在与血管内皮细胞增生相关的生理和病理过程中起重要作用, 特别是与实体瘤的关系密切. Im et al[31]用腺病毒介导转染反义VEGF能够抑制裸鼠乳腺癌的生长, 事实上VEGF启动子含有Smad4结合原件相关序列, 因而DPC4具备调节VEGF的理论基础. 从这一思路出发, 我们通过DPC4基因转染结肠癌细胞株SW620, 建立表达Smad4蛋白的细胞系, 然后分未转染SW620组、空白质粒PcDNA-SW620组、阳性质粒DPC4+-SW620组细胞进行实验, 用ELISA方法检测三组细胞上清液中VEGF蛋白、RT-PCR方法检测三组细胞内VEGF mRNA的表达. 结果表明, DPC4能够降低体外结肠癌细胞VEGF蛋白和VEGF mRNA的表达. 进一步通过建立的结肠癌裸鼠移植瘤模型, 用免疫组织化学检测肿瘤组织中VEGF蛋白的表达和微血管密度. 体内实验同样表明, DPC4也能够降低VEGF的表达和微血管密度. 综合以上实验结果推测, DPC4对裸鼠结肠癌移植瘤的抑制作用可能是通过抑制肿瘤的血管生成而实现的.
编辑: N/A
| 1. | Wei HS, Li DG, Lu HM, Zhan YT, Wang ZR, Huang X, Zhang J, Cheng JL, Xu QF. Effects of AT1 receptor antagonist, losartan, on rat hepatic fibrosis induced by CCl(4). World J Gastroenterol. 2000;6:540-545. [PubMed] [DOI] |
| 2. | Huang GC, Zhang JS, Zhang YE. Effects of retinoic acid on proliferation, phenotype and expression of cyclin-dependent kinase inhibitors in TGF-beta1-stimulated rat hepatic stellate cells. World J Gastroenterol. 2000;6:819-823. [PubMed] [DOI] |
| 3. | Huang X, Li DG, Wang ZR, Wei HS, Cheng JL, Zhan YT, Zhou X, Xu QF, Li X, Lu HM. Expression changes of activin A in the developm- ent of hepatic fibrosis. World J Gastroenterol. 2001;7:37-41. [PubMed] [DOI] |
| 4. | Fang DC, Yang SM, Zhou XD, Wang DX, Luo YH. Telomere erosion is independent of micro- satellite instability but related to loss of hetero- zygosity in gastric cancer. World J Gastroenterol. 2001;7:522-526. [PubMed] [DOI] |
| 5. | Xiong B, Gong LL, Zhang F, Hu MB, Yuan HY. TGF beta1 expression and angiogenesis in colorectal cancer tissue. World J Gastroenterol. 2002;8:496-498. [PubMed] [DOI] |
| 6. | Narai S, Watanabe M, Hasegawa H, Nishibori H, Endo T, Kubota T, Kitajima M. Significance of transforming growth factor beta1 as a new tumor marker for colorectal cancer. Int J Cancer. 2002;97:508-511. [PubMed] [DOI] |
| 7. | Yamaguchi A. Genetic changes in liver metastasis of colorectal cancer and their clinical application. Nippon Geka Gakkai Zasshi. 2001;102:370-375. [PubMed] |
| 8. | Mikami T, Ookawa K, Shimoyama T, Fukuda S, Saito H, Munakata A. KAI1, CAR, and Smad4 expression in the progression of colorectal tumor. J Gastroenterol. 2001;36:465-469. [PubMed] [DOI] |
| 9. | Maitra A, Molberg K, Albores-Saavedra J, Lindberg G. Loss of Dpc4 expression in colonic adenocar- cinomas correlates with the presence of metastatic disease. Am J Pathol. 2000;157:1105-1111. [PubMed] [DOI] |
| 10. | Yi J, Wang ZW, Cang H, Chen YY, Zhao R, Yu BM, Tang XM. p16 gene methylation in colorectal cancers associated with Duke's staging. World J Gastroenterol. 2001;7:722-725. [PubMed] |
| 11. | Li XW, Ding YQ, Cai JJ, Yang SQ, An LB, Qiao DF. Studies on mechanism of Sialy Lewis-X antigen in liver metastases of human colorectal carcinoma. World J Gastroenterol. 2001;7:425-430. [PubMed] [DOI] |
| 12. | Wu BP, Xiao B, Wan TM, Zhang YL, Zhang ZS, Zhou DY, Lai ZS, Gao CF. Construction and selection of the natural immune Fab antibody phage display library from patients with colorectal cancer. World J Gastroenterol. 2001;7:811-815. [PubMed] [DOI] |
| 13. | Deng YC, Zhen YS, Zheng S, Xue YC. Activity of boanmycin against colorectal cancer. World J Gastroenterol. 2001;7:93-97. [PubMed] [DOI] |
| 14. | Peng ZH, Xing TH, Qiu GQ, Tang HM. Relationship between Fas/FasL expression and apoptosis of colon adenocarcinoma cell lines. World J Gastroenterol. 2001;7:88-92. [PubMed] [DOI] |
| 15. | Jia XD, Han C. Chemoprevention of tea on colorectal cancer induced by dimethylhy-drazine in Wistar rats. World J Gastroenterol. 2000;6:699-703. [PubMed] [DOI] |
| 16. | Xiao B, Jing B, Zhang YL, Zhou DY, Zhang WD. Tumor growth inhibition effect of hIL-6 on colon cancer cells transfected with the target gene by retroviral vector. World J Gastroenterol. 2000;6:89-92. [PubMed] [DOI] |
| 17. | Xie B, He SW, Wang XD. Effect of gastrin on protein kinase C and its subtype in human colon cancer cell line SW480. World J Gastroenterol. 2000;6:304-306. [PubMed] |
| 18. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [PubMed] [DOI] |
| 19. | 潘 胜武, 孙 安乐, 刘 变英, 崔 大祥, 闫 小君, 粟 彤, 雷 宇锋, 王 胜. 大肠癌相关基因表达的早期诊断意义. 世界华人消化杂志. 2000;8:1431-1432. [DOI] |
| 22. | Tascilar M, Skinner HG, Rosty C, Sohn T, Wilentz RE, Offerhaus GJ, Adsay V, Abrams RA, Cameron JL, Kern SE. The SMAD4 protein and prognosis of pancreatic ductal adenocarcinoma. Clin Cancer Res. 2001;7:4115-4121. [PubMed] |
| 23. | Maitra A, Molberg K, Albores-Saavedra J, Lindberg G. Loss of Dpc4 expression in colonic adenocarcinomas correlates with the presence of metastatic disease. Am J Pathol. 2000;157:1105-1111. [PubMed] [DOI] |
| 24. | Wilentz RE, Iacobuzio-Donahue CA, Argani P, McCarthy DM, Parsons JL, Yeo CJ, Kern SE, Hruban RH. Loss of expression of Dpc4 in pancreatic intraepithelial neoplasia: evidence that DPC4 inactivation occurs late in neoplastic progression. Cancer Res. 2000;60:2002-2006. [PubMed] |
| 25. | Fink SP, Swinler SE, Lutterbaugh JD, Massague J, Thiagalingam S, Kinzler KW, Vogelstein B, Willson JK, Markowitz S. Transforming growth factor-beta-induced growth inhibition in a Smad4 mutant colon adenoma cell line. Cancer Res. 2001;61:256-260. [PubMed] |
| 26. | Schwarte-Waldhoff I, Volpert OV, Bouck NP, Sipos B, Hahn SA, Klein-Scory S, Luttges J, Kloppel G, Graeven U, Eilert- Micus C. Smad4/DPC4- mediated tumor suppr ession through suppression of angiogenesis. Proc Natl Acad Sci USA. 2000;97:9624-9629. [PubMed] [DOI] |
| 27. | Schwarte-Waldhoff I, Schmiegel W. Smad4 transcriptional pathways and angiogenesis. Int J Gastrointest Cancer. 2002;31:47-59. [PubMed] [DOI] |
| 28. | Peng B, Fleming JB, Breslin T, Grau AM, Fojioka S, Abbruzzese JL, Evans DB, Ayers D, Wathen K, Wu T. Suppression of tumorigenesis and induction of p15 (ink4b) by Smad4/DPC4 in human pancreatic cancer cells. Clin Cancer Res. 2002;8:3628-3638. [PubMed] |
| 29. | Chen WB, Lenschow W, Tiede K, Fischer JW, Kalthoff H, Ungefroren H. Smad4/ DPC4- dependent regulation of biglycan gene expression by transforming growth factor-beta in pancreatic tumor cells. J Biol Chem. 2002;277:36118-36128. [PubMed] [DOI] |
| 30. | Jang CW, Chen CH, Chen CC, Chen JY, Su YH, Chen RH. TGF-beta induces apoptosis through Smad-mediated expression of DAP-kinase. Nat Cell Biol. 2002;4:51-58. [PubMed] [DOI] |
| 31. | Im SA, Kim JS, Gomez-Manzano C, Fueyo J, Liu TJ, Cho MS, Seong CM, Lee SN, Hong YK, Yung WK. Inhibition of breast cancer growth in vivo by antiangiogenesis gene therapy with adenovirus-mediated antisense-VEGF. Br J Cancer. 2001;84:1252-1257. [PubMed] [DOI] |