修回日期: 2003-09-25
接受日期: 2003-10-22
在线出版日期: 2004-03-15
目的: NGX6是新克隆的侯选抑瘤基因, 其在结肠癌组织中表达明显下调, 提示NGX6的差异表达与结肠癌发生有关. 本文通过研究NGX6对人结肠癌细胞HT-29生物学特性的影响以明确NGX6在结肠癌发生发展中的作用.
方法: 脂质体介导pcDNA3.1(+)/NGX6重组体转染低表达NGX6的人结肠癌细胞HT-29, Dot blot及RT-PCR方法检测外源性NGX6基因的表达, 借助生长曲线、MTT、软琼脂集落形成、流式细胞仪、裸鼠成瘤实验对NGX6转染前后人结肠癌细胞HT-29的生物学行为进行检测.
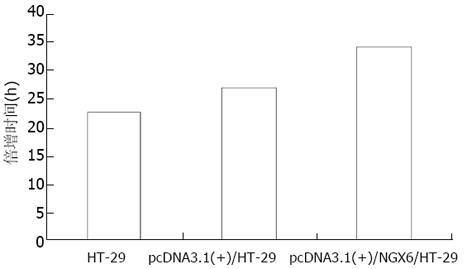
结果: pcDNA3.1(+)/NGX6/HT-29组细胞生长速度比pcDNA3.1(+)/HT-29和HT-29组明显减慢(P<0.05), 其倍增时间为34.5 h比pcDNA3.1(+)/HT-29(27.1 h)和HT-29(23.0 h)延长; pcDNA3.1(+)/NGX6/HT-29组软琼脂集落形成率较对照组明显下降(P<0.05); 流式细胞仪检测NGX6高表达能延缓HT-29细胞周期由G0/G1期→S期的进程; 裸鼠成瘤实验表明pcDNA3.1(+)/NGX6/HT-29组成瘤受抑.
结论: NGX6的重表达可逆转人结肠癌细胞HT-29的恶性表型; NGX6是极具前途的结肠癌相关抑瘤基因侯选者.
引文著录: 王晓艳, 沈守荣, 刘华英, 张晓梅, 彭聪, 黄河, 刘芬, 李晓玲, 李桂源. 抑瘤基因NGX6对人结肠癌细胞HT-29生长的影响. 世界华人消化杂志 2004; 12(3): 574-579
Revised: September 25, 2003
Accepted: October 22, 2003
Published online: March 15, 2004
AIM: NGX6 is a novel tumor suppressor gene candidate, and the expression of NGX6 decreased in colon cancer specimen, which suggested that the down-regulation of NGX6 was closely related to tumorigenesis of colon cancer. This study was designed to explore effects of NGX6 on the cytobiological characteristics of human colon cancer cell line HT-29 and to elucidate the role of NGX6 in the colon cancer.
METHODS: The mammal expression vector of pcDNA3.1(+)/NGX6 was transfected into human colon cancer cell line HT-29 cells by liposome.The integration of the exogenous vector DNA and the expression of NGX6 were detected by dot blot and RT-PCR. Finally, the cytobiological characteristics of positive clone were analyzed by growth curves of cells, MTT, soft agar assay, FCM and xenograft.
RESULTS: pcDNA3.1(+)/NGX6/HT-29 cells grew slower than pcDNA3.1(+)/HT-29 and HT-29 cells (P < 0.05), and the PDT of pcDNA3.1(+)/NGX6/HT-29 cell was 34.5 hours, which was significantly longer than that of pcDNA3.1(+)/HT-29 cells (27.1 h) and HT-29 cells (23.0 h). FCM data showed that the overexpression of NGX6 blocked the progression of G1→S phase in cell cycle, and it also presented decreased clonogenicity in soft agar assay and tumor formation in nude mice.
CONCLUSION: The re-expression of NGX6 can reverse the malignant phenotype of human colon cancer cell line HT-29. Therefore, NGX6 gene may be a good candidate of tumor suppressor gene associated with colon cancer.
- Citation: Wang XY, Shen SR, Liu HY, Zhang XM, Peng C, Huang H, Liu F, Li XL, Li GY. Effects of tumor suppressor gene NGX6 on growth of human colon cancer cell line HT-29. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 574-579
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/574.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.574
结肠癌是最常见的人类恶性肿瘤之一[1-10], 在北美和欧洲结肠癌是癌相关性死亡的主要原因[11]; 在我国其发病率正以每年2.4%的速度增长. 研究表明结肠癌中存在EGF/EGFR高表达, 其与结肠癌的恶性转化、增生、浸润及不良预后有密切关系[12-16], 抗EGF/EGFR治疗可逆转结肠癌的恶性表型[17]. 生物信息学预测NGX6蛋白具有EGF-like结构域, 其可明显地抑制鼻咽癌细胞的增生, 提示NGX6可能具有负性调控EGFR的作用[18-20]. 文献报道NGX6基因低表达与结肠癌的发生、转移密切相关. 上述研究结果提示NGX6在结肠癌中可能通过影响EGFR的活性及表达而抑制结肠癌的发生和增生[21]. 为进一步明确NGX6在结肠癌中的作用, 我们建立了稳定表达NGX6的人结肠癌细胞HT-29, 通过生长曲线、MTT、软琼脂集落形成、裸鼠成瘤实验, 分析NGX6基因对人结肠癌细胞HT-29生物学行为的影响, 以阐明其在结肠癌发生、发展、分化中的作用.
低分化人结肠癌细胞HT-29, 用含120 ml/L胎牛血清的DMEM, 50 ml/L的CO2, 37 ℃条件下培养; pcDNA3.1(+)/NGX6重组体为哺乳动物高效表达载体(由湘雅医学院肿瘤研究所李江博士惠赠); Balb/c裸鼠, ♂, 4周龄, 购于中国科学院上海药物研究所动物中心, 在湘雅医学院动物学部无菌饲养; 随机引物标记试剂盒、反转录试剂盒、PCR产物纯化试剂盒、Taq酶、限制性内切酶EcoRⅠ和XhoⅠ均购自美国Promega公司; 脂质体、TrizolTM 试剂、蛋白酶K和RNA酶为美国GIBCOL公司产品; DNA抽提纯化试剂盒(小量质粒快速抽提纯化试剂盒、大量质粒快速抽提纯化试剂盒、小量胶回收试剂盒)购自上海舜华生物工程有限公司; 同位素-32P-dCTP购自北京福瑞公司; 胎牛血清, DMEM培基购自华美生物工程公司; 三对引物由上海博亚生物技术有限公司合成: GADPH的两条引物为: L: 5'-CCACCCAGAAGACTGTGGAT-3'; R: 5'-TGAGCTTGACAAAGTGGTCG-3 其扩增目的片段为402 bp; NGX6: L: 5'-GTGCGTGTGGAAACATCATC-3'; R: 5'-TTTGGAACAGGTCACTGCTG-3', 其扩增目的片段为520 bp; pCDNA3.1(+): L: 5'-TGCTCCTGCCGAGAAAGTAT-3'; R: 5'-TCATTTCGAACCCCAGAGTC-3', 扩增片段为498 bp.
1.2.1 质粒DNA的提取步骤按小量质粒快速抽提纯化试剂盒操作程序提取: 培养细胞基因组DNA抽提用刮棒将细胞收集入1 mL的PBS中, 按照《分子克隆实验指南》步骤操作. 培养细胞总RNA的提取按TrizolTM试剂盒(GIBCOL公司)操作程序提取. 差异RT-PCR: 先用DNase-I消化RNA中痕量的DNA. 按逆转录试剂盒操作程序作逆转录反应, 反应体积 20 L, 模板RNA 4 g, 反应结束后, 95 ℃, 10 min终止逆转录反应. PCR反应体系50 ul中含KCl 50 mmol/L, MgCl2 1.5 mmol/L, dNTP 200 mmol/L, Tris HCl 10 mmol/L, pH 8.0, 上下游引物0.1 mmol/L, 模板cDNA5Μl, TaqDNA聚合酶3U, 石蜡油覆盖. 为客观地反映mRNA表达的相对水平, 在NGX6及内对照GAPDH达到PCR平台期前结束PCR. 采用下列参数进行差异PCR: 94 ℃, 50 s; 55-58 ℃, 50 s; 72 ℃, 50 s; 取PCR产物5 L, 10 g/L琼脂糖凝胶电泳, 紫外灯下照相. RT-PCR产物琼脂糖电泳照片和Dot blotX光片结果用TIPAS98图像分析仪进行灰度扫描, 测定产物条带面积的积分光密度A值(IA). NGX6的相对量(IA比值)=NGX6的IA/内对照GAPDH的IA.
1.2.2 质粒DNA的转染: 在6孔板中, 每孔接种1×105个HT-29细胞于完全培养基中, 细胞生长至40%-60%融合期. 取重组体DNA 4 g及脂质体10 L转染细胞, 24 h后更换完全培养基继续培养. 48 h后, 用选择性培基(G418浓度: 1-3 d为250 mg/L, 以后为550 mg/L)筛选抗性克隆, 18 d后挑单个克隆扩大培养, 建成稳定传代的转染细胞系.
1.2.3 DNA探针的制备: 以NGX6 cDNA为模板, PCR扩增NGX6的产物, PCR纯化试剂盒回收PCR产物, 以-32P-dCTP为标记物, 采用随机引物标记试剂盒分别标记NGX6及GAPDH基因的探针, 标记DNA量为50-100 ng, 探针的比放射活性大于1×108 cpm/g. Sephadex G-50柱纯化探针. 探针杂交: 将total RNA 10 g通过多孔过滤加样器加样于尼龙膜上, 凉干尼龙膜, 1.5 J/cm2紫外线将RNA与尼龙膜交联, 真空凝胶干燥仪上80 ℃干烤2 h. 同一张膜先后与NGX6探针和GAPDH探针杂交, -70 ℃放射自显影3 d; 取X光片显影, 定影.
1.2.4 细胞生长: 将pcDNA3.1(+)/NGX6 /HT-29, pcDNA 3.1(+)/HT-29和HT-29三组细胞各取1×104个接种于24孔板内, 每隔24 h消化3孔细胞计数, 每孔计数3遍, 取均值. 共记数8 d, 以细胞数为纵坐标, 时间为横坐绘出生长曲线. 数据分别采用t检验和配伍组多样本间均数比较处理, 并计算生长期细胞的倍增时间. 四唑盐(MTT)比色法: 按《细胞培养》步骤操作, 酶联免疫检测仪上测定各孔490 nm波长处的吸光度A值, 数据经统计学软件SPSS 11.0处理. 软琼脂集落形成: 配制5 g/L的底层琼脂, 凝固后将含单细胞的3.3 g/L顶层琼脂培养液接种于底层琼脂上, 每种细胞接种5皿, 接种密度为2.0×104细胞/平皿. 在含50 mL/L CO2的37 ℃生化培养箱中培养15 d, 计算平均集落形成率, 数据经统计学软件SPSS 11.0处理. 克隆形成率=克隆数/接种细胞数×100%. 流式细胞术: 取生长状态良好、融合至70%-80%的HT-29、pcDNA3.1(+)/HT-29和pcDNA3.1(+)/NGX6 /HT-29三组细胞PBS洗涤, 700 mL/L乙醇固定, 调节细胞浓度至1×109/L, 加入PI染液, 流式细胞仪分析细胞群体在细胞周期各个时相的分布比例及细胞凋亡的百分率. 裸鼠成瘤: 以3×107个细胞/只裸鼠的浓度, 将HT-29, pcDNA3.1(+)/HT-29和pcDNA3.1(+)/NGX6/HT-29三组细胞接种于4周龄裸鼠的前肢腋下, 每组3只, 每隔3 d测量裸鼠移植瘤体积的大小. 30 d后处死裸鼠, 测量移植瘤体积及重量, 并用甲醛固定石蜡包埋制成病理切片做HE染色.
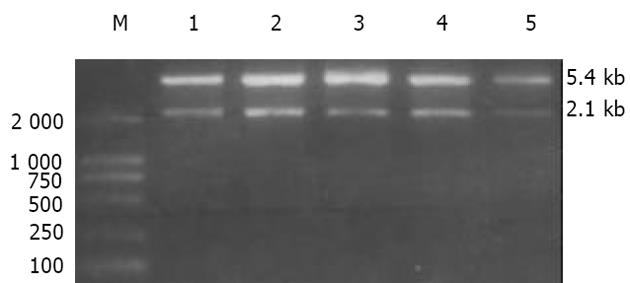
EcoRⅠ和XhoⅠ双酶酶切5组转化细菌JM109的重组体, 均切出5.4 Kb的pcDNA3.1(+)载体的及2.1 Kb的NGX6片段(图1), 表明重组体均含NGX6阅读框架的全长.
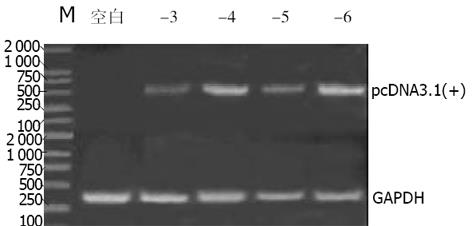
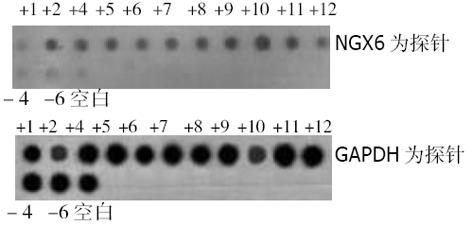
分别挑选11个转染pcDNA3.1(+)/NGX6及4个转染pcDNA3.1(+)的抗性克隆扩大培养, RT-PCR和Dot blot鉴定克隆的阳性率, 11个pcDNA3.1(+)/NGX6克隆中2个克隆(+2、+10号)灰度扫描IA值与空白组的IA值之比大于1.5 (图2); 4个转染pcDNA3.1(+)的抗性克隆中-4和-6号质粒的表达量高(图3). 点杂交鉴定结果与RT-PCR结果一致(图4). 以下实验分别选pcDNA3.1(+)/NGX6/HT-29组的+10号克隆为阳性组、pcDNA3.1(+)/HT-29的-6号克隆和HT-29组为阴性对照组.
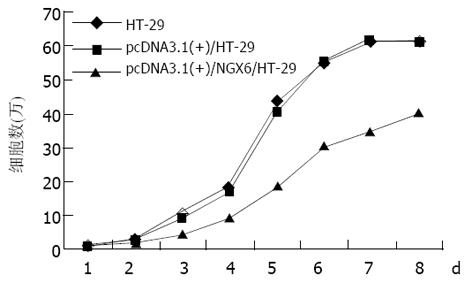
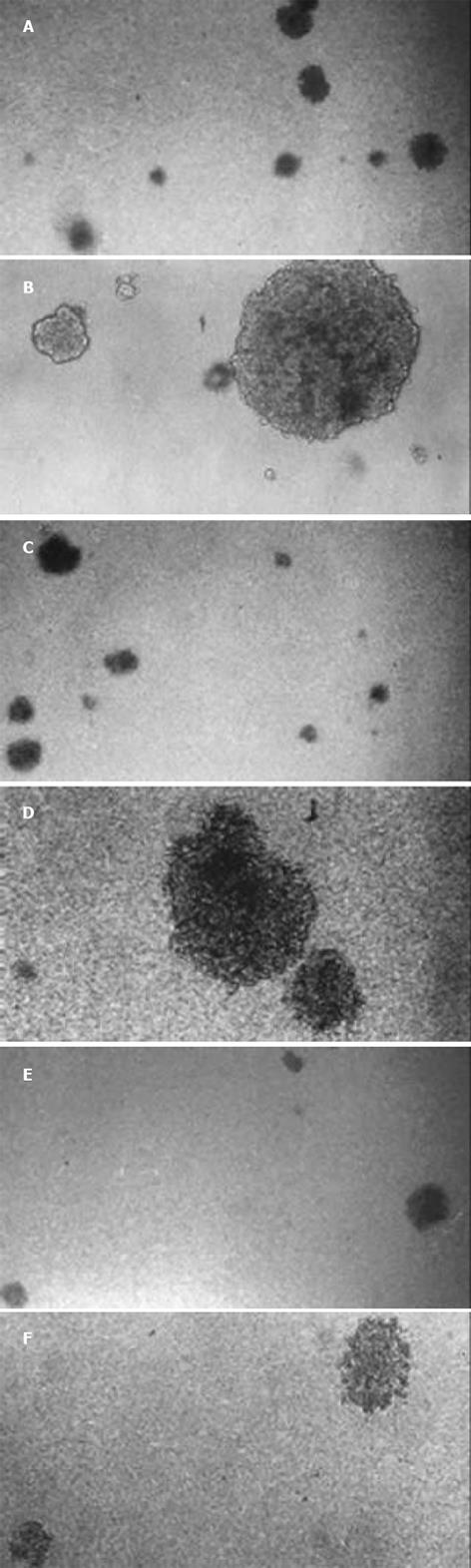
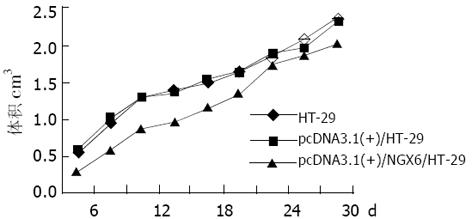
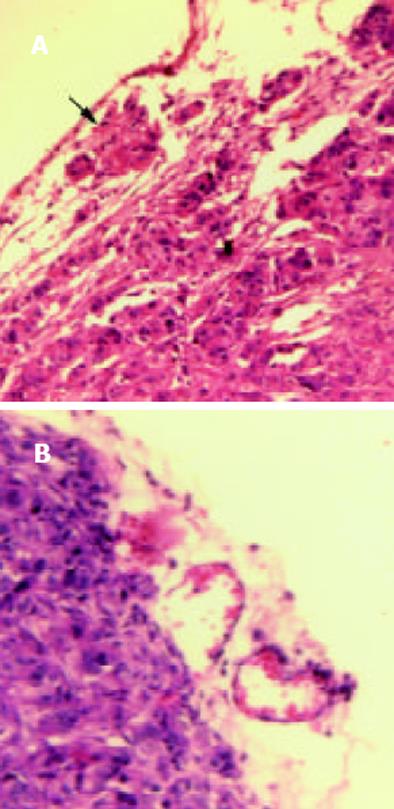
绘制pcDNA3.1(+)/NGX6/HT-29, pcDNA3.1(+)/HT-29和HT-29三组细胞的生长曲线(图5), 结果表明pcDNA3.1(+)/NGX6/HT-29组细胞的生长速度比pcDNA3.1(+)/HT-29和HT-29组明显降低, t检验和方差分析(P<0.05). 根据公式TD=t×Log2/(LogNT-LogN0)得出pcDNA3.1(+)/NGX6/HT-29、pcDNA3.1(+)/HT-29和HT-29组的倍增时间分别为34.5 h、27.1 h和23.0 h(图6). 酶联免疫检测仪测定96孔板中3组细胞分别在490 nm波长处的吸光度, 结果表明pcDNA3.1(+)/HT-29和HT-29组的吸光值明显较pcDNA3.1(+)/NGX6/HT-29组高, HT-29、pcDNA3.1(+)/HT-29 和pcDNA3.1(+)/ NGX6/HT-29组吸光度mean±SD分别为0.67±0.07, 0.64±0.05, 0.50±0.04, 统计学分析(t检验和方差分析)(P<0.05), 表明pcDNA3.1(+)/NGX6/HT-29组细胞生长速度较另外两组明显减慢. pcDNA3.1(+)/NGX6/HT-29、pcDNA3.1(+)/HT-29和HT-29组的平均集落形成率分别为4.11%, 10.54%和9.69%, 阳性组克隆形成率明显降低(P<0.05)(图7), 且pcDNA3.1(+)/NGX6/HT-29组集落生长速度较pcDNA3.1(+)/HT-29和HT-29组慢, 集落体积小, 克隆存活时间缩短. 上述结果表明在体外NGX6基因能抑制人结肠癌细胞HT-29的增生. 流式细胞仪检测结果显示3组细胞凋亡率无明显差别; pcDNA3.1(+)/NGX6/HT-29、pcDNA3.1(+)/HT-29和HT-29组G1/G0期细胞分布的百分比分别为61.8%、38.1%和40.85%, 3组细胞S期的百分比分别为13.0%, 23.0%和23.8%, 表明NGX6转染后能延缓HT-29细胞周期由G1→S期的进程. 将pcDNA3.1(+)/NGX6/HT-29, pcDNA3.1(+)/HT-29和HT-29三组细胞分别注射3组裸鼠, 每组3只, 每只裸鼠接种3×107个肿瘤细胞, 4-5 d可见到皮下包块, HT-29和pcDNA3.1(+)/HT-29组肿块生长速度较快, 且于15 d时肿块坏死脱落; pcDNA3.1(+)/NGX6/HT-29组的肿块生长较慢, 瘤体从24 d开始坏死(图8). 3组移植瘤石蜡切片HE染色显示均为低分化腺癌, 无组间差别. pcDNA3.1(+)/HT-29组移植瘤HE染色发现肿瘤包膜断裂, 瘤体内有血管瘤栓形成, 而pcDNA3.1(+)/NGX6/HT-29组血管壁结构完整, 未见瘤细胞浸润(图9).
结肠癌的发生涉及到瘤基因的激活和抑瘤基因的失活[22-23]. Vogelstein实验室建立了经典的"APC→K-ras→DCC→p53→nm23"的结肠癌发病机制模式[24], 但结肠癌的发生存在多样性[25]. NGX6基因(AF188239)是新克隆的侯选抑瘤基因, 生物信息学预测NGX6位于染色体的9p11.1-12区域, cDNA全长2.1 Kb, 基因编码338个氨基酸, 具有两个跨膜结构, 一个EGF-like domain, 多个N-糖基化位点和多个酪氨酸磷酸激酶位点[26]. EGFR与结肠癌的恶性转化、增生、浸润及不良预后有密切关系[27-31]. 最近Williams在结肠癌中克隆了2个具有EGF-like domain的新基因, 其明显地能抑制结肠癌的增生[32]. 上述研究提示NGX6是否通过影响结肠癌中EGFR的活性发挥抑瘤作用?已有研究表明NGX6表达变化与结肠癌的发生、转移呈负相关[33]. 为进一步明确NGX6对结肠癌增生的影响, 将NGX6基因通过脂质体介导转染入NGX6低表达的人结肠癌细胞系HT-29, 建立NGX6稳定表达的人结肠癌细胞系, 探讨NGX6在结肠癌发生、发展中的作用. 结果显示pcDNA3.1(+)/NGX6/HT-29组结肠癌细胞较pcDNA3.1(+)/HT-29和HT-29组细胞生长缓慢, pcDNA3.1(+)/NGX6/HT-29细胞的倍增时间(34.5 h)比pcDNA3.1(+)/HT-29和HT-29组倍增时间 (27.1 h和23.0 h)延长; 软琼脂集落形成实验发现pcDNA3.1(+)/NGX6/HT-29组克隆形成率较对照组降低, 克隆体积减小, 克隆存活时间缩短, 强烈表明NGX6重表达可明显地抑制人结肠癌细胞HT-29的克隆形成力. 裸鼠成瘤实验显示pcDNA3.1(+)/NGX6/HT-29组的移植瘤体积有所缩小, 但统计学无明显差别, 可能与每只裸鼠接种瘤细胞数量较多、实验动物较少或与肿瘤在裸鼠体内生长环境复杂, 尚受到其他生长因子刺激有关. 移植瘤病理切片HE染色示3组均为低分化腺癌, 无组间差异. 值得关注的是, pcDNA3.1(+)/HT-29组的病理切片中发现有血管瘤栓形成, 瘤体包膜断裂; pcDNA3.1(+)/NGX6/HT-29组无此现象. 已有研究表明NGX6在有转移的结肠癌组织中较无转移的结肠癌组织中表达明显下调, 上述结果提示NGX6可能具有抑制结肠癌转移的作用.
肿瘤是一种细胞周期性疾病[34]. 细胞周期能否启动进入细胞增生, 其主要在于能否通过G1/S检测点, 细胞一旦通过该检测点, 既使在缺乏生长因子刺激的条件下, 细胞也能在cyclins和CDK的驱动下完成该细胞周期[35], 所以G1/S检测点在肿瘤增生中发挥着关键的作用[36-39]. 为明确NGX6对结肠癌细胞周期的影响, 采用流式细胞仪检测NGX6转染前后人结肠癌细胞HT-29在细胞周期中的分布, 发现pcDNA3.1(+)/NGX6/HT-29细胞在G0/G1期的细胞数明显增加, S期减少. NGX6转染后G0/G1期与S期细胞数的比值为转染前比值的2.24倍, 形成G0/G1期阻滞, 表明NGX6明显延缓人结肠癌细胞HT-29细胞周期由G1→S期的进程, 纠正细胞的失控性增长, 逆转人结肠癌细胞的恶性表型. 综上所述, 新侯选抑瘤基因NGX6可抑制人结肠癌细胞系HT-29增生. NGX6符合抑瘤基因的基本条件: (1)基因在相应的正常组织中表达; (2)在肿瘤组织中有该基因功能失活或结构改变或表达缺陷; (3)将基因野生型导入基因异常的肿瘤细胞内, 可全部或部分改变其恶性表型. 因此NGX6为新的结肠癌相关抑瘤基因. 同时研究还发现NGX6可能具有结肠癌转移抑制作用, 目前正在进行进一步的研究以明确NGX6在结肠癌转移中的作用.
编辑: N/A
| 1. | Cheng L, Lai MD. Aberrant crypt foci as microscopic precursors of colorectal cancer. World J Gastroenterol. 2003;9:2642-2649. [PubMed] [DOI] |
| 2. | Ji CY, Smith DR, Goh HS. Prognostic significance of p53 overexpression and mutation in colorectal adeno carcinomas. Br J Cancer. 1996;74:216-223. [PubMed] [DOI] |
| 4. | Fang JY, Lu J, Chen YX, Yang L. Effects of DNA methylation on expression of tumor suppressor genes and proto- oncogene in human colon cancer cell lines. World J Gastroenterol. 2003;9:1976-1980. [PubMed] [DOI] |
| 5. | Yan W, Wang WL, Zhu F, Chen SQ, Li QL, Wang L. Isolation of a novel member of small G protein suprefamily and its expression in colon cancer. World J Gastroenterol. 2003;9:1719-1724. [PubMed] [DOI] |
| 6. | Cai KL, Wang GB, Xiong LJ. Effects of carbon dioxide and nitrogen on adhesive growth and expression of E-cadherin and VEGF of human colon cancer cell CCL-228. World J Gastroenterol. 2003;9:1594-1597. [PubMed] [DOI] |
| 7. | Zhu JW, Yu BM, Ji YB, Zheng MH, Li DH. Upregulation of vascular endothelial growth factor by hydrogen peroxide in human colon cancer. World J Gastroenterol. 2002;8:153-157. [PubMed] [DOI] |
| 10. | 王 小军, 马 庆久, 赖 大年, 黎 成金, 李 金茂, 武 永忠, 王 青. 胃泌素拮抗剂增加CD自杀基因对结直肠癌细胞的杀伤作用. 世界华人消化杂志. 2003;11:1385-1388. [DOI] |
| 11. | Clarke LE, Leitzel K, Smith J, Ali SM, Lipton A. Epidermal growth factor receptor mRNA in peripheral blood of patients with pancreatic, lung, and colon carcinomas detected by RT-PCR. Int J Oncol. 2003;22:425-430. [PubMed] [DOI] |
| 15. | Khorana AA, Ryan CK, Cox C, Eberly S, Sahasrabudhe DM. Vascular endothelial growth factor, CD68, and epidermal growth factor receptor expression and survival in patients with Stage II and Stage III colon carcinoma: a role for the host response in prognosis. Cancer. 2003;97:960-968. [PubMed] [DOI] |
| 16. | Goldstein NS, Armin M. Epidermal growth factor receptor immunohistochemical reactivity in patients with American joint committee on cancer stage IV colon adenocarcinoma: implications for a standardized scoring system. Cancer. 2001;92:1331-1346. [PubMed] [DOI] |
| 17. | Gainet M, Guardiola E, Dufresne A, Pivot X. Epidermal growth factor receptors (EGFR): a new target for anticancer therapy. Cancer Radiother. 2003;7:195-199. [PubMed] [DOI] |
| 18. | Xiong W, Zeng ZY, Li XL. Single-nucleotide polymorphisms in NGX6 gene and their correlation with nasopharyngeal carcinoma. Shengwu Huaxue Yu Shengwu Wuli Xuebao. 2002;34:512-515. [PubMed] |
| 19. | 李 江, 谭 琛, 向 秋. 用双向电泳和质谱技术检测NGX6转染后人鼻咽癌细胞表达差异的蛋白质. 生物化学与生物物理进展. 2001;28:573-578. |
| 23. | Watanabe N. Oncogene and tumor suppressor gene. Rinsho Byori. 2002;123:131-136. [PubMed] |
| 24. | Zajac V, Tomka M, Ilencikova D, Majek P, Stevurkova V, Kirchhoff T. A double germline mutations in the APC and p53 genes. Neoplasma. 2000;47:335-341. [PubMed] |
| 25. | Vecsey-Semjen B, Becker KF, Sinski A, Blennow E, Vietor I, Zatloukal K, Beug H, Wagner E, Huber LA. Novel colon cancer cell lines leading to better understanding of the diversity of respective primary cancers. Oncogene. 2002;21:4646-4662. [PubMed] [DOI] |
| 27. | Takahashi Y, Ellis LM, Wilson MR, Bucana CD, Kitadai Y, Fidler IJ. Progressive upregulation of metastasis-related genes in human colon cancer cells implanted into the cecum of nude mice. Oncol Res. 1996;8:163-169. [PubMed] |
| 28. | Mendelsohn J. The epidermal growth factor receptor as a target for cancer therapy. Endocr Relat Cancer. 2001;8:3-9. [PubMed] [DOI] |
| 29. | Radinsky R, Risin , Fan , Dong , Bielenberg , Bucana , Fidler . Level and function of epidermal growth factor receptor predict the metastatic potential of human colon carcinoma cells. Clin Cancer Res. 1995;1:19-31. |
| 30. | De Jong KP, Stellema R, Karrenbeld A, Koudstaal J, Gouw AS, Sluiter WJ, Peeters PM, Slooff MJ, De Vries EG. Clinical relevance of transforming growth factor alpha, epidermal growth factor receptor, p53, and Ki67 in colorectal liver metastases and corresponding primary tumors. Hepatology. 1998;28:971-979. [PubMed] [DOI] |
| 31. | Parker C, Roseman BJ, Bucana CD, Tsan R, Radinsky R. Preferential activation of the epidermal growth factor receptor in human colon carcinoma liver metastases in nude mice. J Histochem Cytochem. 1998;46:595-602. [PubMed] [DOI] |
| 32. | Williams SJ, McGuckin MA, Gotley DC, Eyre HJ, Sutherland GR, Antalis TM. Two novel mucin genes down-regulated in colorectal cancer identified by differential display. Cancer Res. 1999;59:4083-4089. [PubMed] |
| 33. | Zhang XM, Wang XY, Sheng SR, Wang JR, Li J. Expression of tumor related genes NGX6, NAG 7 BRD7 in gastric cancer and colonorectal cancer. World J Gastroenterol. 2003;9:1729-1733. [PubMed] [DOI] |
| 36. | Bartkova J, Rajpert-De Meyts E, Skakkebaek NE, Lukas J, Bartek J. Deregulation of the G1/S-phase control in human testicular germ cell tumours. APMIS. 2003;111:252-265. [PubMed] [DOI] |
| 37. | Blagosklonny MV, Pardee AB. The restriction point of the cell cycle. Cell Cycle. 2002;1:103-110. [PubMed] [DOI] |
| 38. | Michalides RJ, van de Brekel M, Balm F. Defects in G1-S cell cycle control in head and neck cancer: a review. Head Neck. 2002;24:694-704. [PubMed] [DOI] |
| 39. | Malumbres M, Barbacid M. To cycle or not to cycle: a critical decision in cancer. Nat Rev Cancer. 2001;1:222-231. [PubMed] [DOI] |