修回日期: 2003-09-25
接受日期: 2003-10-22
在线出版日期: 2004-03-15
目的: 了解Survivin基因表达与肝硬化细胞增生活性的关系, 探讨测定Survivin基因和增生细胞核抗原(PCNA)在肝硬化患者中发现肝癌高危人群的意义.
方法: 以RNA提取试剂获得新鲜肝癌及肝硬化组织RNA, 应用RT-PCR法测定Survivin基因mRNA; 应用抗-PCNA单克隆抗体, 以SP免疫组织化学方法测定肝硬化和肝癌组织中的PCNA.
结果: 测定21例肝硬化组织, Survivin表达全部阴性, 17例肝癌组织, Survivin基因阳性11例, 阳性率为64.7%. 11例Survivin阳性肝癌组织PCNA阳性计数平均值为6.8 (0.5-40), 显著高于6例Survivin阴性肝癌组织2.15 (0.5-3.0). 而21例肝硬化组织和5例正常肝组织对照PCNA计分分别为2.47和1.56. 以5例正常肝组织PCNA阳性细胞计数的2倍(3.12)作为细胞高增生活性标准, 测定30例肝硬化组织, 有6例处于高增生状态, 其平均PCNA计数为5.05±2.61, 细胞增生活性介于其余肝硬化组织和肝癌组织之间.
结论: Survivin基因仅在肝癌组织表达, 其表达具有高度肿瘤选择性. 肝癌细胞增生活性较肝硬化明显升高, 其升高程度与Survivin基因的表达有关, 增生活性越高该基因的表达阳性率越高. PCNA可以很方便的用于肝硬化组织细胞增生活性的评价, 在确定肝硬化人群肝癌发生高危患者方面PCNA的测定优于Survivin基因的测定.
引文著录: 贾克东, 石淑仙, 阮幼冰. 肝硬化和肝癌肝组织Survivin基因表达与增生的关系. 世界华人消化杂志 2004; 12(3): 550-554
Revised: September 25, 2003
Accepted: October 22, 2003
Published online: March 15, 2004
AIM: To evaluate the usefulness of detection of cell proliferation and survivin gene in choosing liver cirrhosis patients with extremely dangerous for HCC development.
METHODS: Total RNA was extracted from fresh specimens of HCC and liver cirrhosis. Survivin mRNA amplification was performed by reverse transcription polymerase chain reaction (RT-PCR). Immunostaining for proliferating cell nuclear antigen (PCNA) was employed to assess liver cell proliferative activity in formalin-fixed, paraffin-embedded liver specimens. PCNA immunostaining in liver cells of HCC and cirrhosis fresh and archive specimens was performed with monoclonal antibodies directed against CD10. Five liver specimens removed from patients with hemangioma were taken as controls. The PCNA labeling index was determined by positive cells in each microscopic field (200×) obtained from mean value of positive cells in ten different fields.
RESULTS: RT-PCR was performed in 17 HCC and 21 liver cirrhosis specimens, 11 HCC specimens showed 344 bps molecular survivin DNA band in 1% agarose electrophoresis, but none of liver cirrhosis specimens showed positive band. The survivin positive rate in HCC specimens was 64.7% (11/17). The median PCNA labeling index of 11 survivin positive HCC specimens was 6.8 (from 0.5 to 40), which was significantly higher than that of 6 survivin negative HCC specimens (2.15), while that of 21 LC and 5 normal liver specimens were 2.47 and 1.56 respectively. By using a cutoff of PCNA labeling index (3.12) obtained by two times of the index value in normal liver specimens, six specimens of 30 liver cirrhosis patients with mean PCNA labeling index 5.05±2.61 were considered high proliferative activity.
CONCLUSION: Expression of survivin is detected in HCC tissues but not in liver cirrhosis tissues, indicating that the gene expression may occur at the late phase of HCC transformation. The PCNA detection can be a good mean in screening the high-risk people with elevated possiblity of HCC development among liver cirrhosis patients.
- Citation: Jia KD, Shi SX, Ruan YB. Relationship between expression of survivin gene and proliferation of hepatocytes in liver cirrhosis and hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 550-554
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.550
肝癌(HCC)是肝硬化(LC)自然病程的一部分, 大约每年平均有3%-10%的LC患者转化为HCC, HCC中大约有80%的合并有LC的存在, 因此LC患者是HCC发生的高危人群[1-5]. 在LC人群中确定危险因子, 以便进一步发现高危患者, 进行严密的随访, 可及时发现早期HCC [6-11]. Survivin基因是一种凋亡抑制基因, 研究发现该基因在癌组织中表达增强[12-16]. 应用RT-PCR技术和免疫组织化学技术对HCC和LC组织中Survivin基因和增生细胞核抗原(PCNA)进行了测定, 以了解Survivin基因在LC组织中表达的情况, 以及该基因与LC组织细胞增生的关系, 进一步探讨该基因和PCNA在LC患者中发现HCC高危人群及HCC早期诊断的价值.
2001-03/2002-04期间因肝炎后LC手术新鲜肝脏组织21例, 男17例, 女4例, 33-62(平均年龄为36), 有消化道出血病史16例, 有脾功能亢进6例, 肝功能 Child-Pugh A级 7例, B级 12例, C级 2例. 新鲜HCC患者组织标本21例, 男16例, 女5例, 29-63 (平均年龄45), 肿瘤直径大于10 cm 5例, 多发6例. 正常肝组织5例来自肝血管瘤手术切除患者. 标本迅速置于1 g/L DEPC处理的0.01 mol/L PBS配制的40 g/L多聚甲醛溶液中固定2-4 h, 然后一部分常规进行石蜡包埋、切片; 一部分置于-70 ℃冰箱中保存供提取RNA用. 病理室保存标本: HCC及LC组标本各30例均取自同济医院1998/2000年存档的石蜡块标本. 所有组织切片均经常规HE染色, 镜下对原始诊断进行复核. 对LC患者肝组织肝纤维化程度进行评分, 评分标准除窦周间隙纤维化未计入外, 其余基本参照Chevallier SSS评分法(Hepatology 1994; 20: 349-355)进行. 对HCC患者肝组织根据细胞分化程度参照Edmondson分级法(肝病的现代诊断与治疗. 北京: 中国医学科技出版社, 2001: 581-582)分为4级. 全部评价过程均由一位资深病理专业教授协助完成.
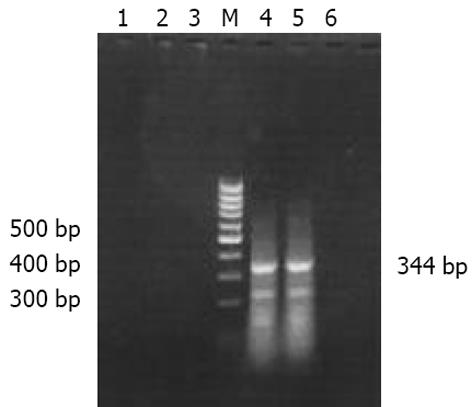
1.2.1 RT-PCR: 应用RNA提取试剂(Omega公司), 取新鲜肝组织50-100 mg提取总RNA, 方法按说明书进行. 提取RNA置-70 ℃储存备用. 引物设计 自GenBank中共获得7个Survivin cDNA序列, 其中5个为429个碱基组成, 选择同源性最大序列如下: A TGGGTGCCCC GACGTTGCCC CCTGCCTGGC AGCCCTTTCT CAAGGACCAC CGCATCTCTA CATTCAAGAA CTGGCCCTTC TTGGAGGGCT GCGCCTGCAC CCCGGAGCGG ATGGCCGAGG CTGGCTTCAT CCACTGCCCC ACTGAGAACG AGCCAGACTT GGCCCAGTGT TTCTTCTGCT TCAAGGAGCT GGAAGGCTGG GAGCCAGATG ACGACCCCAT AGAGGAACAT AAAAAGCATT CGTCCGGTTG CGCTTTCCTT TCTGTCAAGA AGCAGTTTGA AGAATTAACC CTTGGTGAAT TTTTGAAACT GGACAGAGAA AGAGCCAAGA ACAAAATTGC AAAGGAAACC AACAATAAGA AGAAAGAATT TGAGGAAACT GCGGAGAAAG TGCGCCGTGC CATCGAGCAG CTGGCTGCCA TGGATTGA. 应用计算机辅助软件根据上述序列, 设计引物如下: 上游引物 5'-CCA CCG CAT CTC TAC ATT C-3'97-115base); 下游引物 5'-CTT TCT CCG CAG TTT CCT C-3'422-440 base). 引物总长度为19 bp, 拟扩增DNA片断长度为344 bp . Survivin cDNA的合成反应总体积为20 L, 其中模板RNA 3 L(约1-3 g), 下游引物1 L (50 pmoL), RNA酶抑制剂0.5 L, dNTP 1.25 L, M-MLV逆转录酶1 L (3 334 nkat), H2O 13.25 L, 42 ℃反应60 min, 然后99 ℃ 5 min. Survivin DNA PCR扩增反应总体积为50 L, 包括cDNA模板10 L, PCR buffer 5 L, 上游引物1 L (50 pmoL), 去离子水33 L, 95 ℃ 10 min, 然后加入Tag酶1 L (33 nkat), 石蜡油覆盖, 反应条件为94 ℃ 2 min, 94 ℃, 30 s变性, 55 ℃ 30 s退火, 72 ℃ 60 s延伸, 共循环30次, 最后一次72 ℃延伸5 min.
1.2.2 PCNA免疫组织化学: 鼠抗PCNA单克隆抗体PC10(MBI产品, MAB-0145), 购自福州迈新生物技术开发公司. 免疫组织化学应用北京中山生物技术公司生产的SP染色试剂盒, 方法参照说明书进行, 简述如下: 组织切片依次经常规二甲苯脱蜡、梯度乙醇水合, PBS冲洗后置3 mL/L H2O2中, 室温下30 min, 以封闭内源性过氧化酶, 滴加正常血清封闭液, 15 min, 甩干后滴加抗PCNA单克隆抗体, 37 ℃孵育2 h, PBS冲洗, 5 min 3次, 然后依次按说明书加入生物素化二抗工作液、辣根酶标记链霉卵白素工作液, 最后DAB显色. 显微镜下观察每份组织片PCNA染色情况, 每份标本在高倍视野(200×)下分别观察10个视野, 计数每个视野的阳性细胞总数, 最后取平均值作为每份标本的PCNA染色计分.
21例HCC组织, 有11例成功扩增出分子量为344 bp的Survivin特异性条带. 进一步应用HE染色对扩增阴性的10例HCC组织进行检查, 发现其中3例光镜下未见到癌组织, 1例仅见到坏死组织, 因此考虑此4例组织取材不准, 其余17例HCC组织, Survivin阳性率为64.7%(11/17). 10例LC组织RT-PCR无1例扩增出阳性条带(图1).
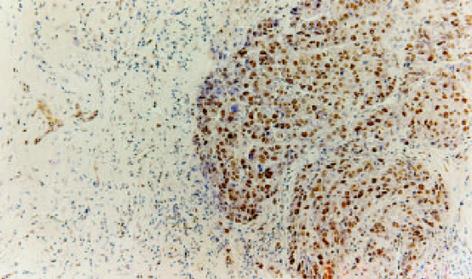
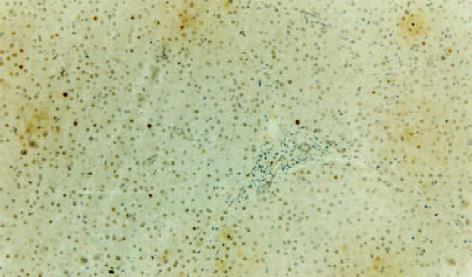
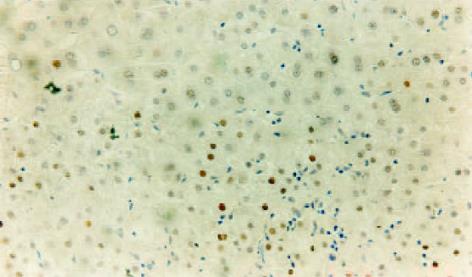
LC组织与HCC组织PCNA阳性染色全部位于细胞核, 阳性细胞核着色呈棕黄色, 其中前者PCNA阳性细胞以簇状分布为主, 少数散在分布于再生结节的周围, 而后者PCNA阳性细胞多数在癌组织内呈弥漫性均匀分布, 且癌结节周围的边缘性聚集现象表现明显(图2-4). 比较30例LC组织及30例HCC组织的PCNA测定结果, HCC组织肝细胞的增生活性明显高于LC组织, 其PCNA阳性计分分别为10.1±12.3和2.4±2.1, 二者比较统计学显示有显著性差异(P = 0.003). 5例正常肝组织PCNA阳性细胞计数分别为0.5, 1.2, 2.3, 2.0, 1.8, 平均值为1.56, 以平均值的2倍作为肝组织高增生状态的标准, 30例LC组织中有6例存在高增生状态, 其PCNA阳性细胞计数分别为3.7, 4.1, 10.1, 3.5, 3.3, 5.6, 平均值为5.0±2.6, 其增生活性介于LC低增生组和HCC组之间(P<0.05). 24例低增生LC患者肝组织PCNA阳性细胞计数与正常肝组织比较无明显差异(P>0.05). 同时将19例LC组织进行纤维化程度SSS评分, 与PCNA测定结果进行配对比较, 相关性分析显示二者无明显相关性, 相关系数r = 0.337, P = 0.159, 证明LC组织肝细胞的增生与肝脏纤维化程度无关.
HCC组织按细胞分化程度分为Ⅰ-Ⅳ级, HCC各级PCNA计分分别为3.7, 9.74, 14.36, 15.7, 进行Spearman等级相关分析, 相关系数r = 0.74, P<0.001. 提示肝癌细胞的增生活性与恶性程度成正相关.
11例Suvivin阳性的HCC组织PCNA阳性计数为6.8 (0.5-40), 6例Survivin阴性HCC组织PCNA阳性计数为2.1 (0.5-3.0), 二者相比有显著性差异(P<0.05), 证明肝癌组织Survivin基因的表达与细胞增生活性升高有关.
研究发现肝癌形成过程中, 肝细胞增生活性的升高和凋亡水平的下降共同发挥了重要的作用[17-18], 但是与细胞凋亡变化相比细胞增生活性的升高是主要的[19-20]. 已经证实LC组织本身存在O6-甲基鸟嘌呤修复酶的缺陷, 基础研究显示O6-甲基鸟嘌呤如果不能及时修复容易造成基因突变, 进而引起癌基因的活化和抑癌基因的失活, 最终导致HCC的发生, LC 患者修复酶的缺陷使O6-甲基鸟嘌呤持续存在, 加上肝细胞增生活性的增强, 构成了LC组织HCC发生的分子生物学基础(J Hepatobiliary Pancreat Surg 1998; 5: 355-366).
临床资料证实LC患者肝细胞增生活性的升高是HCC发生的最重要危险因子, Donato et al[21] 以PCNA作为细胞增生指标对208例肝硬化患者的肝脏组织标本的细胞增生情况进行了分析, 然后进行了为期88 mo±42 mo的前瞻性研究, 发生肝癌的50例患者和158例未发生肝癌的患者PCNA指数为分别为3.6%±2.4%和 1.6%±1.5%. 以研究起始PCNA指数2%为标准, 将患者分为高危险组和低危险组, 结果80例PCNA大于2%的高危险组患者, HCC年发生率为5.2%, 而PCNA小于2%的低危险组患者发生率仅为1.1%. Sangiovannio et al[22]以流式细胞仪测定研究起始肝硬化组织标本细胞处于增生周期S期的比值, 随访97例肝硬化患者, 平均随访时间为53 mo, 结果共发生HCC 12例, 12例肝癌患者为2.5%±1.6%, 显著高于未发生肝癌的肝硬化患者(0.9%±0.6%), 以S期细胞大于或等于1.8%将患者分为细胞高增生组和低增生组, 高增生组HCC发生率为60%, 而低增生组为4%, 进一步证明肝硬化患者细胞增生活性升高是肝癌发生的危险因素.
我们应用针对PCNA的PC10单克隆抗体的免疫组织化学技术, 通过对30例LC和30例HCC组织的研究, 结果显示HCC组织肝细胞增生活性明显高于LC组织, 其PCNA计数分别为10.08和2.38, 显示了肝细胞增生在HCC进展中的作用. 在LC组织中有20%(6例)患者PCNA计数超过正常肝组织的2倍, 其增生活性虽低于HCC组织, 但与其他LC组织及正常肝组织相比均显著升高, 提示存在HCC发生的高度危险性, 应进行严密的临床随访, 以及早发现HCC的发生. 我们发现肝细胞的PCNA阳性细胞指数与肝组织纤维化程度的SSS评分无明显相关性, 相关系数r = 0.337, P>0.05, 证明LC组织肝细胞的增生活性与肝脏纤维化程度无关, 同时间接证明了LC患者HCC发生的直接原因是其他原因诱发的肝细胞高增生活性, 而不是肝纤维化本身.Survivin基因是近年来研究的一个重要凋亡抑制基因, 与其他凋亡抑制基因不同, 其表达具有很强的组织特异性, 在胚胎性组织及包括胃癌[23]、乳腺癌[24]、结直肠癌[25]、胰腺癌[26]等大多数的肿瘤组织中表达, 但在正常发育成熟的组织不表达. 除了抗凋亡的功能外, 最近研究显示.
Survivin基因的表达与HCC患者细胞增生活性的增强有关, 通过对细胞增生凋亡平衡的破坏, 在肝癌发生过程中发挥重要的作用[27-28]. Ito et al[29]应用免疫组织化学测定20例HCC组织, 结果显示Survivin蛋白阳性14例, 而在相应的周围慢性肝炎和LC组织中均未发现该蛋白的表达. 陈涛et al[28]应用上述同样方法测定48例HCC, 结果Survivin蛋白表达阳性率为64.6%, 且表达阳性率与HCC恶性程度、细胞增生凋亡比成正相关. 我们测定17例HCC组织, Survivin基因表达阳性11例, 阳性表达率为64.7%(11/17), 11例Survivin阳性HCC组织平均PCNA计数为9.68±11.64, 显著高于6例Survivin阴性HCC组织(3.27±1.73), 与上述研究结果相一致, 进一步证明该基因的表达同时伴有肝细胞增生活性的升高. Survivin基因的表达是一个渐进过程, 在由癌前细胞向癌细胞转化过程中, 其表达水平逐渐升高, 组织学正常的组织, Survivin阳性提示正常细胞已经发生了向癌细胞的转变, 因而认为该基因的测定可以用于肿瘤的早期诊断[30]. 然而, Ikeguchi et al[27]曾经对61例HCC结节周围组织进行了测定, 结果Survivin基因表达全部阴性, 由此认为该基因的表达仅发生于LC组织中已经转化的癌细胞, 我们所观察的结果与上述结果一致, 21例LC组织Survivin基因表达全部阴性, 分析可能与本研究中的LC组织全部未出现癌性转变有关. 根据上述结果我们认为Survivin 基因表达的测定可以用于HCC的早期诊断, 但无法区分处于HCC发生高危阶段的LC患者.
肝细胞的增生与Survivin基因的表达不仅与HCC的发生有关, 而且也与HCC的预后和复发有关[21,31]. 我们测定17例HCC组织, 其中11例Survivin阳性HCC组织PCNA阳性计数显著高于6例阴性组织(P<0.05), 而且HCC细胞PCNA阳性计数与HCC分化程度呈正相关, 分化越差, PCNA计数越高, 充分说明二者在HCC预后方面具有较高的一致性. 鉴于Survivin基因的表达发生在HCC阶段, 推测处于HCC发生高危阶段的LC患者可能仅仅表现为细胞增生活性的增加, 而并未出现基因型的癌性改变, 故针对Survivin基因的测定不适合在LC患者中对HCC发生高危人群的筛选, 加之该方法步骤复杂, 技术要求和对组织的要求均较高, 因此我们认为该方法很难适用于临床应用. 而PCNA免疫组织化学技术可以有效测定LC患者肝细胞增生活性, 及时发现HCC高危人群, 配合影像学及血清学检查, 实现HCC的早期诊断.
编辑: N/A
| 1. | Wu GC, Zhou WP, Zhao YR, Guo SH, Wang ZY, Zou SB, Zhang QH, Ren H, Huang AL, Zhang DF. The natural history of chronic hepatitis B: a retrospective study. Hepatobiliary Pancreat Dis Int. 2003;2:566-570. [PubMed] |
| 2. | Kim YS, Um SH, Ryu HS, Lee JB, Lee JW, Park DK, Kim YS, Jin YT, Chun HJ, Lee HS. The prognosis of liver cirrhosis in recent years in Korea. J Korean Med Sci. 2003;18:833-841. [PubMed] [DOI] |
| 3. | Miyazawa K, Moriyama M, Mikuni M, Matsumura H, Aoki H, Shimizu T, Yamagami H, Kaneko M, Shioda A, Tanaka N. Analysis of background factors and evaluation of a population at high risk of hepatocellular carcinoma. Intervirology. 2003;46:150-156. [PubMed] [DOI] |
| 4. | Findor J, He XS, Sord J, Terg R, Gershwin ME. Primary biliary cirrhosis and hepatocellular carcinoma. Autoimmun Rev. 2002;1:220-225. [PubMed] [DOI] |
| 5. | Bolondi L, Sofia S, Siringo S, Gaiani S, Casali A, Zironi G, Piscaglia F, Gramantieri L, Zanetti M, Sherman M. Surveillance programme of cirrhotic patients for early diagnosis and treatment of hepatocellular carcinoma: a cost effectiveness analysis. Gut. 2001;48:251-259. [PubMed] [DOI] |
| 6. | McMahon BJ, Bulkow L, Harpster A, Snowball M, Lanier A, Sacco F, Dunaway E, Williams J. Screening for hepatocellular carcinoma in Alaska natives infected with chronic hepatitis B: a 16-year population-based study. Hepatology. 2000;32:842-846. [PubMed] [DOI] |
| 7. | Yuen MF, Cheng CC, Lauder IJ, Lam SK, Ooi CG, Lai CL. Early detection of hepatocellular carcinoma increases the chance of treatment: Hong Kong experience. Hepatology. 2000;31:330-335. [PubMed] [DOI] |
| 8. | Trevisani F, De NS, Rapaccini G, Farinati F, Benvegnu K, Zoli M, Grazi GL, Del PP, Di N, Bernardi M. Italian liver cancer group. Semiannual and annual surveillance of cirrhotic patients for hepatocellular carcinoma: effects on cancer stage and patient survival (Italian experience). Am J Gastroenterol. 2002;97:734-744. [PubMed] [DOI] |
| 9. | Henrion J, Libon E, De Maeght S, Deltenre P, Schapira M, Ghilain JM, Maisin JM, Heller FR. Screening for hepatocarcinoma in a cohort with cirrhosis mainly of alcoholic origin. Gastroenterol Clin Biol. 2003;27:534-539. [PubMed] |
| 10. | Chen TH, Chen CJ, Yen MF, Lu SN, Sun CA, Huang GT, Yang PM, Lee HS, Duffy SW. Ultrasound screening and risk factors for death from hepatocellular carcinoma in a high risk group in Taiwan. Int J Cancer. 2002;98:257-261. [PubMed] [DOI] |
| 11. | Goodman M, Ueyama N, Naider F. Conformational studies of alanine oligopeptides by nuclear magnetic resonance. Biopolymers. 1975;14:901-914. [DOI] |
| 12. | Gianani R, Jarboe E, Orlicky D, Frost M, Bobak J, Lehner R, Shroyer KR. Expression of survivin in normal, hyperplastic, and neoplastic colonic mucosa. Hum Pathol. 2001;32:119-125. [PubMed] [DOI] |
| 13. | Sarela AI, Scott N, Ramsdale J, Markham AF, Guillou PJ. Immunohistochemical detection of the anti-apoptosis protein, survivin, predicts survival after curative resection of stage II colorectal carcinomas. Ann Surg Oncol. 2001;8:305-310. [PubMed] [DOI] |
| 14. | O'Connor DS, Grossman D, Plescia J, Li F, Zhang H, Villa A, Tognin S, Marchisio PC, Altieri DC. Regulation of apoptosis at cell division by p34cdc2 phosphorylation of survivin. Proc Natl Acad Sci USA. 2000;97:13103-13107. [PubMed] [DOI] |
| 15. | Grossman D, Kim PJ, Schechner JS, Altieri DC. Inhibition of melanoma tumor growth in vivo by survivin targeting. Proc Natl Acad Sci USA. 2001;98:635-640. [PubMed] [DOI] |
| 16. | Mesri M, Wall NR, Li J, Kim RW, Altieri DC. Cancer gene therapy using a survivin mutant adenovirus. J Clin Invest. 2001;108:981-990. [PubMed] [DOI] |
| 17. | Park YN, Chae KJ, Kim YB, Park C, Theise N. Apoptosis and proliferation in hepatocarcinogenesis related to cirrhosis. Cancer. 2001;92:2733-2738. [PubMed] [DOI] |
| 18. | Chen GG, Lai PB, Chak EC, Xu H, Lee KM, Lau WY. Immunohistochemical analysis of pro-apoptotic Bid level in chronic hepatitis, hepatocellular carcinoma and liver metastases. Cancer Lett. 2001;172:75-82. [PubMed] [DOI] |
| 19. | Pizem J, Marolt VF, Luzar B, Cor A. Proliferative and apoptotic activity in hepatocellular carcinoma and surrounding non-neoplastic liver tissue. Pflugers Arch. 2001;442:R174-176. [PubMed] [DOI] |
| 20. | Paiva C, Oshima CT, Lanzoni VP, Forones NM. Apoptosis, PCNA and p53 in hepatocellular carcinoma. Hepatogastroenterology. 2002;49:1058-1061. [PubMed] |
| 21. | Donato MF, Arosio E, Del Ninno E, Ronchi G, Lampertico P, Morabito A, Balestrieri MR, Colombo M. High rates of hepatocellular carcinoma in cirrhotic patients with high liver cell proliferative activity. Hepatology. 2001;34:523-528. [PubMed] [DOI] |
| 22. | Sangiovanni A, Colombo E, Radaelli F, Bortoli A, Bovo G, Casiraghi MA, Ceriani R, Roffi L, Redaelli A, Rossini A. Hepatocyte proliferation and risk of hepatocellular carcinoma in cirrhotic patients. Am J Gastroenterol. 2001;96:1575-1580. [PubMed] [DOI] |
| 23. | Krieg A, Mahotka C, Krieg T, Grabsch H, Muller W, Takeno S, Suschek CV, Heydthausen M, Gabbert HE, Gerharz CD. Expression of different survivin variants in gastric carcinomas: first clues to a role of survivin-2B in tumour progression. Br J Cancer. 2002;86:737-743. [PubMed] [DOI] |
| 24. | Tanaka K, Iwamoto S, Gon G, Nohara T, Iwamoto M, Tanigawa N. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas. Clin Cancer Res. 2000;6:127-134. [PubMed] |
| 25. | Sarela AI, Macadam RC, Farmery SM, Markham AF, Guillou PJ. Expression of the antiapoptosis gene, survivin, predicts death from recurrent colorectal carcinoma. Gut. 2000;46:645-650. [PubMed] [DOI] |
| 26. | Satoh K, Kaneko K, Hirota M, Masamune A, Satoh A, Shimosegawa T. Expression of survivin is correlated with cancer cell apoptosis and is involved in the development of human pancreatic duct cell tumors. Cancer. 2001;92:271-278. [PubMed] [DOI] |
| 27. | Ikeguchi M, Ueta T, Yamane Y, Hirooka Y, Kaibara N. Inducible nitric oxide synthase and survivin messenger RNA expression in hepatocellular carcinoma. Clin Cancer Res. 2002;8:3131-3136. [PubMed] |
| 29. | Ito T, Shiraki K, Sugimoto K, Yamanaka T, Fujikawa K, Ito M, Takase K, Moriyama M, Kawano H, Hayashida M. Survivin promotes cell proliferation in human hepatocellular carcinoma. Hepatology. 2000;31:1080-1085. [PubMed] [DOI] |