修回日期: 2003-10-20
接受日期: 2003-11-19
在线出版日期: 2004-02-15
目的: 初步研究尼美舒利对培养结肠癌细胞生长及其ICAM-1 mRNA表达的作用.
方法: 以人结肠癌细胞株HT-29, HCT-116为研究对象, 体外药物敏感试验(MTT)法检测尼美舒利对肿瘤细胞的增生抑制效应; RT-PCR方法检测尼美舒利作用前后细胞ICAM-1 mRNA表达的变化.
结果: 尼美舒利对结肠癌细胞HT-29、HCT-116生长抑制作用呈时间、剂量依赖性方式, 对HT-29细胞抑制效果强于HCT-116细胞.尼美舒利下调HT-29细胞ICAM-1 mRNA表达, 而对HCT-116细胞ICAM-1 mRNA的表达无显著作用.
结论: 尼美舒利可明显抑制结肠癌细胞HT-29生长, 提示NIM可能通过抑制COX-2酶活性, 下调细胞ICAM-1的表达, 从而降低癌细胞播散及转移几率.
引文著录: 刘伟, 张超. 尼美舒利对结肠癌细胞ICAM-1 mRNA表达的影响. 世界华人消化杂志 2004; 12(2): 477-479
Revised: October 20, 2003
Accepted: November 19, 2003
Published online: February 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 477-479
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.477
研究发现非甾体类抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)可抑制环氧合酶(cyclooxygenase, COX)活性, 拮抗结肠肿瘤形成.结肠癌的转移及复发可能与COX-2的高表达有关[1-2]. 细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)是体内重要的免疫活性分子, 有关ICAM-1与肿瘤侵袭转移的关系是近年来研究的热点[3]. 本试验应用COX-2选择性抑制剂-尼美舒利 (nimesulide, NIM) 作用于结肠腺癌细胞, 通过检测肿瘤细胞的增生及细胞ICAM-1 mRNA表达情况, 初步探讨COX-2选择性抑制剂对结肠癌侵袭转移的作用机制.
DMEM培养基、小牛血清(Gibco公司)、MTT、DMSO、NIM(Sigma公司)、CO2培养箱(Thermo Forma公司), 人结肠癌细胞株HT-29 (COX-2高表达)和HCT-116 (COX-2低表达).
HT-29和HCT-116细胞于含100 mL/L小牛血清的DMEM液中培养, 置37 ℃, 50 mL/L CO2培养箱中, 取对数生长期的细胞备实验之用.
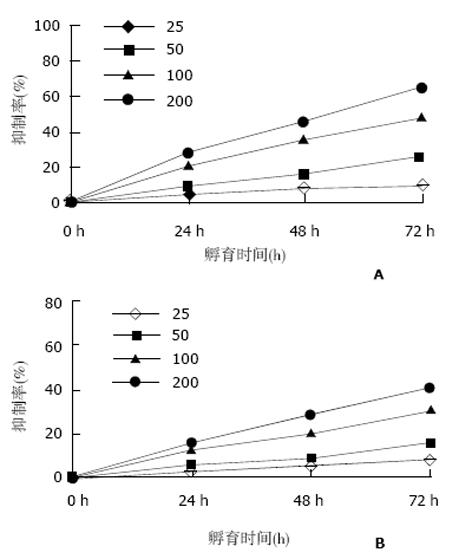
1.2.1 体外药物敏感试验: 噻唑蓝(MTT)法: 取两种细胞接种于96孔板中, 加入NIM原液, 使终浓度为25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L, 设加溶剂DMSO对照组, 继续培养24 h、48 h和72 h, 加入MTT液, 孵育4 h后弃上清, 加入DMSO 150 μL, 轻轻振荡10 min, 测定各孔光吸收值(A值), 绘制细胞生长曲线. 计算药物对细胞的生长抑制率.
1.2.2 RT-PCR法检测ICAM-1表达变化: 两种细胞培养过夜后, 收集0 μmol/L, 50 μmol/L, 100 μmol/L, 200 μmol/L NIM作用72 h和200 μmol/L NIM作用12 h、24 h、48 h、72 h的细胞, 抽提细胞总RNA, 测定其A260, A260/A280, 进行逆转录和PCR反应. 产物以琼脂糖凝胶电泳分离, 紫外光照下以UVP凝胶图像分析系统成像和定量分析.
统计学处理 采用SPSS 10.0统计软件包进行统计学处理, 所得到的数值均以mean±SD表示.
MTT试验结果显示: 随NIM浓度的增加, 作用时间的延长, 药物对HT-29和HCT-116细胞生长抑制率明显增高.NIM对HT-29细胞的增生抑制效果较HCT-116细胞明显(图1).
HT-29和HCT-116细胞株均表达ICAM-1 mRNA, 对照组HT-29细胞表达较HCT-116细胞为高, 差异有显著性(P<0.05); NIM作用72 h的HT-29细胞, ICAM-1 mRNA表达量随药物浓度增加逐渐降低. 50 μmol/L NIM作用组与对照组相比有显著性差异(P<0.05), 100 μmol/L和200 μmol/L组与对照组差异更为显著(P<0.01).各NIM浓度组HCT-116细胞ICAM-1 mRNA表达无显著性差异. 200 μmol/L NIM作用于HT-29细胞24 h、48 h和72 h后, 细胞ICAM-1 mRNA表达与12 h组相比均有极其显著差异(P<0.01). 而同样浓度药物的HCT-116细胞不同作用时间组ICAM-1 mRNA表达则无显著性差异.
流行病学资料表明: 长期服用NSAIDs类药物可使罹患大肠癌危险性降低40-50%. COX-2受抑制可能是NSAIDs抗肿瘤作用的机制之一. COX-2为COX诱导性异构酶, 其过度表达可能是结肠肿瘤发生的早期事件, 并在诱导肿瘤血管生成和转移的过程中发挥重要作用. 我们采用MTT方法证实NIM可以时间、剂量依赖方式抑制结肠腺癌细胞的增生.
ICAM-1是一种跨膜蛋白, 通过与其配体淋巴细胞功能相关抗原-1(LFA-1、CD11a/CD18)和巨噬细胞相关复合体(Mac、CD11b/CD18)结合, 介导细胞与细胞之间的相互活动; 参与呈递抗原信息、激活细胞免疫等过程[4-5]. 正常情况下, ICAM-1仅在血管内皮细胞等细胞低水平的表达, 但在炎症、器官移植、肿瘤免疫等情况下表达量明显增多[6-8]. 研究发现, 结肠癌组织中有高水平ICAM-1的表达, 而癌旁组织和结肠腺瘤组织的表达水平较低, 原因可能为结肠癌细胞能自分泌或刺激邻近组织旁分泌ICAM-1[9]. 研究显示: 癌细胞通过表达ICAM-1作用于其配体LFA-1, 致肿瘤细胞间黏附力降低, 而与血管内皮细胞、淋巴细胞和胞外基质紧密结合, 易从原发灶脱落, 黏着到基质成分, 并可随淋巴细胞进入血液循环. 同时, ICAM-1的可溶性形式sICAM-1进入血液循环后, 竞争性抑制瘤细胞与T细胞与LFA-1的结合, 使肿瘤细胞逃避了免疫监视, 在肿瘤的转移过程中起了重要的作用[10-12]. 有研究者认为sICAM-1可作为结肠癌早期诊断及转移判断的有用指标[13]. 但是, 也有研究发现ICAM-1与肿瘤的侵袭和转移呈负相关. Yasuda et al[14]研究发现: 肿瘤细胞在转移起始阶段, 表达高水平的ICAM-1, 避免受到免疫攻击, 易于肿瘤细胞着床、形成转移灶; 当肿瘤细胞受到细胞外基质刺激时, 通过激活酪氨酸激酶途径, 下调ICAM-1表达, 增加sICAM-1的表达, 使肿瘤细胞免遭杀伤[15].
目前, 对COX-2是否影响ICAM-1表达, 进而影响结肠癌侵袭转移的相关研究目前国内外尚未见报道. 为探讨其作用机制, 我们采用RT-PCR方法检测NIM对肿瘤细胞ICAM-1 mRNA表达的影响, 结果显示: 随着NIM浓度增加, 作用时间延长, HT-29 细胞ICAM-1 mRNA表达水平逐渐降低; 而同样作用形式HCT-116细胞组别间ICAM-1 mRNA表达无显著差异. 结果提示结肠癌细胞COX-2与ICAM-1表达存在相关性, 说明NIM可能通过抑制COX-2酶活性的途径, 下调肿瘤细胞ICAM-1表达, 从而抑制结肠癌细胞生长, 削弱癌细胞与淋巴细胞和单核细胞的黏附, 加强同质细胞间的黏附, 降低癌播散及转移几率.
编辑: N/A
| 1. | Nagatsuka I, Yamada N, Shimizu S, Ohira M, Nishino H, Seki S, Hirakawa K. Inhibitory effect of a selective cyclooxygenase-2 inhibitor on liver metastasis of colon cancer. Int J Cancer. 2002;100:515-519. [PubMed] [DOI] |
| 2. | Kakiuchi Y, Tsuji S, Tsujii M, Murata H, Kawai N, Yasumaru M, Kimura A, Komori M, Irie T, Miyoshi E. Cyclooxygenase-2 activity altered the cell-surface carbohydrate antigens on colon cancer cells and enhanced liver metastasis. Cancer Res. 2002;62:1567-1572. [PubMed] |
| 4. | Uzendoski K, Kantor JA, Abrams SI, Schlom J, Hodge JW. Construction and characterization of a recombinant vaccinia virus expressing murine intercellular adhesion molecule-1: induction and potentiation of antitumor responses. Hum Gene Ther. 1997;8:851-860. [PubMed] [DOI] |
| 5. | Bessa X, Elizalde JI, Mitjans F, Piñol V, Miquel R, Panés J, Piulats J, Piqué JM, Castells A. Leukocyte recruitment in colon cancer: role of cell adhesion molecules, nitric oxide, and transforming growth factor beta1. Gastroenterology. 2002;122:1122-1132. [PubMed] [DOI] |
| 6. | Banner BF, Savas L, Woda BA. Expression of adhesion molecules in the host response to colon carcinoma. Ultrastruct Pathol. 1995;19:113-118. [PubMed] [DOI] |
| 7. | Liu YZ, Chen B, She XD. A clinical evaluation of serum concentrations of intercellular adhesion molecule-1 in patients with gastric cancer. World J Gastroenterol. 1998;4:225-227. [PubMed] [DOI] |
| 8. | Sun JJ, Zhou XD, Zhou G, Liu YK. Expression of intercellular adhesive molecule-1 in liver cancer tissues andliver cancer metastasis. World J Gastroenterol. 1998;4:202-205. [PubMed] [DOI] |
| 10. | Kaihara A, Iwagaki H, Gouchi A, Hizuta A, Isozaki H, Takakura N, Tanaka N. Soluble intercellular adhesion molecule-1 and natural killer cell activity in gastric cancer patients. Res Commun Mol Pathol Pharmacol. 1998;100:283-300. [PubMed] |
| 11. | Lin SJ, Yan DC. ICAM-1 (CD54) expression on T lymphocytes and natural killer cells from umbilical cord blood: regulation with interleukin-12 and interleukin-15. Cytokines Cell Mol Ther. 2000;6:161-164. [PubMed] [DOI] |
| 12. | Alexiou D, Karayiannakis AJ, Syrigos KN, Zbar A, Kremmyda A, Bramis I, Tsigris C. Serum levels of E-selectin, ICAM-1 and VCAM-1 in colorectal cancer patients: correlations with clinicopathological features, patient survival and tumour surgery. Eur J Cancer. 2001;37:2392-2397. [DOI] |
| 14. | Yasuda M, Tanaka Y, Tamura M, Fujii K, Sugaya M, So T, Takenoyama M, Yasumoto K. Stimulation of beta1 integrin down-regulates ICAM-1 expression and ICAM-1-dependent adhesion of lung cancer cells through focal adhesion kinase. Cancer Res. 2001;61:2022-2030. [PubMed] |
| 15. | Araki T, Miki C, Kusunoki M. Biological implications of circulating soluble intercellular adhesion molecule-1 in colorectal cancer patients. Scand J Gastroenterol. 2001;36:399-404. [PubMed] [DOI] |