修回日期: 2003-05-20
接受日期: 2003-06-02
在线出版日期: 2004-02-15
目的: 初步探讨基质金属蛋白酶与恶性腹水的关系.
方法: 收集腹水患者67例, 男38例, 女29例. 肝硬化腹水36例, 结核性腹水8例, 恶性腹水23例. 用明胶酶谱法测定基质金属蛋白酶活性.
结果: 肝硬化腹水、结核性腹水不能检出基质金属蛋白酶-2, -9(MMP-2, -9)活性, 而恶性腹水MMP-2检出率为87.0%, MMP-9检出率为78.3%, 且MMP-2活性高于MMP-9活性(0.01<P = 0.022<0.05).
结论: 基质金属蛋白酶活性检测对于良、恶性腹水的鉴别诊断有重要价值, 他可能与恶性腹水形成有关.
引文著录: 孙晓敏, 董卫国, 余保平, 罗和生, 于皆平. 恶性腹水基质金属蛋白酶活性分析. 世界华人消化杂志 2004; 12(2): 376-378
Revised: May 20, 2003
Accepted: June 2, 2003
Published online: February 15, 2004
AIM: To explore the relationship between matrix metallopro-teinase and malignant ascites.
METHODS: A total of 67 patients, 38 male and 29 female, including cirrhotic ascites (36 cases), tuberculous ascites (8 cases) and malignant ascites (23 cases) were collected and studied in the following experiment. The matrix metallopro-teinase activity was detected by gelatin zymography.
RESULTS: The activity of matrix metalloproteinase-2 and matrix metalloproteinase -9 could not be detected in ascites of hepatic cirrhosis and tuberculous peritonitis but could be detected in 87.0% and 78.3% of malignant ascites (n = 23) respectively. Furthermore, the activity of MMP-2 was higher than that of MMP-9 (0.01<P = 0.022<0.05).
CONCLUSION: The detection of matrix metalloproteinase activity is useful in differential diagnosis between benign and malignant ascites. Matrix metalloproteinase may be related to the formation of malignant ascites.
- Citation: Sun XM, Dong WG, Yu BP, Luo HS, Yu JP. Matrix metalloproteinase activity in malignant ascites. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 376-378
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/376.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.376
腹水是一种常见的临床表现, 可由多种疾病引起. 不同疾病引起的腹水, 其治疗和预后迥然不同, 故良、恶性腹水的鉴别诊断一直是学者们关注的主要课题. 腹水中找到肿瘤细胞乃是确诊恶性腹水的一种迅速、可靠、经济的方法, 但由于其受经验、技术条件及细胞数量的限制, 对相当数量恶性腹水难以做出定性诊断. 近年来, 越来越多的研究表明, 基质金属蛋白酶(matrix metalloproteinase, MMP), 尤其是基质金属蛋白酶-2 (MMP-2) 和基质金属蛋白酶-9 (MMP-9) 与多种肿瘤生长、浸润、转移密切相关[1-5]. 我们通过明胶酶谱法测定各种类型腹水中MMP活性, 旨在探讨其与恶性腹水的关系, 以期为临床腹水鉴别诊断及恶性腹水的治疗提供重要参考.
2002-07/2003-3武汉大学人民医院、中南医院、湖北省肿瘤医院住院腹水患者67例, 男38例, 平均年龄51岁; 女29例, 平均年龄49岁. 肝硬化腹水36例, 结核性腹水 8例, 恶性腹水23例(卵巢癌8例, 胃癌6例, 结肠癌5例, 肝癌2例, 胰腺癌1例, 原发性腹膜癌1例). 以上病例均经细胞学检查、病理活检、B超及CT等确诊. 普通试剂由武汉大学医学院生化教研室提供. MMP标准品IV型胶原酶为Invitrogen公司产品. MMP特异性抑制剂邻菲罗林(1, 10-Phenanthroline)购于上海生物工程技术有限公司. 主要仪器: BIO-RAD 垂直电泳槽, 国产(上海)恒温孵育箱.
常规腹腔穿刺抽取腹水10 mL, 3 000 r/min离心15 min, 取上清液, 按每次用量分装后立即置-70℃冰箱冻存待测, 同时测蛋白浓度. 明胶酶谱法测定MMP活性[6]: 将标本自-70 ℃冰箱取出后置室温下解冻, 按每泳道70 μg蛋白量处理标本(NS稀释). 取处理后的标本40 μL加蛋白处理液(100 mmol/L Tris-HCL pH25 g/L SDS, 400 g/L蔗糖, 0.5 g/L溴酚兰)20 μL, 置37 ℃恒温水浴箱孵育40 min. 制备80g/L十二烷基硫酸钠聚丙酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)为分离胶(含1 g/L明胶), 上覆50 g/L浓缩胶, 取孵育后的标本20 μL上样, 20 mA恒流电泳, 溴酚兰刚好逸出时停止电泳. 电泳结束后, 将凝胶依次置于洗脱液(25 g/L TritonX-100, 50 mmol/L Tris-HCL, 5 mmol/L CaCl2, 1 μmol/L ZnCl2, pH 8.3)中振荡洗脱2次, 45 min/次; 漂洗液(不含TritonX-100的洗脱液)中振荡漂洗2次, 20 min/次, 以上操作均在4 ℃进行. 接着, 将凝胶置于孵育液中(0.1 mol/L glycine, 50 mmol/L Tris-HCL, 5 mmol/L CaCl2, 1 μmol/L ZnCL2, 0.5 mol/L NaCL, pH 8.3 ) 37 ℃恒温低速振荡孵育60 h. 然后经染色液(750 mg/L考马斯亮兰, 300 mL/L甲醇, 100 mL/L乙酸)染色3 h, 用脱色液A, B, C (浓度分别为甲醇300、200、100 mL/L, 乙酸100、100、50 mL/L)分别脱色30 min, 1 h, 2 h, 直至显示MMP的蓝色背景上的负染带透亮清晰. 为证实所检出的负染带为具有活性的MMP, 采用邻菲罗林(1, 10-phenanthroline)抑制试验[7]. 取各组标本, 加2.5 mmol/L 1, 10-phenanthroline观察结果, 以鉴定MMP的存在. 乳酸脱氢酶、腹水细胞学检查、血清综合指标(AFP, CEA, CA系列)由本院检验科及病理科检测.
统计学处理 用χ2检验及确切概率法进行统计学分析.
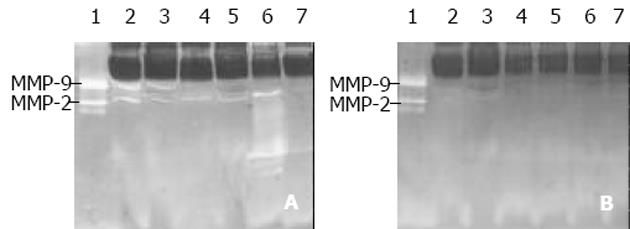
同一份阳性标本加入1, 10-phenanthroline 后, 电泳结果为阴性, 说明本实验所检测到的均为MMP (图1, 2) . 用任意等级积分法对恶性腹水MMP活性进行半定量分析. 等级积分 ±: 条带弱但可检测到, 宽度小于1.0 mm; 1+: 条带清晰可见, 宽度1.0-1.5 mm; 2+: 条带清晰且亮, 宽度1.5-3.0 mm. 肝硬化腹水、结核性腹水均未检出MMP-2、MMP-9 (表1, 图1A). 恶性腹水MMP-2检出率为87.0%, 活性积分为1+以上占80.0%; MMP-9检出率为78.3%, 活性积分为1+以上占44.4%; MMP-2活性高于MMP-9活性(0.01<P = 0.022<0.05); MMP-2和MMP-9活性积分为2+各有3例, 均为原发性腹膜癌1例, 卵巢癌2例(表1, 图2A). 电泳结果还发现, 在36例肝硬化腹水中有6例检出Mr <72 000的MMP, 而在23例恶性腹水中则检测出7例, 而且在有MMP-2表达的腹水中, 若同时有Mr <72 000的MMP表达时, 则该例腹水MMP-2活性明显增强(表1, 图2A). 在23例恶性腹水中, MMP-2阳性20例, 阳性率为87.0%, 显著高于腹水常规检查(乳酸脱氢酶、腹水细胞学、血清综合指标)(P<0.01); MMP-9阳性18例, 阳性率为78.3%, 高于乳酸脱氢酶、腹水细胞学检查(P<0.05), 但与血清综合指标相比, 差异无显著性(P>0.05)(表2).
| 组别 | n | MMP-2活性 | MMP-9活性 | Mr<72 000 | ||||
| ± | 1+ | 2+ | ± | 1+ | 2+ | |||
| 肝硬化腹水 | 36 | 0 | 0 | 0 | 0 | 0 | 0 | 6 |
| 结核性腹水 | 8 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 恶性腹水 | 23 | 4 | 13 | 3 | 10 | 5 | 3 | 7 |
| 胃癌 | 6 | 1 | 4 | 0 | 3 | 2 | 0 | 2 |
| 结肠癌 | 5 | 1 | 2 | 0 | 4 | 1 | 0 | 2 |
| 肝癌 | 2 | 1 | 1 | 0 | 0 | 1 | 0 | 1 |
| 胰腺癌 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| 卵巢癌 | 8 | 1 | 5 | 2 | 3 | 1 | 2 | 2 |
| 原发性腹膜癌 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 0 |
| MMP-2 | MMP-9 | LDH腹水/LDH血清(>1为阳性) | 腹水细胞学 | 血清综合指标(AFP, CEA, CA) | |
| 阳性(n) | 20 | 18 | 10 | 11 | 13 |
| 阳性率 | 87.0% | 78.3% | 43.4% | 47.8% | 56.5% |
肿瘤细胞在侵袭转移过程中必须破坏由细胞间基质和基底膜组成的细胞外基质(extracellular maxtrix, ECM). 在参与破坏ECM的酶类中MMP是主要的直接作用者, 而其中MMP-2(Mr, 72 000)和MMP-9(Mr, 92 000), 又称IV型胶原酶或明胶酶A和明胶酶B, 与肿瘤侵袭转移的关系最为密切. 因为, IV型胶原酶不但可以酶解细胞间基质成分, 还能酶解基底膜主要成分IV型胶原. 许多肿瘤组织、转移灶及肿瘤转移患者血清中IV型胶原酶表达明显增强[8-12]. 然而, IV型胶原酶与恶性腹水的关系, 目前国内外研究的还较少[13-14]. 近期, 有研究发现转移性乳腺癌患者尿液中[15-16]、脑肿瘤患者脑脊液中[17]MMP活性增高. 但是, 少见腹水中MMP活性检测的报道.
恶性腹水是恶性肿瘤腹膜侵袭和转移的结果, 鉴于MMP与肿瘤浸润、转移的关联性, 可推测恶性腹水中有望检测到MMP. 本结果显示, 肝硬化腹水、结核性腹水均未检测到MMP-2和MMP-9; 恶性腹水MMP-2检出率为87.0%, 显著高于腹水常规检查(P<0.01); MMP-9检出率为78.3%, 高于乳酸脱氢酶、腹水细胞学检查(P<0.05), 这表明IV型胶原酶可作为良、恶性腹水的鉴别诊断指标. 同时我们发现, 恶性腹水MMP-2活性高于MMP-9活性(P<0.01), 这可能与不同组织来源恶性肿瘤MMP-2和MMP-9表达上的差异有关. 另外, 在我们的实验研究中4例原因不明腹水2例经腹膜活检确诊, 1例为卵巢癌腹腔转移, 1例为原发性腹膜癌, 而这2例MMP-2, MMP-9活性检测均阳性, 且活性积分均在1+以上; 另2例通过胃镜及结肠镜分别确诊为胃癌和结肠癌腹腔转移, 其MMP-2, MMP-9活性检测也均阳性, 但活性较弱. 以上实验结果提示腹水MMP-2, MMP-9活性在很大程度上反映肿瘤生物学行为, 他的检测对于良、恶性腹水的定性诊断有重要价值, 并有助于判断导致恶性腹水的肿瘤组织来源.
我们还发现, 36例肝硬化腹水中6例检出Mr<72 000的MMP, 而在23例恶性腹水中则检测出7例. 而且, 在有MMP-2表达的腹水中, 若同时有Mr<72 000的MMP表达时, 则该MMP-2活性明显增强. 不排除该MMP为I型膜型MMP的可能性. 有资料表明I型膜型MMP不仅本身具有降解ECM能力, 而且能结合并激活MMP-2[18-19], 该实验结果支持"MT1-MMP结合并激活MMP-2"的观点. 但其在不同性质腹水中表达的作用有待深入研究.
国外文献报道MMP-2在卵巢癌细胞腹膜内入侵中起明显作用[13]. 另有研究发现基质金属蛋白酶抑制剂可消退恶性胸腹水[20-22]. 我们发现肝硬化腹水、结核性腹水均不表达MMP-2和MMP-9; 相反, 大部分恶性腹水有MMP-2、MMP-9较高水平的表达, 这些可推测MMP尤其是MMP-2、MMP-9与恶性腹水形成密切相关, 从而为MMP抑制剂在恶性腹水中的应用提供了临床依据.
编辑: N/A
| 1. | Waas ET, Lomme RM, DeGroot J, Wobbes T, Hendriks T. Tissue levels of active matrix metalloproteinase-2 and -9 in colorectal cancer. Br J Cancer. 2002;86:1876-1883. [PubMed] [DOI] |
| 2. | Kleiner DE, Stetler-Stevenson WG. Matrix metalloproteinases and metastasis. Cancer Chemother Pharmacol. 1999;43 Suppl:S42-S51. [PubMed] [DOI] |
| 3. | Ji F, Wang WL, Yang ZL, Li YM, Huang HD, Chen WD. Study on the expression of matrix metallo proteinase-2 mRNA in human gastric cancer. World J Gastroenterol. 1999;5:455-457. [PubMed] [DOI] |
| 5. | Ellenrieder V, Alber B, Lacher U, Hendler SF, Menke A, Boeck W, Wagner M, Wilda M, Friess H, Büchler M. Role of MT-MMPs and MMP-2 in pancreatic cancer progression. Int J Cancer. 2000;85:14-20. [PubMed] |
| 6. | Kleiner DE, Stetler-Stevenson WG. Quantitative zymography: detection of picogram quantities of gelatinases. Anal Biochem. 1994;218:325-329. [PubMed] [DOI] |
| 7. | Young TN, Rodriguez GC, Rinehart AR, Bast RC Jr, Pizzo SV, Stack MS. Characterization of gelatinases linked to extracellular matrix invasion in ovarian adenocarcinoma: purification of matrix metalloproteinase 2. Gynecol Oncol. 1996;62:89-99. [PubMed] [DOI] |
| 8. | Wang ZN, Xu HM. Relationship between collagen IV expression and biological behavior of gastric cancer. World J Gastroenterol. 2000;6:438-439. [PubMed] [DOI] |
| 10. | Ylisirniö S, Höyhtyä M, Turpeenniemi-Hujanen T. Serum matrix metalloproteinases -2, -9 and tissue inhibitors of metalloproteinases -1, -2 in lung cancer--TIMP-1 as a prognostic marker. Anticancer Res. 2000;20:1311-1316. [PubMed] |
| 11. | Gohji K, Fujimoto N, Hara I, Fujii A, Gotoh A, Okada H, Arakawa S, Kitazawa S, Miyake H, Kamidono S. Serum matrix metalloproteinase-2 and its density in men with prostate cancer as a new predictor of disease extension. Int J Cancer. 1998;79:96-101. [PubMed] [DOI] |
| 12. | Torii A, Kodera Y, Uesaka K, Hirai T, Yasui K, Morimoto T, Yamamura Y, Kato T, Hayakawa T, Fujimoto N. Plasma concentration of matrix metalloproteinase 9 in gastric cancer. Br J Surg. 1997;84:133-136. [PubMed] [DOI] |
| 13. | Fishman DA, Bafetti LM, Banionis S, Kearns AS, Chilukuri K, Stack MS. Production of extracellular matrix-degrading proteinases by primary cultures of human epithelial ovarian carcinoma cells. Cancer. 1997;80:1457-1463. [PubMed] [DOI] |
| 14. | Aslam N, Marino CR. Malignant ascites: new concepts in pathophysiology, diagnosis, and management. Arch Intern Med 1; 161: 2733-2737. [PubMed] [DOI] |
| 15. | Moses MA, Wiederschain D, Loughlin KR, Zurakowski D, Lamb CC, Freeman MR. Increased incidence of matrix metalloproteinases in urine of cancer patients. Cancer Res. 1998;58:1395-1399. [PubMed] |
| 18. | Ohuchi E, Imai K, Fujii Y, Sato H, Seiki M, Okada Y. Membrane type 1 matrix metalloproteinase digests interstitial collagens and other extracellular matrix macromolecules. J Biol Chem. 1997;272:2446-2451. [PubMed] [DOI] |
| 19. | Kinoshita T, Sato H, Takino T, Itoh M, Akizawa T, Seiki M. Processing of a precursor of 72-kilodalton type IV collagenase/gelatinase A by a recombinant membrane-type 1 matrix metalloproteinase. Cancer Res. 1996;56:2535-2538. [PubMed] |
| 20. | Beattie GJ, Smyth JF. Phase I study of intraperitoneal metalloproteinase inhibitor BB94 in patients with malignant ascites. Clin Cancer Res. 1998;4:1899-1902. [PubMed] |
| 21. | Parsons SL, Watson SA, Steele RJ. Phase I/II trial of batimastat, a matrix metalloproteinase inhibitor, in patients with malignant ascites. Eur J Surg Oncol. 1997;23:526-531. [PubMed] [DOI] |
| 22. | Macaulay VM, O'Byrne KJ, Saunders MP, Braybrooke JP, Long L, Gleeson F, Mason CS, Harris AL, Brown P, Talbot DC. Phase I study of intrapleural batimastat (BB-94), a matrix metalloproteinase inhibitor, in the treatment of malignant pleural effusions. Clin Cancer Res. 1999;5:513-520. [PubMed] |