修回日期: 2003-05-10
接受日期: 2003-06-04
在线出版日期: 2004-02-15
目的: 通过检测DNA修复酶hOGG1 mRNA及其蛋白在肝细胞癌中表达程度, 探讨hOGG1在肝细胞癌发生、发展中的作用.
方法: 应用RT-RCR研究正常肝细胞株L-02、肝癌细胞株SMMC7721, HepG2和肝癌(26例)及癌旁组织(21例)中hOGG1 mRNA的表达, 同时用免疫组织化学方法检测了上述肝癌组织(17例)及癌旁组织(15例)中hOGG1蛋白的表达.
结果: 三株细胞均有hOGG1 mRNA表达, 但hOGG1mRNA在正常肝细胞株L-O2中的表达显著低于肝癌细胞株SMMC7721、HepG2中的表达(分别为0.270±0.014 , 0.66±0.011, 0.624±0.020, P<0.05). 肝癌组织hOGG1mRNA表达较癌周组织明显降低(P<0.05). HOGG1蛋白肝组织表达阳性率为87.2%, 主要在肝细胞胞质表达, 在肝癌组织中表达比癌周组织明显降低(P<0.05).
结论: hOGG1mRNA及其蛋白在肝癌细胞株及癌周组织中表达量升高, 这可能是肝细胞癌恶性演变过程中的一个早期预警指标.
引文著录: 周秀敏, 林菊生, 章金艳, 张莉, 周鹤俊. 肝细胞癌hOGG1 mRNA及其蛋白的表达. 世界华人消化杂志 2004; 12(2): 280-282
Revised: May 10, 2003
Accepted: June 4, 2003
Published online: February 15, 2004
AIM: To study the expression of DNA repair enzyme hOGG1 mRNA and protein in nomal liver cell, hepatoma cell lines and hepatocellular carcinoma (HCC) tissues, and to investigate their function in the progress of HCC.
METHODS: Expression of hOGG1 in normal liver cell L-02, hepatoma cell lines HepG2, SMMC7721 and HCC tissues (26 cases) as well as surrouding tissues of HCC (21 cases) were detected by semi-quantitative reverse-transcription polymerase chain reaction. hOGG1 protein was detected in corresponding HT tissues (17 cases HT) and their surrouding liver tissues (15 cases HST) by immunohistochemistry.
RESULTS: The expression level of hOGG1 mRNA in nomal liver cell line was lower than that in two hepatoma cell lines (0.270±0.014 vs 0.662±0.011, 0.624±0.020, P < 0.05). The expression of hOGG1 mRNA in HepG2 was similar to that in SMMC7721. The expression of hOGG1 mRNA in HT was lower than that in HST (P < 0.05). hOGG1 protein was 87.2% (41 of 47) positive in HT and HST and was mainly distributed in liver cells. The protein level of hOGG1 in HCC tissues was correspondingly lower than in their surrouding tissues (P < 0.05).
CONCLUSION: Overexpression of hOGG1 in hepatoma cell lines and the surrouding liver tissuses of HCC may be one of the key events which promote the malignant growth. These results suggest a role for hOGG1 expression in the course of the multistage process of carcinogenesis in hepatocellular carcinoma.
- Citation: Zhou XM, Lin JS, Zhang JY, Zhang L, Zhou HJ. Expression of hOGG1 mRNA and protein in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 280-282
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/280.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.280
多种理化因素, 如紫外线、电离辐射、化学诱变剂等可损伤细胞DNA. 如果DNA损伤得不到及时和有效的修复, 细胞将发生基因突变和癌变等严重后果. Oh8Gua是肿瘤发生过程中DNA损伤的主要产物, 是一种高度致突变性损伤. hOGG1基因产物hOGG1蛋白具有DNA糖苷酶和AP裂解酶活性, 可特异切除修复Oh8Gua以及因自发碱基丢失、或因DNA糖苷化作用产生的阻断DNA复制的脱嘌呤或脱嘧啶(AP)位点. 我们以β-microglobulin基因为内参, 采用RT-PCR技术和免疫组织化学SP方法检测正常肝细胞株L-02、肝癌细胞株SMMC7721, HepG2和肝癌及癌旁组织中hOGG1 mRNA及其蛋白质表达, 来揭示hOGG1表达与肝细胞癌恶性演变的关系.
正常肝细胞株L-02、肝癌细胞株SMMC7721, HepG2均由同济医院肝病研究所传代培养, 均为贴壁生长的真核细胞, 用含100 mL/L的胎牛血清(FCS)和100 kU/L的青/链霉素的DMEM(dulbeccos modified engle medium)培养液在37 ℃, 50 mL/L CO2条件下培养. 2001-09/2002-01在武汉同济医院肝胆外科中心手术切除, 并经病理证实为肝癌及癌旁组织各26、21例, 经病理证实为肝癌及肝硬化组织. 逆转录试剂及PCR扩增试剂均购自Promega公司, Trizol购自Omega公司. 兔抗人hOGG1多克隆抗体购自美国Santa Cruz Biotech公司, 由国内深圳晶美公司代理. 免疫组织化学SP试剂盒购自北京中山公司. 引物和内参β-microglobulin参照文献[1] (Oncogene 1998; 16: 3083-3086)中的引物序列, 扩增片段分别为250 bp和190 bp, 两对引物由上海生物工程研究所合成. hOGG1上游引物序列: 5'-GCGACTGCTGCGACAAGAC-3', 下游引物序列: 5'-TCGGGCACTGGCACTCAC-3'; β-microglobulin上游引物序列5'-TACTCTCTCTTTCTGGCCTG-3', 下游引物序列: 5'-GACAAGTCTGAATGCTCCAC-3'.
吸干六孔板培养液, 加TrizoL 1 mL后吹打、混匀、按照TrizoL试剂说明书步骤提取总RNA, 溶于无RNase酶水中, 用紫外分光光度仪测定RNA浓度和纯度, -75 ℃保存备用. 组织用预冷的PBS漂洗干净后, 组织匀浆器研碎, 其他步骤同细胞提取过程相同. 取总RNA 2 μL, 5×RT Buffer 5 μL, 10 mmol/L dNTP 1 μL, 50 mU/L的RNasin 0.5 μL, 0.5 g/L的 oLigodT 1 μL, 200 mU/L的 M-MLV RT 1 μL, 去离子水补至25 μL, 42 ℃反应60 min, 99 ℃灭活5 min. 阴性对照为不加模板的反应体系. 取上述cDNA 4 μL, 加入10×Buffer 5μL, 10mmol/L dNTP 2 μL, 25 mmol/L MgCl2 4 μL, 10 pmol/L引物各2 μL, 10 pmol/L β-microglobulin各1 μL. 混匀后97℃, 5 min热启动, 3 mU/LTaq酶1 μL, 总体积50 μL, 加矿物油50 μL覆盖. 扩增条件: 94 ℃变性50 s, 57 ℃退火50 s, 72 ℃延伸20 s, 32个循环, 72 ℃补偿7 min, 分别扩增hOGG1及β-microglobulin基因片段. 实验过程设立空白对照, 为不加模板的反应体系. 取PCR产物10 μL, PCR上样缓冲液 5 μL, 于20 g/L琼脂糖凝胶上电泳(含0.5 mg/L溴化乙锭), 80V, 30 min, 然后在紫外灯下观察结果. UVP凝胶分析系统摄像分析结果. hOGG1蛋白的表达用SP法检测 , 石蜡切片常规脱蜡至水, 然后加3% H2O2甲醇孵育10 min, 0.01 mol/L枸橼酸钠缓冲液微波90 ℃, 10 min抗原修复, PBS洗后加正常兔血清, 再滴加一抗(1: 100) 4 ℃孵育过夜. 滴加二抗, PBS洗后用DAB显色, 苏木素复染, 中性树胶封片.
统计学处理 实验数据以mean±SD表示, 率的显著性差异检验选用方差分析(SNK软件).
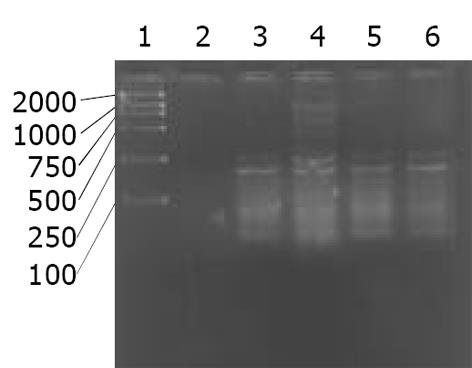
正常肝细胞株L-O2平均hOGG1/β2比值为0.270±0.014, SMMC7721为0.662±0.011, HepG2为0.624±0.020. 其中hOGG1 mRNA的水平在L-O2中比在SMMC7721, HepG2中相对下降 (P<0.05, SNK test), 但两株肝癌细胞SMMC7721和HepG2中hOGG1 mRNA表达无明显差异(P>0.05, SNK test, 图1).
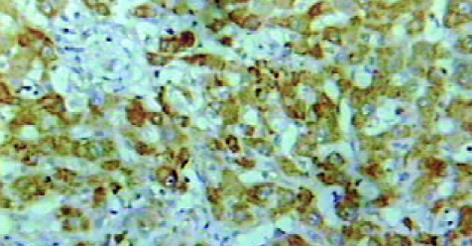
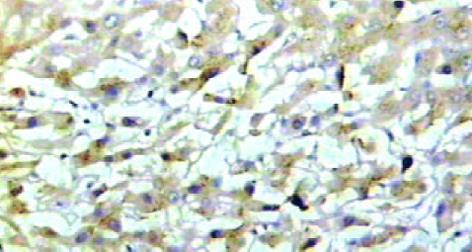
肝癌组织hOGG1/β2比值为0.31±0.08, 癌旁组织为0.68±0.15, 两组差异有显著性(P<0.05, 图2). hOGG1蛋白表达阳性率为87.2% (41/47), 阳性物质呈棕黄色, 在肝癌及癌旁组织中主要分布于肝细胞胞质内见图3, 4. 肝癌组织中hOGG1蛋白表达的阳性均值0.126±0.02, 癌旁组织中hOGG1蛋白表达的阳性均值为0.137±0.08, 两组均值有统计学差异(t = 5.358, P<0.05).
在DNA氧化损伤中, 8-羟基鸟嘌呤(Oh8Gua)形成频率最高, 致突变能力最强, 是DNA氧化损伤的代表性产物, 是肿瘤发生和发展的重要因素[1-10]. 因此, Oh8Gua 的修复能力可能与个体癌症易感性密切相关[11-17]. hOGG1基因产物hOGG1蛋白具有DNA糖苷酶和AP裂解酶活性, 可特异切除修复Oh8Gua以及自发碱基丢失、或因DNA糖苷化作用产生的阻断DNA复制的脱嘌呤或脱嘧啶(AP)位点. hOGG1基因及其表达产物与肿瘤的发生发展关系密切, 在多种肿瘤里发现hOGG1基因表达异常, 故很多学者认为: hOGG1基因及其表达产物可能是肿瘤恶变的一个早期预警指标. Li et al发现乳腺癌患者的正常乳腺组织较正常人的乳腺组织Oh8Gua含量高, 同时也发现其hOGG1蛋白含量也较正常人乳腺组织高. Cheng et al研究了女性肺癌的致癌因素, 发现厨房的油烟是主要的因素之一. 发现肺癌细胞CL-3经油烟处理后, Oh8Gua含量增高, hOGG1 mRNA含量也相应升高; 同时他们研究了经常接触油烟的94名女厨师和43名家庭妇女, 101名没有接触厨房油烟的正常女性作为对照. 发现前二者肺组织hOGG1 mRNA含量较对照组高. 因此他们认为: hOGG1 mRNA水平可能作为油烟刺激后肺癌发生的一个预警指标. Kondo et al发现hOGG1 mRNA在结肠癌组织中比相应癌旁组织表达增高, Oh8Gua在结肠癌组织中比相应癌旁组织中含量增高.
本研究结果显示hOGG1 mRNA在三株细胞中均有表达. 其中, hOGG1mRNA在正常肝细胞株L-02中表达量较肝癌细胞株SMMC7721、HepG2中相对较少(P<0.05), 而2株肝癌细胞株中的hOGG1 mRNA基因表达则无显著异性(P>0.05). 肝癌细胞株SMMC7721, HepG2中hOGG1 mRNA基因表达比正常肝细胞株L-02中表达量增加, 这可能是肝癌的演进过程中氧化应激加剧, 机体DNA修复酶系统反馈性从转录水平进行调节的机制. 同时发现肝癌组织hOGG1 mRNA及蛋白表达较癌周肝硬化组织明显降低, 其机制可能为肝癌在恶性演变过程中, 在其肝硬化阶段已发生DNA修复酶系统hOGG1从转录水平进行代偿性调节, 在肝癌形成阶段DNA修复酶系统失代偿所致. 我们从DNA氧化损伤及其修复酶系统探讨肝细胞癌的发生机制, 研究氧化应激和DNA修复酶在肝细胞癌发生发展中的地位与作用. 试图为肝癌的发生预测和早期诊断寻求新的指标, 为肝癌的预防和早期治疗开辟一条新的途径.
编辑: N/A
| 1. | Mistry P, Herbert KE. Modulation of hOGG1 DNA repair enzyme in human cultured cells in response to pro-oxidant and antioxidant challenge. Free Radic Biol Med. 2003;35:397-405. [PubMed] [DOI] |
| 2. | Collins AR, Harrington V, Drew J, Melvin R. Nutritional modulation of DNA repair in a human intervention study. Carcinogenesis. 2003;24:511-515. [PubMed] [DOI] |
| 3. | Karim MR, Wanibuchi H, Wei M, Morimura K, Salim EI, Fukushima S. Enhancing risk of ethanol on MeIQx-induced rat hepatocarcinogenesis is accompanied with increased levels of cellular proliferation and oxidative stress. Cancer Lett. 2003;192:37-47. [PubMed] [DOI] |
| 4. | Tsuruya K, Furuichi M, Tominaga Y, Shinozaki M, Tokumoto M, Yoshimitsu T, Fukuda K, Kanai H, Hirakata H, Iida M. Accumulation of 8-oxoguanine in the cellular DNA and the alteration of the OGG1 expression during ischemia-reperfusion injury in the rat kidney. DNA Repair (Amst). 2003;2:211-229. [PubMed] [DOI] |
| 5. | Potts RJ, Watkin RD, Hart BA. Cadmium exposure down-regulates 8-oxoguanine DNA glycosylase expression in rat lung and alveolar epithelial cells. Toxicology. 2003;184:189-202. [PubMed] [DOI] |
| 6. | Hazra TK, Izumi T, Boldogh I, Imhoff B, Kow YW, Jaruga P, Dizdaroglu M, Mitra S. Identification and characterization of a human DNA glycosylase for repair of modified bases in oxidatively damaged DNA. Proc Natl Acad Sci USA. 2002;99:3523-3528. [PubMed] [DOI] |
| 7. | Saitoh T, Shinmura K, Yamaguchi S, Tani M, Seki S, Murakami H, Nojima Y, Yokota J. Enhancement of OGG1 protein AP lyase activity by increase of APEX protein. Mutat Res. 2001;486:31-40. [PubMed] [DOI] |
| 8. | Kim HN, Morimoto Y, Tsuda T, Ootsuyama Y, Hirohashi M, Hirano T, Tanaka I, Lim Y, Yun IG, Kasai H. Changes in DNA 8-hydroxyguanine levels, 8-hydroxyguanine repair activity, and hOGG1 and hMTH1 mRNA expression in human lung alveolar epithelial cells induced by crocidolite asbestos. Carcinogenesis. 2001;22:265-269. [PubMed] [DOI] |
| 9. | Bruner SD, Norman DP, Verdine GL. Structural basis for recognition and repair of the endogenous mutagen 8-oxoguanine in DNA. Nature. 2000;403:859-866. [PubMed] [DOI] |
| 10. | Nishioka K, Ohtsubo T, Oda H, Fujiwara T, Kang D, Sugimachi K, Nakabeppu Y. Expression and differential intracellular localization of two major forms of human 8-oxoguanine DNA glycosylase encoded by alternatively spliced OGG1 mRNAs. Mol Biol Cell. 1999;10:1637-1652. [PubMed] [DOI] |
| 11. | Cheng B, Jüngst C, Lin J, Caselmann WH. [Potential role of human DNA-repair enzymes hMTH1, hOGG1 and hMYHalpha in the hepatocarcinogenesis]. J Huazhong Univ Sci Technolog Med Sci. 2002;22:206-211, 215. [PubMed] |
| 12. | Riis B, Risom L, Loft S, Poulsen HE. Increased rOGG1 expression in regenerating rat liver tissue without a corresponding increase in incision activity. DNA Repair (Amst). 2002;1:419-424. [PubMed] [DOI] |
| 13. | Morland I, Rolseth V, Luna L, Rognes T, Bjørås M, Seeberg E. Human DNA glycosylases of the bacterial Fpg/MutM superfamily: an alternative pathway for the repair of 8-oxoguanine and other oxidation products in DNA. Nucleic Acids Res. 2002;30:4926-4936. [PubMed] [DOI] |
| 14. | Vogel U, Møller P, Dragsted L, Loft S, Pedersen A, Sandström B. Inter-individual variation, seasonal variation and close correlation of OGG1 and ERCC1 mRNA levels in full blood from healthy volunteers. Carcinogenesis. 2002;23:1505-1509. [PubMed] [DOI] |
| 15. | Kinoshita A, Wanibuchi H, Imaoka S, Ogawa M, Masuda C, Morimura K, Funae Y, Fukushima S. Formation of 8-hydroxydeoxyguanosine and cell-cycle arrest in the rat liver via generation of oxidative stress by phenobarbital: association with expression profiles of p21(WAF1/Cip1), cyclin D1 and Ogg1. Carcinogenesis. 2002;23:341-349. [PubMed] [DOI] |
| 16. | He YH, Xu Y, Kobune M, Wu M, Kelley MR, Martin WJ 2nd. Escherichia coli FPG and human OGG1 reduce DNA damage and cytotoxicity by BCNU in human lung cells. Am J Physiol Lung Cell Mol Physiol. 2002;282:L50-L55. [PubMed] [DOI] |
| 17. | Araneda S, Mermet N, Verjat T, Angulo JF, Radicella JP. Expression of Kin17 and 8-OxoG DNA glycosylase in cells of rodent and quail central nervous system. Brain Res Bull. 2001;56:139-146. [PubMed] [DOI] |