修回日期: 2003-08-10
接受日期: 2003-09-24
在线出版日期: 2004-02-15
目的: 将肝癌H22细胞与树突状细胞(DC)相融合, 研制杂交瘤苗, 并观察瘤苗的生长特性、致瘤性及免疫活性.
方法: 将 DC与肝癌H22细胞融合制备H22-DC融合细胞, 磁式分选器分选融合细胞; 观察融合细胞的生长特性和体内致瘤性; 从Balb/C小鼠皮下接种融合细胞, 实验设肿瘤等三组对照, 每组各5只小鼠. MTT比色法检测小鼠脾CTL活性.
结果: 融合细胞在体外能分裂增生, 但明显低于肿瘤细胞, 无体内致瘤性; 活融合细胞免疫的小鼠, 其脾CTL杀伤H22细胞的活性明显高于对照组小鼠 (P<0.01).
结论: 融合细胞能诱导出特异性的CTL活性, 可望成为肝癌免疫治疗的新途径.
引文著录: 张娟, 张锦堃, 卓少宏. 肝癌细胞H22与树突状细胞杂交瘤苗的实验研究. 世界华人消化杂志 2004; 12(2): 276-279
Revised: August 10, 2003
Accepted: September 24, 2003
Published online: February 15, 2004
AIM: To prepare a cancer vaccine (H22-DC) based on fusion of hepatocarcinoma cells (H22) with dendritic cells (DC) of mice and to analyze the biological characteristics, tumorigenicity and specific CTL activity of H22-DC.
METHODS: DCs were fused with H22 cells and fusion cells were marked with CD11c MicroBeads. The teachniques of cell culture, immunocytochemistry and light microscopy were used to test the characteristics of growth morphology of H22-DC in vitro. As an immunogen, H22-DC was inoculated subcutaneously into the right armpit of Balb/C mice, and their tumorigenicity in vivo was observed. MTT was used to test the CTL activity of murine spleen in vitro.
RESULTS: H22-DC was able to divide and prolifterate in vitro,but its activity of proliferation was significantly decreased as compared with H22 cells and its growth curve was flatter than that of H22 cells. The spleen CTL activity against H22 cells in mice implanted with fresh H22-DC was significantly higher than that in control groups (P < 0.01).
CONCLUSION: H22-DC can significantly stimulate the specific CTL activity of murine spleen. The DC vaccine is likely to become a helpful approach in immunotherapy of hepatocellular carcinoma.
- Citation: Zhang J, Zhang JK, Zhuo SH. A vaccine prepared by fusion of H22 cells with the spleen-drived dendritic cells. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 276-279
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/276.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.276
T细胞介导的细胞免疫应答在机体抗肿瘤免疫中起着关键作用, T细胞的致敏、激活和扩增依赖于抗原呈递细胞(antigen presenting cells, APC)提呈相应的抗原多肽并提供共刺激信号[1]. 然而, 由于许多肿瘤细胞为弱免疫原性, 呈现MHC分子与共刺激分子的表达低下或缺如, 致使肿瘤抗原不能得到有效的提呈, 因而不能诱导机体有效的抗肿瘤免疫应答, 不能有效地激活体内特异性的杀伤机制. 当前国内外引人瞩目的APC瘤苗, 正是期望增强肿瘤细胞的免疫原性和提高抗原呈递细胞对肿瘤抗原的提呈能力, 以诱导有效的特异性T 细胞抗肿瘤免疫. 树突状细胞(dendritic cells, DC)是目前已知体内功能最强的一类专职的抗原呈递细胞[2-4], DC具有抗原捕获、加工和提呈功能[5-6], 尤其对初次免疫应答激发具有强大的刺激活性[7-9]. 因此DC在肿瘤免疫治疗方面的作用越来越受到人们的重视[10-13]. 本文采用小鼠脾脏来源的DC与肝癌细胞融合, 以有效发挥DC提呈肿瘤抗原的能力, 增强肿瘤细胞的免疫原性, 刺激宿主产生特异性CTL活性.
BALB/C小鼠(H-2d): 清洁级, 6-8周龄. ♂, 质量15-20 g, 购自上海西普尔必凯实验动物有限公司, 随机分成实验组和对照组. 小鼠mAbCD80, CD86, CD54为coulter公司产品. rmGM-CSF和rm IL-4为R&D Systems产品; Mini MACS磁式分选器及CD11c MicroBeads为Miltenyi Biotec GmbH产品; Metrizamide为amresco产品, PEG为Sigma公司产品.
分离DC 在原有Steinman法的基础上加以改良, 根据DC的半黏附性及FcR-的特点, 应用145 g/L的Metrizamide密度梯度离心再用小鼠粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)和白介素-4(rmIL-4)共培养, 诱导小鼠脾DC扩增, 制备大量的DC.
细胞融合和筛选 用500 g/L的聚乙二醇(PEG)使DC与H22细胞融合[14-15]. 再用CD11c MicroBeads标记, Mini MACS磁式细胞分选器分选出H22-DC. 置于含rmGM-CSF和rm IL-4(500 ng/L)以及200 g/LFCS的RPMI 1640完全培养基中扩增培养2-3 wk. 用光镜和相差镜观察H22-DC, H22和DC的形态特征.
1.2.1 免疫细胞化学染色: 细胞分别与一抗CD80, CD86或CD54共孵育, 应用ABC试剂, DAB显色, 观察膜蛋白并用Olympus显微摄相显微镜摄相.
1.2.2 细胞体外增生特性分析: 接种H22-DC于24孔培养板, 1.25×104/孔, 每隔24 h取3孔计数细胞, 取其平均值绘制体外生长曲线, 同时以H22细胞为对照.
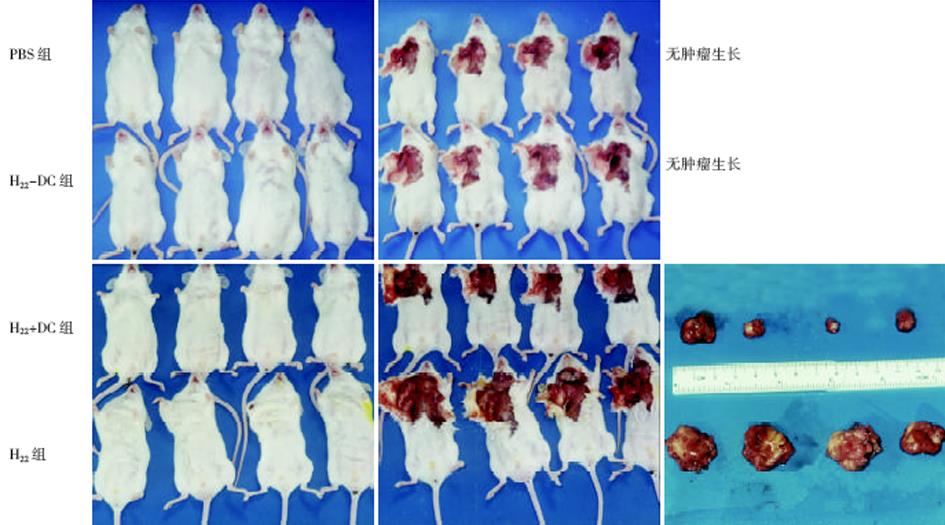
1.2.3 致瘤性分析: 实验分三组, 每组又分4小组(H22-DC, H22+DC, H22和PBS组). 分别给第一组的实验组小鼠右腋皮下接种0.1 mL 1×1010-2×1010/L的活H22-DC, 对照组分别给予等量的H22+DC, H22和PBS. 每日观察肿瘤的生长情况及小鼠的存活期. 第二组小鼠于免疫后14 d处死, 分离肿瘤并称重比较.
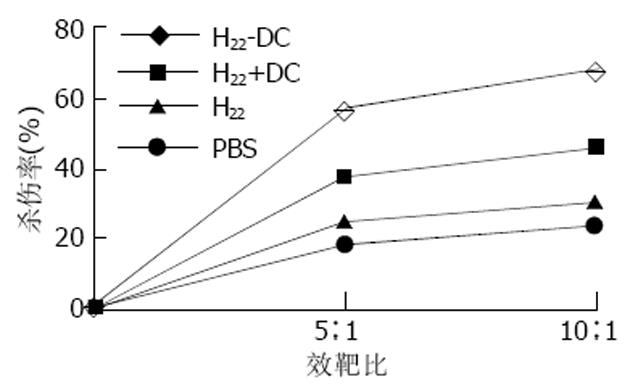
1.2.4 CTL活性: 第三组小鼠于免疫后第10 d处死, 分离脾脏, 制备细胞悬液. 加入基因重组IL-2的含100 g/L FCS的RPMI1640培养液, 37 ℃, 50 mL/L CO2 饱湿条件下孵育3 d. 抗肿瘤实验分为4组, 各组均设5: 1和10: 1效(CTL)靶(H22)比. A组: CTL(H22-DC组)+ H22 ; B组: CTL(H22+DC组)+ H22; C组: CTL(H22组)+ H22; D组: CTL(PBS组)+ H22 . 另设T组为相应的CTL对照组, E组为H22对照组, 培养液空白对照组只含FCS- RPMI1640. 每组均设3个复孔, 置于96孔培养板中, 37 ℃、50 mL/L CO2 饱湿条件下孵育48h, 应用原有的MTT法检测细胞毒活性. 简而言之, 就是加入新配制已滤菌的5 g/L的MTT 20 µL/孔继续孵育4 h, 吸弃上清液, 加入150 µL DMSO 振荡10 min使结晶物充分溶解; 选择570 nm波长, 在Bio-Rad 3550-UV型全自动酶联检测仪上检测.
统计学处理 用方差分析进行统计学处理, P<0.05为有统计学意义.
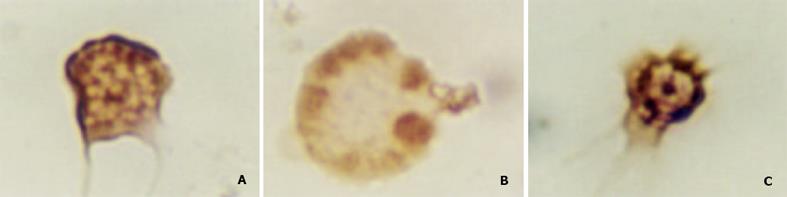
DC为具有许多突起的形态不规则的细胞, 有刺突状和球形伪足状突起. 核卵圆形或不规则形, 不断进行波状运动. 胞质富含球形线粒体. 免疫细胞化学染色显示DC为CD80、CD86、CD54阳性细胞. 细胞形态不规则, 胞质内充满棕黄色细颗粒(图1).
CD11c MicroBeads标记后, Mini MACS分选, 结果H22-DC为阳性细胞, H22为阴性细胞 ; 免疫细胞化学染色显示H22-DC为CD80、CD86、CD54阳性细胞(图2), 而H22为CD80, CD86, CD54阴性细胞. 细胞因子rmGM-CSF和rmIL-4能诱导融合细胞分裂增生, 并延长其存活时间. 经rm CD11c MicroBeads标记, Mini MACS分选的融合细胞中混有未融合的DC, 但在不加细胞因子的培养液中10-14 d, DC自然调亡, 而融合细胞则继续生长.
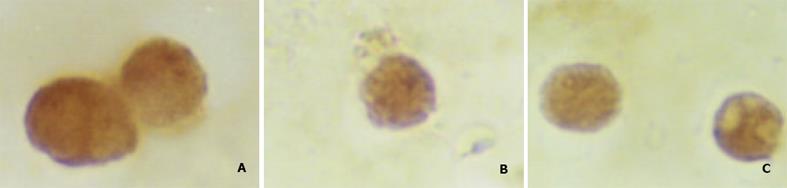
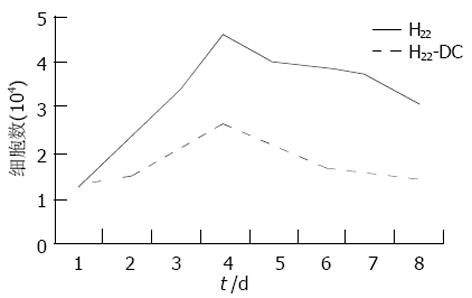
H22-DC兼具两种亲本细胞的特性, 细胞呈悬浮生长, 呈卵圆形、扁平、不规则状, 富含线粒体, 核不规则(图3). 不加rmGM-CSF、rmIL-4的H22-DC细胞活性低, 加入rmGM-CSF和rmIL-4后, H22-DC可分裂增生, 但其生长曲线明显低于H22细胞(图4). H22-DC免疫小鼠后, 超过60 d未见肿瘤形成, 而H22+DC和H22对照组却100%成瘤. 荷瘤14 d小鼠, H22-DC组与H22组瘤重有显著性差异P<0.01(图5, 6).
MTT法检测结果表明, H22-DC组脾CTL活性显著高于H22+DC, H22和PBS组(P<0.01)(图6).
成熟的DC能有效的递呈肿瘤肽表位诱导机体CTL产生特异性的抗肿瘤免疫反应[15-18]. 活化的B细胞和DC与肿瘤细胞融合可制备DC瘤苗. 我们在建立DC的分离与扩增培养的基础上, 采用PEG化学融合与免疫磁珠法相结合研制融合瘤苗, 不仅大大简化了传统细胞融合方法中的繁琐筛选过程, 也提高了分选细胞的纯度, 是一种既简便又切实可行的方法. CD11c mAb (N418)对小鼠脾脏DC上表达的白细胞整合素axβ2中的αx亚单位是特异性的, CD11c+ 细胞磁式分选器(Mini MACS)分离细胞的原理是通过通过偶联在CD11c抗体上的磁珠标记在细胞上, 让细胞流过置于磁场中的分离柱而分离细胞. 磁标记的CD11c+- 细胞留在MACS分选柱中, 而CD11c- 的细胞流过分选柱. 分选柱撤离磁场后, 从柱上洗脱的CD11c+ 细胞DC为正选细胞. MACS的分离效果已得到免疫荧光、PCR、FISH及FACS的确认, 他的优点是处理的细胞量大, 分离纯度高, 方法简便, 易于操作.
近年直接用DC与肿瘤细胞融合制备瘤苗已成为肿瘤主动免疫治疗的重要方法之一[19-23]. 他不仅方法容易掌握、切实可行, 而且开发了宿主体内免疫系统独特地识别、杀伤肿瘤细胞而又不损伤正常细胞的肿瘤治疗途径[24-30]. 利用小鼠CD11c MicroBeads 标记, Mini MACS磁式分选器分选出的H22-DC融合细胞, 兼具两种亲本细胞的的特征, 形态不规则. 其中混有的DC-DC和DC, 在不加细胞因子的情况下, DC-DC于7-10 d自然调亡, DC于10-14 d自然调亡, H22-DC则继续存活. 融合细胞开始时分裂增生尚快, 尔后生长变的缓慢, 活力和分裂增生活性下降, 体外建株未成功. 可能与肿瘤亲本细胞在体外的生长特性及融合细胞随培养时间增加而出现染色体丢失有关.
将H22-DC融合细胞注入Balb/C小鼠右腋皮下, 超过60 d未见肿瘤形成; 注入混有等量DC的H22细胞的对照组则100%诱发肿瘤, 说明H22-DC融合细胞已失去体内致瘤性. 荷瘤14 d的DC+H22组小鼠瘤重与H22组有显著性差异, 说明单纯的混合虽不能阻止肿瘤形成, 但在肿瘤形成的早期却可明显抑制小鼠肿瘤生长. 提示在肿瘤形成早期, DC在递呈肿瘤抗原和诱导特异性抗肿瘤免疫反应过程中起到了一定的积极作用. 本研究分别取接种10 d的H22-DC, H22+DC及H22小鼠的脾脏, 在体外诱导脾CTL活性, 结果表明, 接种融合细胞H22-DC的小鼠脾CTL活性明显高于接种H22细胞小鼠. 提示瘤苗主动免疫小鼠能在体内产生特异性的抗肿瘤免疫保护作用, DC和H22-DC都能诱导小鼠体内特异性的抗肿瘤免疫反应, 刺激效应性T细胞的形成, 且H22-DC无致瘤性, 提示DC与肝癌细胞直接融合有望成为肝癌肿瘤免疫治疗的一条有希望的治疗途径.
编辑: N/A
| 2. | Nagata Y, Ono S, Matsuo M, Gnjatic S, Valmori D, Ritter G, Garrett W, Old LJ, Mellman I. Differential presentation of a soluble exogenous tumor antigen, NY-ESO-1, by distinct human dendritic cell populations. Proc Natl Acad Sci USA. 2002;99:10629-10634. [PubMed] [DOI] |
| 3. | de Vries IJ, Eggert AA, Scharenborg NM, Vissers JL, Lesterhuis WJ, Boerman OC, Punt CJ, Adema GJ, Figdor CG. Phenotypical and functional characterization of clinical grade dendritic cells. J Immunother. 2002;25:429-438. [PubMed] [DOI] |
| 4. | Zhang X, Gordon JR, Xiang J. Advances in dendritic cell-based vaccine of cancer. Cancer Biother Radiopharm. 2002;17:601-619. [PubMed] [DOI] |
| 7. | Rains N, Cannan RJ, Chen W, Stubbs RS. Development of a dendritic cell (DC)-based vaccine for patients with advanced colorectal cancer. Hepatogastroenterology. 2001;48:347-351. [PubMed] |
| 8. | Fay JW. Hematopoietic growth factors, dendritic cell biology, and vaccine therapy of cancer. Curr Opin Hematol. 2002;9:202-206. [PubMed] [DOI] |
| 9. | Hu JY, Wang S, Zhu JG, Zhou GH, Sun QB. Expression of B7 costimulation molecules by colorectal cancer cells reducestumorigenicity and induces anti-tumor immunity. World J Gastroenterol. 1999;5:147-151. [PubMed] [DOI] |
| 10. | Gitlitz BJ, Belldegrun AS, Figlin RA. Vaccine and gene therapy of renal cell carcinoma. Semin Urol Oncol. 2001;19:141-147. [PubMed] |
| 11. | Zisman A. [New trends in the diagnosis and treatment of renal cell carcinoma]. Harefuah. 2002;141:713-717, 761. [PubMed] |
| 12. | Sabel MS, Sondak VK. Tumor vaccines: a role in preventing recurrence in melanoma? Am J Clin Dermatol. 2002;3:609-616. [PubMed] [DOI] |
| 13. | Onaitis M, Kalady MF, Pruitt S, Tyler DS. Dendritic cell gene therapy. Surg Oncol Clin N Am. 2002;11:645-660. [PubMed] [DOI] |
| 14. | McConnell EJ, Pathangey LB, Madsen CS, Gendler SJ, Mukherjee P. Dendritic cell-tumor cell fusion and staphylococcal enterotoxin B treatment in a pancreatic tumor model. J Surg Res. 2002;107:196-202. [PubMed] [DOI] |
| 15. | Liu Y, Zhang W, Chan T, Saxena A, Xiang J. Engineered fusion hybrid vaccine of IL-4 gene-modified myeloma and relative mature dendritic cells enhances antitumor immunity. Leuk Res. 2002;26:757-763. [PubMed] [DOI] |
| 18. | 肖 兰凤, 罗 利琼, 邹 奕, 黄 树林. CD28/CD80和CD2/CD58活化PBLs作用肝癌细胞的表型分析与TcR Vβ基因亚家族的优势取用. 世界华人消化杂志. 1999;7:1044-1046. [DOI] |
| 20. | 李 军, 张 锦堃, 张 娟, 陈 海滨, 陈 肃标. 树突状细胞融合瘤苗的体内抗肝癌效应. 胃肠病学和肝病学杂志. 2003;12:34-38. |
| 22. | 刘 美娜. 自体或同种异体树突状细胞融合人卵巢癌细胞体外诱导抗肿瘤免疫反应. 国外医学•妇产科学分册. 2001;28:189-190. |
| 27. | 吴 军, 杨 太成, 王 晓怀, 杨 传红, 赖 晃文, 王 捷, 郑 文玲. 人癌胚抗原重组痘苗病毒转染树突状细胞体外诱导的抗肿瘤免疫. 中华微生物学和免疫学杂志. 2003;23:27-30. |
| 29. | N/A. 癌症疫苗. 国外医学•预防、诊断、治疗用生物制品分册. 2001;24:14-16. |
| 30. | 邹 文燕, 钱 志红, 徐 惠民. 树突状细胞与卵巢癌的免疫治疗. 国外医学•妇产科学分册. 2003;30:50-53. |