修回日期: 2003-08-10
接受日期: 2003-09-24
在线出版日期: 2004-02-15
目的: 构建一个在大肠杆菌中表达人鼠嵌合Fab抗体的通用载体, 并用于抗人肝癌相关抗原HAb18G人鼠嵌合Fab抗体的表达.
方法: 利用特异引物PCR扩增人IgG3的CH1和Cκ基因, 分别克隆到表达载体pComb3中, 从而构建成人-鼠嵌合Fab抗体的通用表达载体pComb3C. 然后将扩增的mAb HAb18的VL和VH基因分别组装到通用表达载体中, 酶切去除gIII片段后, 连接成为HAb18嵌合Fab抗体的分泌型表达载体pComb3C/cFab. 转化大肠杆菌后诱导其表达, 通过ELISA检测产物的表达和定位. 最后, 利用亲合层析纯化表达产物, 进行SDS-PAGE电泳和Western-blot检测, 同时采用ELISA和免疫荧光法检测表达产物的亲和力和特异性.
结果: 测序及酶切鉴定表明, 人IgG3的CH1和Cκ基因正确插入到pComb3中, 大小分别为324 bp和333 bp, 同时mAb HAb18的嵌合Fab基因也分别获得正确组装和表达. 表达产物的分子质量约为45 ku, 主要位于周质腔中. 另外, ELISA和免疫荧光检测证实, 表达产物含有人的抗体片段, 并具有与相应抗原特异结合的活性, 亲和力约为亲本抗体的10%.
结论: 成功构建了人鼠嵌合Fab抗体的通用表达载体并制备了抗人肝癌小分子嵌合Fab抗体, 为其进一步在肝癌诊断与治疗中的应用奠定了基础.
引文著录: 邢金良, 杨向民, 张思河, 姚西英, 梁瑞安, 陈志南. 人鼠嵌合Fab抗体通用表达载体的构建和抗人肝癌相关抗原HAb18G嵌合Fab抗体的表达. 世界华人消化杂志 2004; 12(2): 271-275
Revised: August 10, 2003
Accepted: September 24, 2003
Published online: February 15, 2004
AIM: To construct a universal expression vector for human-mouse chimeric Fab antibody and to use it for construction and expression of human-mouse chimeric Fab antibody against human hepatoma associated antigen HAb18G.
METHODS: Human IgG3 CH1 and Cκgenes were amplified by PCR with Specific primers and cloned into vector pComb3 to construct a human-mouse chimeric Fab antibody universal expression vector pComb3C. Then, the Vκ and VH genes of mAb HAb18 were amplified by PCR using Specific primers and cloned into the expression vector pComb3-cFab. After gIII was cut away, the secretory expression vector pComb3C/cFab containing chimeric Fab antibody gene of HAb18 was constructed and transfected into competent E. Coli. And then, the antibody induction expression by IPTG was conducted. The locaeization of expression products was detected by sandwich ELISA. Finally, The expression product was purified by affinity chromatography and the antigen-binding Specificity and affinity of the expression product were tested by ELISA and immunofluorescence staining.
RESULTS: Human IgG3 CH1 and Cκgenes were correctly inserted into vector pComb3 by nucleotide sequencing and restriction endonucleases digestion, with the size of 324bp and 333 bp, and chimeric Fab gene of mAb HAb18 was successfully constructed and expressed in E. Coli. The molecular mass of expression product was about 45 ku. It was mainly located in the periplasm. The results of ELISA and immunofluorescence staining showed that the expressed chimeric Fab contained human antibody fragment and had Specific antigen-binding activity, and its affinity was about 10% of parental antibody HAb18.
CONCLUSION: We have successfully constructed a universal expression vector for human-mouse chimeric Fab antibody. Based on this result, a small molecule of chimeric Fab antibody against human hepatoma is prepared, which lays a foundation for its further application into diagnosis and therapy of human hepatocellular carcinoma.
- Citation: Xing JL, Yang XM, Zhang SH, Yao XY, Liang RA, Chen ZN. Construction of a universal expression vector for human-mouse chimeric Fab antibody and expression of chimeric Fab antibody against human hepatoma associated antigen HAb18G. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 271-275
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/271.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.271
HAb18mAb为抗人肝细胞肝癌表面分子HAb18G/CD147的特异性单克隆抗体[1-2], 具有较好的特异性和亲和力. 近年来, 我们利用该mAb作为载体进行了肝癌的导向治疗研究, 其中I131标记HAb18 mAb的F(ab')2制备的第二代肝癌放射免疫治疗剂已进入II期临床阶段[3-7]. 但鼠源性抗体在患者体内可产生不同程度的人抗鼠抗体反应(HAMA), 从而削弱其治疗的有效性, 并对清除抗体的器官产生毒性损害[8]. 另外, 较大的抗体分子的组织穿透能力较差, 在血液和非瘤组织的清除较慢. 从而导致相对较低的T/NT比值, 因此应用受限[9]. 为了克服这些弊病, 研制新一代低免疫原性高T/NT比值的基因工程抗体很有必要. 我们在成功制备HAb18mAb鼠源Fab抗体的基础上, 对已构建好的Fab抗体进行了部分人源化改造, 用huCH1/huCL替换鼠源的mCH1/mCL, 制备成嵌合Fab片段, 以期尽可能的减少人体内应用时可能引发的人抗鼠抗体(HAMA)反应, 便于实际应用, 为进一步探讨该型抗体在肝癌治疗中的应用奠定了良好的基础.
含有人IgG3CH1及κ轻链恒定区基因的载体pComb3/HuFab由本校生化教研室温博士惠赠. 含有mAb HAb18(IgG1)Fd及全长轻链基因的T载体pMD18T-Fd和pMD18T-L由本中心构建并保存. 表达载体pComb3及E. Coli感受态菌株JM109和XL1-blue, 均为本室制备保存. T载体、PCR试剂及限制性内切酶和连接酶, 均为大连宝生物公司产品. mAb HAb18、嵌合IgG抗体chHAb18及HRP-HAb18由本室自制. IPTG, FITC及HRP标记的羊抗人IgG购于华美公司. Protein G亲合层析柱为美国安玛西亚的产品. 肝癌细胞株HHCC由我中心培养保存. PCR引物由北京赛百盛公司合成, 具体序列如下: MVHback5'-AAG TGA AGC TTC TCG AGT CTG G-5'; MVHfor5'- GGG GAT ATC TGC AGA GAC AGT GAC -3'; HuCH1back5'-GGG GCT CGA GTT GAT ATC TCC ACC AAG GGC CCA TCG GTC-3'; HuCH1for5'-GCA TGT ACT AGT TTT GTC ACA AGA TTT GGG -3'; MVLback5'-CAGATGTGAGCTCAGTATTGTGATGACCCAGACTCC-3'; MVLfor5'-GGG GTC GAC GTT TTA TTT CCA ACT TTG T-3'; HuCLback5'-GTT CCG AGC TCA AGT CGA CCT GTG GCT GCA CCA TCT GTC -3'; HuCLfor3'-GCG CCG TCT AGA ATT AAC ACT CTC CCC TGT TGA AGC TCT TTG TGA CGG GCG AAC TCA GGC CC-3'. 划线处依次为Xho I、EcoR V、 Xho I、EcoR V、Spe I、Sac I、 Sal I、Sac I 、Sal I 及Xba I的酶切位点.
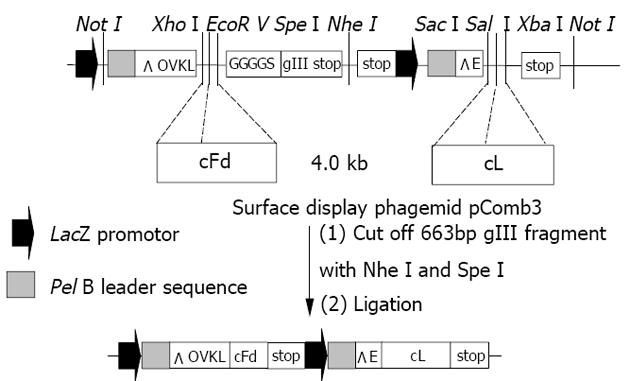
1.2.1 人鼠嵌合Fab抗体通用表达载体的构建: 以载体pComb3/HuFab为模板, 分别用两对引物扩增人IgG3CH1及κ轻链恒定区基因. PCR扩增产物经凝胶纯化试剂盒纯化并回收后, 分别与载体pMD18-T进行连接(具体步骤参见试剂盒说明书), 构建成克隆载体pMD18-T/HuCH1和pMD18-T/HuCκ, 并转化感受态大肠杆菌JM109挑选阳性克隆, 酶切鉴定后进行DNA序列分析. 以Sac I+Xba I分别双酶切表达载体pComb3和测序分析的克隆载体pMD18-T/Hu Cκ, 经琼脂糖凝胶电泳分离纯化目的片段后, 连接、转化, 筛选pComb3/Hu Cκ阳性克隆并进行酶切鉴定. 然后, 用Xho I+Spe I双酶切构建的pComb3/ HuCκ和已测序分析的克隆载体pMD18-T/Hu CH1, 重复连接、转化, 筛选及鉴定的步骤, 构建成嵌合Fab展示型通用载体pComb3C.
1.2.2 HAb18 cFab基因表达载体的构建: 分别以载体pMD18T-Fd和pMD18T-L为模板, 利用对应的引物扩增mAb HAb18重、轻链可变区基因, 同时引入相应的酶切位点. 然后, 用Sac I+Sal I分别双酶切表达载体pComb3C和经凝胶纯化试剂盒纯化并回收后的mAb HAb18重链可变区基因PCR扩增产物, 经琼脂糖凝胶电泳分离纯化目的片段后, 连接、转化, 筛选pComb3C/cL阳性克隆并进行酶切鉴定. 进而, 用Xho I+EcoR V双酶切构建的pComb3C/cL和经凝胶纯化试剂盒纯化并回收后的mAb HAb18轻链可变区基因PCR扩增产物, 重复连接、转化, 筛选及鉴定的步骤, 构建成嵌合Fab展示型载体pComb3C/cFab-gIII. 再以Spe I+Nhe I酶切已鉴定正确的重组子pComb3C/cFab-gIII中的gIII片段后, 直接用T4 DNA连接酶将其环化为分泌型的表达载体pComb3C/cFab, 再次进行转化、筛选和酶切鉴定等步骤, 获得目的克隆.
1.2.3 cFab的小量诱导表达及鉴定和检测: 分别取鉴定正确的pComb3/cFab重组菌和pComb3空载体转化菌1: 100分别接种于10 mL和5 mL新鲜SB-Amp (100 mg/L)液体培养基中, 250 r/min 37 ℃振荡培养至A600nm为0.6左右. 取出pComb3/Fab重组菌5 mL不加IPTG诱导剂, 其余菌液分别加入IPTG至终浓度1 mmol/L, 所有菌液均于250 r/min 30 ℃培养16 h. 将菌液12 000 g离心2 min收集菌体. 反复冻融后离心收集上清, 利用夹心ELISA检测cFab的表达, 设立嵌合HAb18IgG作为阳性对照, PBS作为空白对照(Yan ZY, et al. Jingbian Fenzishengwuxue Shiyan Zhinan Beijing: Science Press. 1998: 415-417). 分别收集和制备诱导菌的培养基上清、周质腔提取液、细胞质蛋白和不溶性沉淀物, 夹心ELISA检测cFab表达产物的定位.
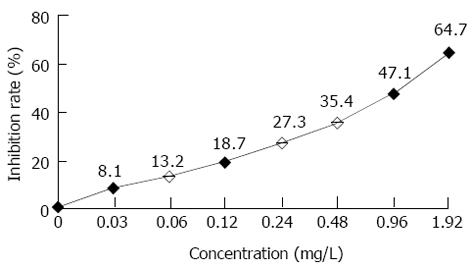
1.2.4 cFab表达产物的纯化及鉴定和检测: 同步骤1.2.3的条件诱导表达500 mL pComb3/cFab重组菌, 制备周质腔提取液, 具体操作步骤参见文献[10]. 样品于PBS缓冲液中4 ℃透析过夜后, 利用protein G亲合层析柱纯化, 具体纯化方法参见产品说明书. 纯化样品进行120 g/L SDS-PAGE凝胶电泳和Western Blot分析. (1)间接ELISA: 包被HAb18G[11] (mAb HAb18的相应抗原)胞外区的原核融合表达产物GST-HAb18GE和粗纯化的GST, 检测纯化cFab表达产物的抗原结合特异性, 以chHAb18为阳性对照, PBS为空白对照. (2)竞争性ELISA: 以粗纯化的GST-HAb18GE 4 ℃包被过夜, 用脱脂奶粉封闭后, 加入HRP-HAb18 (0.1 mg/L)与不同稀释度的cFab表达产物的等量混合物. 孵育洗涤后, 以TMB显色, 检测A450nm值, 并计算抑制率和相对亲和力. 抑制率(%) = [(对照组A值-抑制组A值)/对照组A值]×100%. (3)免疫荧光染色 制备高表达HAb18G的HHCC细胞悬液, 调整细胞密度至5×109/1×1010/L. 用马血清稀释HAb18 cFab后, 将其加入到适量HHCC细胞悬液中, 4 ℃作用30 min, 洗涤2次. 然后, 加入兔抗人IgG-FITC, 4 ℃作用30 min, 洗涤2次, 经固定、制片后, 于荧光显微镜下观察. 分别设立人IgG为阴性对照, PBS为空白对照.
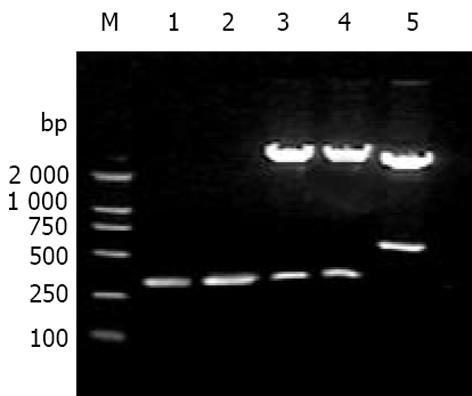
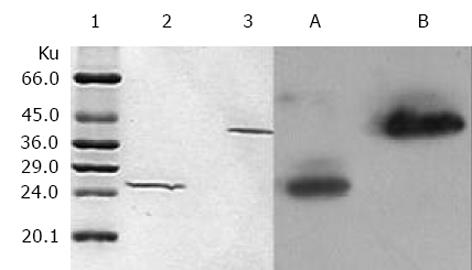
利用PCR成功扩增出与预期大小相符的人IgG3CH1及κ轻链恒定区基因片段(图1). 序列测定结果证实与已知的人IgG3CH1及κ轻链恒定区基因序列完全相符, 大小分别为324 bp和333 bp, 且同时正确引入了相应的酶切位点. 重组通用表达载体pComb3C酶切鉴定结果显示, 人IgG3CH1及κ轻链恒定区基因已正确插入载体pComb3中相应的酶切位点, 为单拷贝插入(图1).
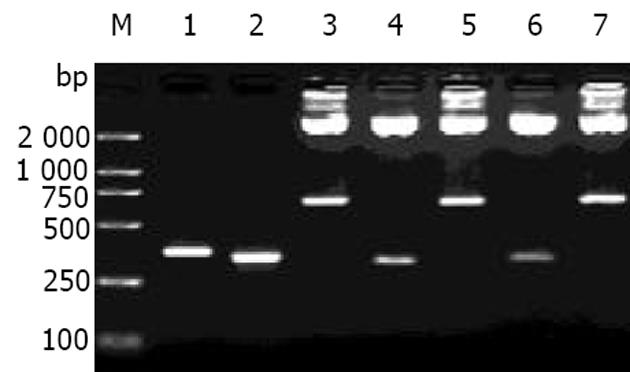
利用PCR成功扩增出与mAb HAb18重、轻链可变区基因预期大小相符的目的片段(图2). 酶切载体及相应基因片段后构建成重组表达载体pComb3C/cFab(图3). 酶切鉴定结果(图2)证实, 目的基因片段已正确插入载体pComb3C中相应的酶切位点. 序列分析结果显示, 嵌合Fd片段的VH及嵌合轻链的VL序列与已克隆的HAb18可变区序列完全相符, 并正确引入了相应的酶切位点, 同时鼠源的VH、VL分别与人IgG3CH1及κ轻链恒定区通过酶切位点EcoR V、Sal I获得正确组装, 且密码子读框正确.
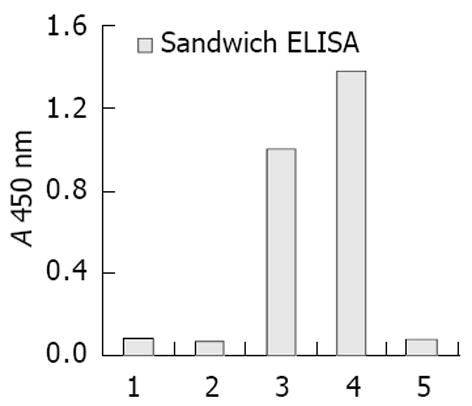
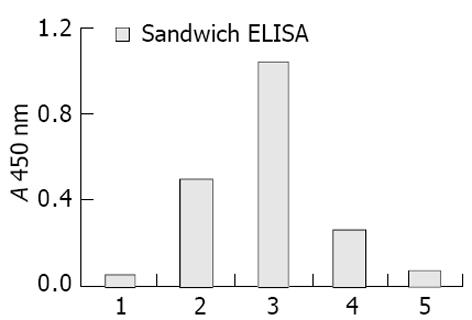
夹心ELISA检测证实: 重组载体pComb3C/cFab经IPTG诱导后成功的获得cFab抗体的表达(图4, 图5). cFab表达产物主要存在于周质腔中, 培养基上清和细胞质中也有小量存在, 而沉淀中则未检测到cFab的存在.
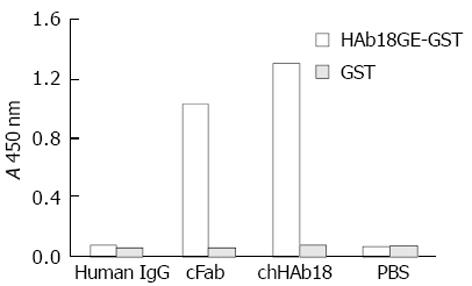
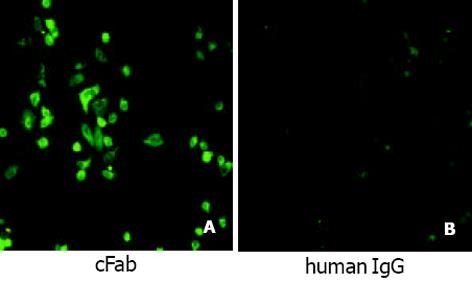
利用亲和层析从500 mL培养细菌中纯化获得了50 μg cFab表达产物. SDS-PAGE电泳和Western-Blot检测表明, 非还原状态下目的蛋白分子质量约为42 ku, 还原后改变为25 ku左右. 所有蛋白条带均与羊抗人IgG抗体特异结合(图6). 间接ELISA显示, 纯化的cFab可与HAb18G胞外区片段特异性结合(图7). 同时竞争性ELISA结果证实, 纯化的cFab可以与亲本鼠抗体竞争性结合同一抗原表位, 且竞争性作用随着抗体浓度的增加而增强(图8). 根据50%抑制率时cFab抗体与亲本鼠抗体浓度的比值, 可估计出其亲和力约为亲本鼠抗体HAb18的10%. 免疫荧光染色结果也表明, 纯化的cFab可与肝癌细胞株HHCC特异性结合(图9A), 阴性对照的细胞未见荧光染色(图9B).
单克隆抗体作为一种新型生物制剂在人类疾病的预防、诊断及治疗方面已显示出重要作用[12-14]. 然而, 鼠源性单抗属于异种蛋白而具免疫原性, 故在人体内应用时可产生不同程度的人抗鼠抗体(HAMA)反应, 因此其应用受到限制. 制备嵌合抗体、人源化抗体甚至完全人源性抗体可以程度不同的克服上述问题[15-16], 但由于完全人源性抗体和人源化抗体制备相对比较困难[17], 所以目前嵌合抗体是最常用于降低免疫原性的方法之一[18]. 嵌合抗体应用于临床治疗是安全有效的[19].
另外, 全抗体分子组织穿透能力较差, 在血液和非瘤组织的清除较慢, 从而导致相对较低的T/NT比值. 嵌合Fab抗体的Mr为50 Ku, 只有完整IgG的1/3, 具有较好的穿透性和药代动力学特征, 且能较好地保持结合抗原的活性因而成为当今应用较多的一种基因工程抗体类型[20-21]. cFab由于没有Fc段, 从理论上减少了发生非特异性结合, 产生排斥反应的机会. 和完整抗体相比, cFab没有抗体依赖的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC), 因而主要作为载体分子用于疾病的导向诊断和治疗, 也可以进一步加工改造用于制备基因工程嵌合F(ab)2的抗体形式[22].
由于嵌合Fab不需要翻译后修饰, 所以目前应用最多的为原核表达系统[23]. 所用pComb3该系统中最为常见的噬粒表达载体之一, 含有两套启动子、前导肽及多克隆位点, 可同时使cFd和轻链基因在大肠杆菌中共表达. 表达产物在引导肽引导下, 可分泌进入大肠杆菌的周质腔, 在周质腔中形成二硫键并折叠成正确的空间构像, 并以有活性的可溶状态存在, 但也可由于未知的"渗漏"机制, 而导致cFab进入培养上清. 相对于以包涵体形式表达的蛋白而言, 分泌表达最大的优点是表达的抗体活性较高且便于纯化, 无须进行重新折叠复性等复杂的处理过程, 同时可避免细菌蛋白酶的降解, 降低抗体蛋白对宿主细胞的毒性作用, 但产量一般低于包涵体表达.
为了利于将各种鼠源性抗体方便的改造成嵌合Fab的形式, 避免每一次构建时均要进行嵌合Fd和嵌合轻链拼接的烦琐, 并尽量减少拼接部位个别氨基酸的改变对嵌合Fab抗体结构与功能活性的不确定影响, 我们首先将人IgG3CH1和κ轻链恒定区基因克隆至原核分泌表达载体pComb3中, 成功构建了一个人鼠嵌合Fab抗体通用表达载体pComb3C, 从而使鼠源性VH、VL与人IgGCH1、κ轻链恒定区基因拼接部位的氨基酸构成得以固定. 并通过抗人肝癌相关抗原HAb18G嵌合Fab抗体的表达证实了拼接部位的氨基酸构成对片段抗体的活性无明显影响. 其次, 我们先后将mAb HAb18重、轻链可变区基因亚克隆到载体pComb3C中相应的内切酶位点, 然后用SpeⅠ和NheⅠ双酶切去除gIII 基因而得到可溶性cFab的表达载体. ELISA和免疫细胞化学检测均证实, cFab获得表达, 并具有较好的亲和力和特异性, 但纯化的结果显示表达产物的分泌量较低. 原因可能有两个方面: 一是外源基因本身对产量的影响, 这在我们表达HAb18的鼠源性Fab抗体时也有体现. 二是可能表达的条件不够优化. 根据Raffai et al[24]的报道, 在Fab的表达中, 选用不同的大肠杆菌菌株在表达量和表达抗体的活性上会有所不同. 因此, 如何提高HAb18 cFab的表达量, 仍是进一步需要解决的关键问题. 目前, 我们也正在尝试通过大肠杆菌非分泌性表达的形式来获得大量的高活性cFab抗体, 以期为进一步探讨该类抗体在肝癌治疗中的应用奠定良好的基础.
编辑: N/A
| 2. | 骞 爱荣, 商 澎, 李 郁, 黄 宝成, 朱 平, 梅 其炳, 陈 志南. HAb18G/CD147拮抗肽抗肝癌转移作用的体外实验. 世界华人消化杂志. 2003;11:255-259. [DOI] |
| 3. | Lou C, Chen ZN, Bian HJ, Li J, Zhou SB. Pharmacokinetics of radioimmunotherapeutic agent of direct labeling mAb 188Re-HAb18. World J Gastroenterol. 2002;8:69-73. [PubMed] [DOI] |
| 4. | Yang LJ, Sui YF, Chen ZN. Preparation and activity of conjugate of monoclonal antibody HAb18 against hepatoma F(ab')(2) fragment and staphylococcal enterotoxin A. World J Gastroenterol. 2001;7:216-221. [PubMed] [DOI] |
| 5. | Bian HJ, Chen ZN, Deng JL. Direct technetium-99m labeling of anti-hepatoma monoclonal antibody fragment: a radioimmunoconjugate for hepatocellular carcinoma imaging. World J Gastroenterol. 2000;6:348-352. [PubMed] [DOI] |
| 6. | Qiu K, Wang BC, Chen ZN, Fang P, Liu CG, Wan WX, Liu YF. 99mTc-labeled HAb18 McAb Fab fragment for radioimmunoimaging in nude mice bearing human hepatocellular carcinoma. World J Gastroenterol. 1998;4:117-120. [PubMed] [DOI] |
| 8. | Hasholzner U, Stieber P, Meier W, Lamerz R. Value of HAMA--determination in clinical practice--an overview. Anticancer Res. 1997;17:3055-3058. [PubMed] |
| 9. | Souriau C, Hudson PJ. Recombinant antibodies for cancer diagnosis and therapy. Expert Opin Biol Ther. 2003;3:305-318. [PubMed] [DOI] |
| 10. | He FT, Nie YZ, Chen BJ, Qiao TD, Fan DM, Li RF, Kang YS, Zhang Y. Expression and identification of recombinant soluble single-chain variable fragment of monoclonal antibody MC3. World J Gastroenterol. 2002;8:258-262. [PubMed] |
| 12. | Goldenberg DM. Advancing role of radiolabeled antibodies in the therapy of cancer. Cancer Immunol Immunother. 2003;52:281-296. [PubMed] |
| 13. | Trail PA, King HD, Dubowchik GM. Monoclonal antibody drug immunoconjugates for targeted treatment of cancer. Cancer Immunol Immunother. 2003;52:328-337. [PubMed] |
| 14. | Milenic DE. Monoclonal antibody-based therapy strategies: providing options for the cancer patient. Curr Pharm Des. 2002;8:1749-1764. [PubMed] [DOI] |
| 15. | Chuntharapai A, Lai J, Huang X, Gibbs V, Kim KJ, Presta LG, Stewart TA. Characterization and humanization of a monoclonal antibody that neutralizes human leukocyte interferon: a candidate therapeutic for IDDM and SLE. Cytokine. 2001;15:250-260. [PubMed] [DOI] |
| 17. | Caldas C, Coelho V, Kalil J, Moro AM, Maranhão AQ, Brígido MM. Humanization of the anti-CD18 antibody 6.7: an unexpected effect of a framework residue in binding to antigen. Mol Immunol. 2003;39:941-952. [PubMed] [DOI] |
| 18. | Carter P. Improving the efficacy of antibody-based cancer therapies. Nat Rev Cancer. 2001;1:118-129. [PubMed] [DOI] |
| 19. | Linenberger ML, Maloney DG, Bernstein ID. Antibody-directed therapies for hematological malignancies. Trends Mol Med. 2002;8:69-76. [PubMed] [DOI] |
| 20. | Hellstrom HR. Platelet glycoprotein IIb/IIIa inhibitors. Circulation. 2003;107:E39-E39. [PubMed] [DOI] |
| 22. | Humphreys DP, Vetterlein OM, Chapman AP, King DJ, Antoniw P, Suitters AJ, Reeks DG, Parton TA, King LM, Smith BJ. F(ab')2 molecules made from Escherichia coli produced Fab' with hinge sequences conferring increased serum survival in an animal model. J Immunol Methods. 1998;217:1-10. [PubMed] [DOI] |
| 23. | Maeda F, Nagatsuka Y, Ihara S, Aotsuka S, Ono Y, Inoko H, Takekoshi M. Bacterial expression of a human recombinant monoclonal antibody fab fragment against hepatitis B surface antigen. J Med Virol. 1999;58:338-345. [PubMed] [DOI] |
| 24. | Raffaï R, Vukmirica J, Weisgraber KH, Rassart E, Innerarity TL, Milne R. Bacterial expression and purification of the Fab fragment of a monoclonal antibody specific for the low-density lipoprotein receptor-binding site of human apolipoprotein E. Protein Expr Purif. 1999;16:84-90. [PubMed] [DOI] |