修回日期: 2004-10-10
接受日期: 2004-10-20
在线出版日期: 2004-12-15
目的: 探讨H1阻滞剂扑尔敏、H2阻滞剂法莫替丁协同作用治疗幽门结扎胃溃疡的疗效.
方法: 建立幽门结扎致胃溃疡模型, 40只SD大鼠随机分为五组: 正常组、模型组、法莫替丁组(famotidin, FMD 4 mg/kg)、扑尔敏组(chlorpheniramine, CPA 10 mg/kg)、联合用药组(FMD+CPA), 于给药3 d后造模, 造模3 h后处死搜集标本. 用肉眼、光镜观察胃标本的病理学改变, 按Okabe法改良法计算溃疡指数(UI); 滴定法测胃液酸度; 生化法测定肝组织匀浆中的髓过氧化物酶(MPO)的含量; 放免分析法测定血浆IL-8.
结果: 与模型组比较, FMD组与FMD+CPA联合组的溃疡指数均明显下降(2.25±0.46 vs 3.75±0.46, P = 0.007<0.01, 1.75±0.46 vs 3.75±0.46, P = 0.002<0.01)胃酸度明显下降(22±14.78 vs 50.63±19.03 mmol/L, P = 0.001<0.01; 20.6±17.57 vs 50.63±19.03 mmol/L, P = 0.0 008<0.01); FMD组与FMD+CPA组之间无差异(P>0.05), 提示FMD组与FMD+CPA联合组治疗胃溃疡均疗效明显; 但是FMD+CPA联合组与FMD组的大鼠血浆IL-8及肝组织MPO相比要明显低(IL-8: 0.32±0.05 vs 0.47±0.08 μg/L, P = 0.024<0.05; MPO: 4.25±0.87 vs 8.17±1.29 U/L, P = 0.0 017<0.01), 提示扑尔敏有抗炎作用, 法莫替丁与扑尔敏联合应用抗炎作用显著.
结论: H1、H2受体阻滞剂协同作用治疗幽门结扎胃溃疡能取得良好的疗效, 尤其抗炎作用显著, 其机制与减少炎症因子的产生, 减少对胃黏膜的损伤, 改善胃黏膜血流有关.
引文著录: 覃珍, 陈超. 法莫替丁与扑尔敏协同作用治疗幽门结扎胃溃疡的实验研究. 世界华人消化杂志 2004; 12(12): 2867-2871
Revised: October 10, 2004
Accepted: October 20, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2867-2871
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2867.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2867
胃溃疡是一种世界性的常见病、多发病, 总发病率可能占人口的10-12%, 其发病原因及发病机制尚未完全阐明. 但近年来发现胃酸分泌过多、幽门螺杆菌(H pylori)感染和胃黏膜保护作用减弱等因素是引起消化性溃疡的主要环节[1]. 胃溃疡病灶中大量肥大细胞浸润[2], 肥大细胞受刺激释放组胺, 作用于H2受体引起胃酸分泌, 作用于H1受体引起血管扩张和通透性增高、炎性细胞浸润等炎症反应. 组胺H2受体阻滞剂应用于胃溃疡的治疗, 取得了良好的效果, 对胃酸分泌的抑制率达到了60-95%, 但治愈后溃疡易复发. 国外研究表明, 组胺H1受体阻滞剂能增加胃黏膜的血流, 抑制炎症递质的产生, 而减轻对胃黏膜的损害[3]. 他还能影响细胞免疫反应, 故由此推测组胺H1和H2受体阻滞剂协同作用既可以抑制胃酸的分泌, 又能阻断组胺对胃黏膜的作用, 从而具有减轻溃疡的形成及发展的作用. 我们应用组胺H1受体阻滞剂扑尔敏(chlorpheniramine, CPA)和H2受体阻滞剂法莫替丁(famotidin, FMD)对大鼠胃溃疡进行研究.
♂Sprague-Dawley清洁级大鼠40只, 180-220 g, 购自华中科技大学同济医学院实验动物中心. 合格证号: TJLA-2004-159. 自由摄食饮水, 12 h明/12 h暗(光照时间6: 00-18: 00), 22-30 ℃条件下饲养1 wk后实验. 法莫替丁注射液, 上海信谊金朱药业有限公司, 批号: 031003; 扑尔敏注射液, 批号: 2004031644. 硫喷妥钠注射液; 批号: 010017; IL-8放射免疫分析测定盒(购自北京北方生物技术研究所); 髓过氧化物酶(MPO)试剂盒(购自南京建成生物工程研究所 ); 其余试剂均为市售分析纯产品. 721分光光度计, 上海第三分析仪器厂; 放免测量仪器采用上海核辐光电仪器有限公司的SN-6 95型智能放射免疫γ计数器.
采用幽门结扎型大鼠胃溃疡模型[4]. ♂SD大鼠40只每组8只, 随机分为五组: 正常组(blank)、模型组(control等容生理盐水)、法莫替丁组(FMD 4 mg/kg、扑尔敏组(CPA 10 mg/kg)、联合组(FMD+CPA, 剂量同上). 分别按上述剂量连续给药3 d, ip1次/d. 于第2 d开始禁食不禁水, 共48 h, 末次给药后用10 g/L硫喷妥钠麻醉下开腹结扎幽门, 缝合腹壁切口. 3 h后开腹、胸, 心脏采血6 mL至试管4 ℃静置. 5 500 r/min, 离心 15 min, 分离血浆于-70 ℃保存待测相关指标; 胸腔剪断胃管, 经此抽空胃液至试管, 然后注入40 g/L的甲醛4 mL固定, 贴标签. 记录胃液量, 以1 500 r/min离心10 min, 取上清液用滴定法测定胃液总酸度, 计算总酸排出量.
1.2.1 胃酸度的测定: 胃酸测定[5]: 用移液管取胃液上清液0.5 mL于锥形瓶中, 加入1滴酚酞指示剂, 用0.01 mol/L的NaOH滴定至胃液先呈黄色再转为红色2 s内不消失为终点, 记录消耗的NaOH的毫升数.
胃酸浓度(mmol/L) = NaOH滴定消耗的毫升数×10×稀释倍数
1.2.2 胃损伤指数的测定: 将大鼠处死, 向胃内注入10 mL 40 g/L甲醛, 取出胃并置同一浓度甲醛中充分固定. 沿胃大弯剪开, 轻轻洗去胃内容物, 按Okabe指数评定法计算出胃黏膜损伤指数(ulcer indexs, UI). 溃疡标准参照Okabe法改良[6]. 0分: 无损伤; 1分: 红肿; 2分: 轻度损伤, 1-7个小溃疡, 直径或长度<3 mm; 3分: 较大损伤, 1-3个大溃疡, 直径或长度>3 mm, 或多于7个小溃疡; 4分: 严重损伤, 多于3个大溃疡; 5分: 溃疡穿孔. 常规计算溃疡发生率、溃疡指数及溃疡抑制率. 资料行组间student-t检验. 溃疡程度: 按病变情况, 分为4级: 一级(糜烂): d(溃疡直径)<1 mm; 二级(小溃疡): 1 mm<d<3 mm; 三级(大溃疡): d>3 mm; 四级(有穿孔).
1.2.3 血白介素-8(IL-8)采用放射免疫学方法测IL-8, 试剂盒购于北京北方生物技术研究所. 按碘标记的IL-8放免试剂盒要求操作, 用γ-闪烁仪测放射性, 并换算为μg/L.
1.2.4 髓过氧化物酶(MPO): 采用比色法, 测定原理: 中性白细胞中存在有髓过氧化物酶, 每个细胞所含的酶的量是一定的, 约占细胞干重的5%, 该酶具有使过氧化氢还原的能力, 利用这一特点可以分析酶的活力, 并定量测定中性白细胞的数目. 通过供氢体邻连茴香胺供氢后生成黄色化合物, 在460 nm处通过比色测定此产物的生成量, 从而推算出MPO的活力及H2O2的减少量和白细胞的数目. 药盒由南京生物建成有限公司提供, 按试剂说明进行操作, 于721型分光光度计上读取A值, 通过计算获得结果.
统计学处理 采用SPSS软件10.0版本进行数据统计处理, 计量资料描述方法采用mean±SD表示, 对两个变量之间计量资料的比较进行t检验, P<0.05为差异显著.
2.1 如表1所示, 模型组与正常组的溃疡指数相比明显大, 有显著意义(P<0.01), 提示造模成功.
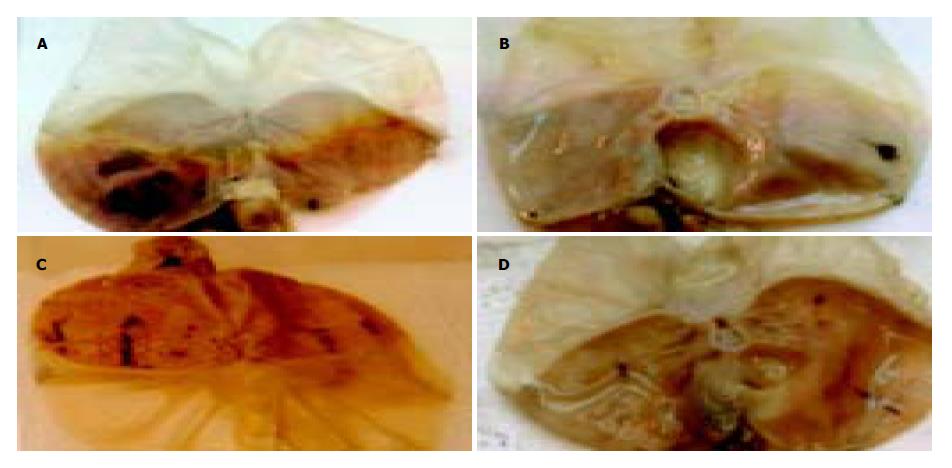
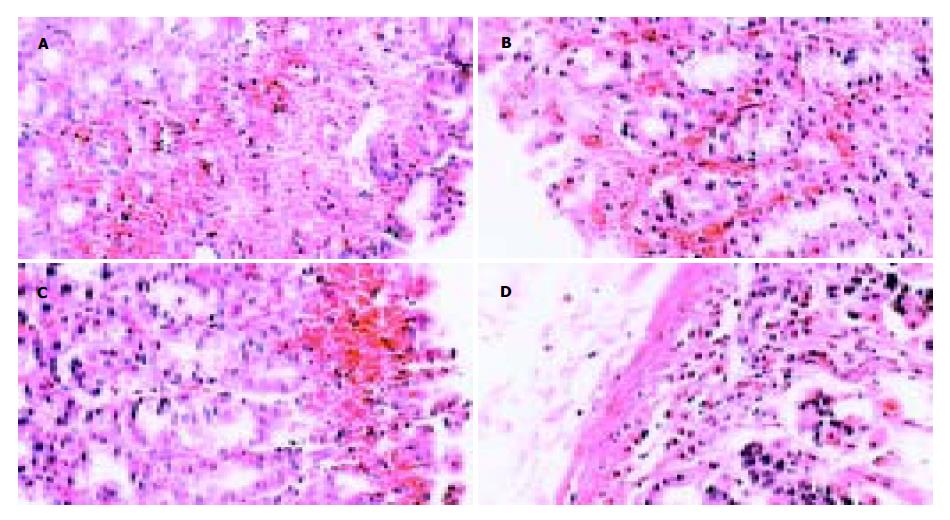
2.2 肉眼观胃黏膜病变浅表, 散在分布, 直径0.1-1 cm, 伴点状、片状或条状出血, 或呈大小不等的淤点、淤斑. 糜烂底部多有出血或被以血痂, 有时外观呈黑褐色. 镜下病变黏膜表面细胞可出现空泡变性、坏死、溶解和脱落, 致使黏膜面连续破坏. 黏膜固有层可出现明显的充血、水肿、红细胞渗出或出血, 严重时可波及黏膜下层和肌层(图1-2).
2.3 FMD组与FMD+ CPA联合组的溃疡指数和胃酸度与模型组比较有显著差异性(P<0.01), FMD组与FMD+CPA联合组之间无显著差异性, 但联合组的胃酸度的值要低一些, 溃疡抑制率要高一些; CPA组的溃疡指数与模型组比较无显著差异性(表1).
2.4 与FMD组相比, FMD+CPA联合组的IL-8、MPO要明显低, 有显著差异性(P<0.05), 提示扑尔敏有抗炎作用, 法莫替丁与扑尔敏联合应用抗炎作用显著(表1).
胃溃疡的病因迄今仍未明确, 由于这一原因使临床治疗远未达到预期目的. 随着对胃溃疡的深入研究, 人们对细胞因子在胃溃疡发病中的作用有了进一步的认识. 细胞因子不仅能引起炎症细胞的聚集与活化, 刺激胃泌素的释放增加, 还能通过刺激前列腺素和生长抑素的释放, 减少酸的分泌而抑制溃疡的生成. 由细胞因子引发了炎症细胞、胃泌素、前列腺素、生长抑素及酸分泌的调节, 于是这些因素的失衡决定了胃溃疡的临床表现[7]. 可见细胞因子是造成胃黏膜损害、胃溃疡的重要直接因素. 国内外许多研究证实炎性细胞因子在胃肠黏膜损害中发挥了重要作用, 主要有血小板活化因子(PAF)、肿瘤坏死因子(TNF)、白介素(IL)和粒-单核细胞克隆刺激因子. 其机制与以下因素有关[8]: (1)通过增加血管通透性, 引起血压下降和血管收缩, 减少胃肠黏膜血流量; (2)作用于胃肠道中的中性粒细胞, 使其活化、粘附、游出, 通过"呼吸爆发"产生氧自由基、白三烯(LTs)等炎性递质, 释放消化酶, 引起胃肠黏膜损害; (3)血小板活化因子(PAF)、肿瘤坏死因子(TNF)、白介素Ⅰ(IL-1)和粒-单核细胞克隆刺激因子等相互诱导、合成、释放和协同作用, 引起血管组织损伤的正反馈, PAF和TNF在开始阶段起着关键作用; (4)细菌内毒素也是致胃肠黏膜损伤的重要因子, PAF可与内毒素协同作用引起胃肠黏膜损伤上. LTs可明显收缩胃黏膜下微血管, 导致黏膜充血、血浆外渗、血流淤滞和血流量下降, 最终导致胃黏膜缺血. IL-8是一种化学因子, 分子质量约为8 ku, 主要由单核巨噬细胞、血管内皮细胞等受到细菌脂多糖(LPS)、TNF、IL-1等刺激产生, 可趋化和激活中性粒细胞, 后者在炎症中起重要作用[9]. 胃黏膜上皮细胞和单核巨噬细胞分泌的IL-8以及其他趋化因子可趋化和激活炎症细胞, 使他们从血管内移行至胃上皮处, 导致炎症反应[10-11]. MPO活性是间接反映炎症程度的重要指标[12].
幽门结扎法为Shay's传统经典大鼠胃溃疡模型法, 因其发病机制、病理表现与人类胃溃疡相似, 常用于胃溃疡治疗药物的筛选与评价. 结扎幽门后, 胃液滞留胃中, 胃壁防御能力减弱, 导致溃疡形成. 溃疡多为圆形或椭圆形.此法方法可靠, 重复性好, 省时. 胃幽门结扎后, 胃液酸度增加, H+逆向弥散入黏膜组织内的刺激肥大细胞脱颗粒, 释放组胺、LTs等炎性递质. 组胺兴奋胃黏膜下小动脉H1受体, 使毛细血管前括约肌扩张、微血管收缩, 导致毛细血管后静脉内压力升高、毛细血管前括约肌和小动脉后的血管运动减弱, 最终引起胃黏膜充血、微血管通透性增加, 并造成胃黏膜水肿、黏膜有效灌注压下降进而加重胃黏膜缺血, 同时造成胃内H+更加增高[13]. 此外, 在酸性增强的环境下又刺激活化胃蛋白酶元引起自身消化, 从而有利于溃疡的发生, 故组胺在胃溃疡的形成中发挥了重要作用. H2受体阻滞剂治疗胃溃疡已得到公认, 但复发率较高. 我们联合应用H1、H2受体阻滞剂证实疗效更好.
H1受体阻滞剂是一类能竞争性拮抗组胺, 与特异性的H1受体结合而发挥作用的药物. 他们主要应用于抗变态反应性疾病. 近年来国外最新研究表明, H1受体阻滞剂除具有上述作用外, 还表现出较强的抗炎和免疫调节活性. Cook et al[14]研究了不同浓度的H1受体阻滞剂olopatadine, 用于处理人眼结膜上的肥大细胞, 然后用抗IgE抗体致敏, 测定肥大细胞脱颗粒释放TNF的量, 结果发现olopatadine剂量依赖性减少TNF的生成量, 其IC50 = 13.1 microM, IC0 = 3 micro M, 说明olopatadine通过减少TNF的生成而具有抗炎及抗变态反应的作用; Bakker et al[15]报道H1受体作为核因子激活机制的一个部分或完全作为激动剂来激活转录因子. Miki et al[16]研究发现组胺能剂量依赖性增强TNF-α诱导的E-选择素和细胞内黏附分子的表达, 且此种作用能被H1受体阻滞剂美吡拉明、苯海拉明阻滞, H2受体阻滞剂雷尼替丁没有此作用. Arnold et al[17]研究证实西替利嗪能减少IL-8的释放, 其机制是降低IL-8的基因表达来实现. 而我们的实验显示, FMD+CPA显著减轻大鼠胃黏膜损伤程度, 明显减少炎症因子IL-8的产生, 表现出明显的胃黏膜损伤保护作用, 而且FMD+CPA联合明显降低MPO活性, 显示出较好的抗炎效果, 与国外报道结果一致.
总之, 联合应用H1、H2受体阻滞剂治疗胃溃疡能取得良好的疗效, 其机制与减少炎症因子的损伤, 改善胃黏膜血流有关.
编辑: N/A
| 3. | Ohta Y, Kobayashi T, Ishiguro I. Role of endogenous serotonin and histamine in the pathogenesis of gastric mucosal lesions in unanaesthetised rats with a single treatment of compound 48/80, a mast cell degranulator. Pharmacol Res. 1999;39:261-267. [PubMed] [DOI] |
| 7. | Lehmann FS, Stalder GA. Hypotheses on the role of cytokines in peptic ulcer disease. Eur J Clin Invest. 1998;28:511-519. [PubMed] [DOI] |
| 8. | 胡 根林, 郭 汉身. 血小板活化因子与胃肠损伤. 国外医学?消化系疾病分册. 1995;15:17-19. |
| 9. | Reimund JM, Wittersheim C, Dumont S, Muller CD, Kenney JS, Baumann R, Poindron P, Duclos B. Increased production of tumour necrosis factor-alpha interleukin-1 beta, and interleukin-6 by morphologically normal intestinal biopsies from patients with Crohn's disease. Gut. 1996;39:684-689. [PubMed] [DOI] |
| 10. | Sharma SA, Tummuru MK, Blaser MJ, Kerr LD. Activation of IL-8 gene expression by Helicobacter pylori is regulated by transcription factor nuclear factor-kappa B in gastric epithelial cells. J Immunol. 1998;160:2401-2407. [PubMed] |
| 11. | Crabtree JE. Role of cytokines in pathogenesis of Helicobacter pylori-induced mucosal damage. Dig Dis Sci. 1998;43:46S-55S. [PubMed] |
| 12. | Li JH, Yu JP, He XF, Xu XM. Expression of NF-kB in rats with TNBS-induced ulcerative colitis. Shijie Huaren Xiaohua Zazhi. 2003;11:214-218. |
| 14. | Cook EB, Stahl JL, Barney NP, Graziano FM. Olopatadine inhibits TNFalpha release from human conjunctival mast cells. Ann Allergy Asthma Immunol. 2000;84:504-508. [PubMed] [DOI] |
| 15. | Bakker RA, Schoonus SB, Smit MJ, Timmerman H, Leurs R. Histamine H(1)-receptor activation of nuclear factor-kappa B: roles for G beta gamma- and G alpha(q/11)-subunits in constitutive and agonist-mediated signaling. Mol Pharmacol. 2001;60:1133-1142. [PubMed] |
| 16. | Miki I, Kusano A, Ohta S, Hanai N, Otoshi M, Masaki S, Sato S, Ohmori K. Histamine enhanced the TNF-alpha-induced expression of E-selectin and ICAM-1 on vascular endothelial cells. Cell Immunol. 1996;171:285-288. [PubMed] [DOI] |
| 17. | Arnold R, Rihoux J, K?nig W. Cetirizine counter-regulates interleukin-8 release from human epithelial cells (A549). Clin Exp Allergy. 1999;29:1681-1691. [DOI] |