修回日期: 2004-10-31
接受日期: 2004-11-12
在线出版日期: 2004-12-15
目的: 了解大肠侧向发育型肿瘤(laterally spreading tumor, LST)线粒体DNA的突变, 探讨其与肿瘤发生的关系.
方法: 提取LST线粒体DNA(mtDNA), 扩增D-环区, 产物用DNA自动测序法进行序列分析.
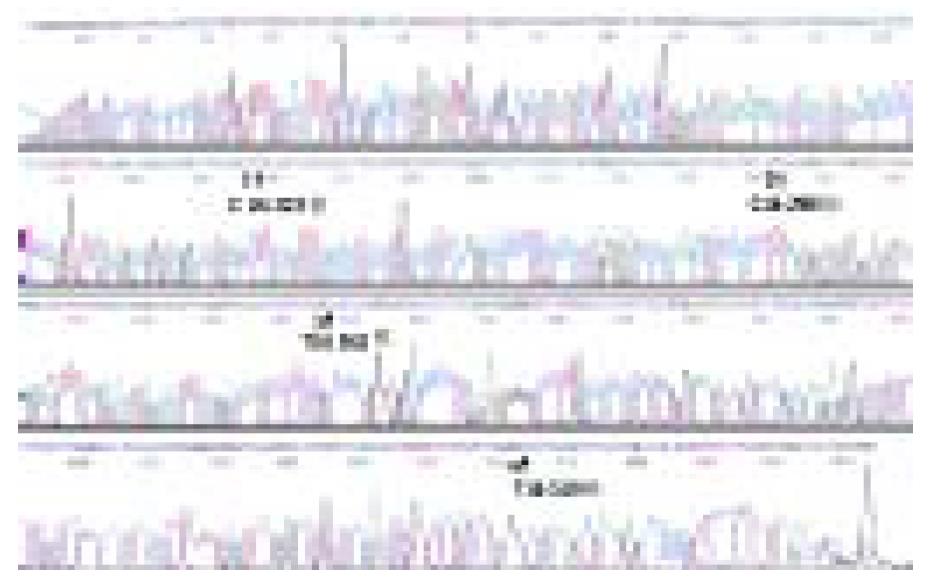
结果: 共检测到4个碱基突变. 第16 223位C突变为T, 第16 298位C突变为T, 第16 362位T突变为C, 第16 519位T突变为C.
结论: 线粒体DNA D-环区是一个具有高度多态性和突变性的区域, 在LST中突变率较高.
引文著录: 宋卫兵, 吴倩倩, 阎丽, 马莉, 肖冰. 大肠侧向发育型肿瘤线粒体DNA D-环区的突变. 世界华人消化杂志 2004; 12(12): 2865-2867
Revised: October 31, 2004
Accepted: November 12, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2865-2867
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2865.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2865
肿瘤发生是一个多步过程. 在研究细胞核中癌基因、抑癌基因的变化方面, 人类取得了很大成就, 但仍有许多问题不能仅用核基因的变化解释[1-2]. 一系列实验表明染色体外存在抑癌因素, 维持细胞的肿瘤特性需要线粒体DNA的参与[1,3]. 人类的线粒体基因组是环状、双链DNA, 分成编码区和非编码区, 即D-环区. D-环区包括重链的复制起点等重要序列. 线粒体DNA的结构特点及其在DNA复制和损伤修复方面的特性使他的突变率比核染色体高10-100倍[4-5]. 大肠侧向发育型肿瘤(laterally spreading tumor, LST). 主要沿黏膜表面呈侧向浅表扩散, 国内对其的研究尚不多. 哺乳动物线粒体DNA为核外重要遗传物质, 其突变与细胞癌变之间的关系已引起重视, 本文用DNA自动测序方法, 测定了LST线粒体DNA D-环区基因序列, 旨在了解他们的变异, 探讨线粒体基因突变与肿瘤发生的关系.
LST细胞株为本研究所自建[6], 含100 mL/L小牛血清的RPMI1640培养, 为杭州特诺公司产品, 线粒体DNA的提取试剂盒为杭州唯特洁公司产品. PCR纯化为OMEGA公司的PCR纯化试剂盒.
1.2.1 LST细胞的培养及线粒体的提取: LST细胞培养在含100 ℃ mL/L小牛血清的RPMI1640培养液中, 35 mL培养瓶培养, 置于37 ℃, 50 mL/L CO2培养箱, 隔天换液. 当细胞铺满瓶底时, 按DNA的提取试剂盒说明书进行线粒体DNA的提取.
1.2.2 D-环区的PCR扩增: 上游引物5'-ATCGGATCCTTCATGGGGAAGCAGATTTGG-3'下游引物: 5'-ACGCTCGAGGGAGGTAAGCTACATAAACTG-3'. PCR的反应体积是25 μL, 包括各1 μL的两种引物(20 μmol/L), 1 μL的10×Buffer, 12.5 μL PFU, l μL的LST细胞mtDNA. 8.5 μL去离子双蒸水补至25 μL. 用PCR仪(GeneAmp9600, 美国Perkin Elmer)进行反应: 起始变性温度94 ℃, 2 min, 以下过程进行33个循环: 变性温度94 ℃, 30 s; 复性温度56 ℃, 30 s; 延伸温度72 ℃, 30 s, 结束延伸温度72 ℃, 2 min.
1.2.3 产物的证实、纯化和测定: 取2 μL的反应产物, 在15 g/L的琼脂糖凝胶上电泳, 确定D-环区成功扩增后, 用快速PCR纯化试剂盒对反应产物进行纯化, 送上海博亚公司测序. 将肿瘤组织线粒体DNA D-环区序列与正常组织的进行对比, 并与基因库数据(http://WWW.Infinity. gen. emory. edu/mitomap. html)对照. 当线粒体DNA D-环区的核苷酸顺序与正常顺序不同时, 即为突变; 用TaKaRa公司的EXTaq酶重新扩增, PCR的反应体积是50 μL, 包括各2 μL的两种引物(20 μmol/L), 5 μL的10×Buffer, 4 μL dNTP, 0.25 μL EXTaq酶4 μL的LST细胞mtDNA, 22.75 μL去离子双蒸水补至50 μL. 反应条件同前. 用重新合成引物: Primer1 A(bp68): 5'-atcATCGGATCCTTCATGGGGAAGCAGATTTGG-3', Primer1 B(bp1205C): 5'-acgACGCTCGAGGGAGGTAAGCTACATAAACTG-3'重新扩增线粒体D-环区, 再次测序, 证实了突变确实存在.
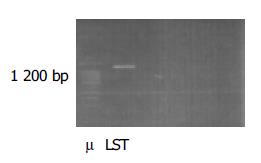
LST细胞线粒体DNA提取后, 使用引物经PCR扩增, 其片段长度均约为1 200 bp(图1).
经DNA正, 反向自动测序, 获得的细胞D-环全序列长1 119 bp(图2). 结果显示, 有第16 223位C突变为T, 第16 298位C突变为T, 第16 362位T突变为C, 第16 519位T突变为C.
大肠侧向发育型肿瘤(laterally spreading tumor, LST)的概念由日本学者工藤进英(Kudo Sinea)首先提出, 指起源于大肠黏膜的一类隆起型病变. 这类病变极少向肠壁深层垂直侵犯, 而主要沿黏膜表面呈侧向浅表扩散, 故被称为侧向发育型肿瘤. LST病变形态和发生发展上有一定的特殊性, 不同于一般的腺瘤, 因此日本学者将之单独列为一类肿瘤进行研究. 据日本的一些大宗研究报道[7], LST与大肠癌的关系密切, LST病变合并大肠癌的比例为8.4-52.5%, 并已有动态观察表明LST可以在3年内发展为进展期大肠癌[8]. 国内对LST的研究尚不多. 哺乳动物线粒体DNA(mitochondrial DNA, mtDNA)为一长度约16.5 kb的环状双链分子. 含有自我复制、转录和翻译的遗传体系. 基因组包含2个rRNA基因, 22个tRNA基因和编码氧化磷酸化复合物体系中13种多肽的mRNA基因[9]. mtDNA作为核外重要遗传物质, 不受组蛋白保护, 修复系统功能不完善, 比核DNA更易受诱变因素的损伤[10-11]. 因而, 易成为化学致癌物攻击的靶分子, 其突变与细胞癌变之间的关系已引起重视[12]. 肿瘤的发生涉及多因素多环节过程, 研究者们不仅注意到核基因的变化, 而且也注意到了核外遗传物质的变化. 人类的线粒体基因组分成编码区和非编码区, 即D-环区. D-环区包括重链的复制起点等重要序列. 线粒体DNA的结构特点及其在DNA复制和损伤修复方面的特性使他的突变率比核染色体高10-100倍[13-15], Kornelia et al[16]对10个人类结直肠癌细胞系线粒体DNA序列分析后提出: D-环区是突变发生的热点. 但不同的肿瘤, 有关该区突变频率的报道存在明显差异[16-20]. 我们的研究中, 共检测到4个突变. 与文献资料基本一致[20]. mtDNA突变可导致肿瘤, 已为人们所公认, 但机制尚不完全清楚. 近年来, 人们把目光逐渐转向mtDNA与核DNA的相互作用方面, 试图找到其中的联系. 结果发现, 在一定条件下, mtDNA和核DNA序列可以在细胞内游走, 形成二者部分遗传物质的交换或插入. 有研究证实部分胃癌及其癌前病变细胞核基因组中存在mtDNA序列, 提示mtDNA可整合到核基因组中, 其意义值得进一步研究. 我们推测这种整合至少可通过两条途径引起细胞癌变: (1)引起核基因组的不稳定性, 抑制肿瘤抑制基因的活性或激活癌基因的活性; (2)改变细胞能量产生, 提高线粒体氧化压力, 引起线粒体酶表达异常和/或调控凋亡等途径来影响细胞的生物学行为, 但以上推论尚需进一步研究来证实. 多数消化系肿瘤具有高频率mtDNA细胞突变, 突变型mtDNA易在各种癌的体液中检测到. 由于他们的克隆特性和高拷贝数, 线粒体突变可能为癌的非侵入性诊断提供一种有效分子标记[21].
LST细胞线粒体D-环区是一个具有高度突变性和多态性的区域, 该区域突变在其肿瘤发生和发展过程中的作用有待进一步研究. LST作为一种特殊形态的肿瘤, 其发生发展的机制及其与恶性肿瘤的联系尚不是很清楚, 其线粒体的突变也可作为一个研究点, 为消化系肿瘤的防治提供一条新的途径.
编辑: N/A
| 1. | Shay JW, Werbin H. Are mitochondrial DNA mutations involved in the carcinogenic process? Mutat Res. 1987;186:149-160. [PubMed] [DOI] |
| 2. | Luciane RC, Bertrand CL. Mutagenesis, tumorigenicity and apoptosis: are the mitochondria involved? Mutat Res. 1998;398:19-26. [DOI] |
| 3. | Millar CB, Guy J, Sansom OJ, Selfridge J, MacDougall E, Hendrich B, Keightley PD, Bishop SM, Clarke AR, Bird A. Enhanced CpG mutability and tumorigenesis in MBD4-deficient mice. Science. 2002;297:403-405. [PubMed] [DOI] |
| 4. | Matsuda T, Vande Berg BJ, Bebenek K, Osheroff WP, Wilson SH, Kunkel TA. The base substitution fidelity of DNA polymerase beta-dependent single nucleotide base excision repair. J Biol Chem. 2003;278:25947-25951. [PubMed] [DOI] |
| 5. | Servant L, Bieth A, Hayakawa H, Cazaux C, Hoffmann JS. Involvement of DNA polymerase beta in DNA replication and mutagenic consequences. J Mol Biol. 2002;315:1039-1047. [PubMed] [DOI] |
| 9. | Takeuchi H, Fujimoto A, Hoon DS. Detection of mitochondrial DNA alterations in plasma of malignant melanoma patients. Ann N Y Acad Sci. 2004;1022:50-54. [PubMed] [DOI] |
| 10. | Tong BC, Ha PK, Dhir K, Xing M, Westra WH, Sidransky D, Califano JA. Mitochondrial DNA alterations in thyroid cancer. J Surg Oncol. 2003;82:170-173. [PubMed] [DOI] |
| 11. | Zhou S, Kachhap S, Singh KK. Mitochondrial impairment in p53-deficient human cancer cells. Mutagenesis. 2003;18:287-292. [PubMed] [DOI] |
| 12. | Hansel DE, Kern SE, Hruban RH. Molecular pathogenesis of pancreatic cancer. Annu Rev Genomics Hum Genet. 2003;4:237-256. [PubMed] [DOI] |
| 13. | Wong LJ, Tan DJ, Bai RK, Yeh KT, Chang J. Molecular alterations in mitochondrial DNA of hepatocellular carcinomas: is there a correlation with clinicopathological profile? J Med Genet. 2004;41:59-65. [DOI] |
| 14. | Solano A, Roig M, Vives-Bauza C, Hernandez-Peña J, Garcia-Arumi E, Playan A, Lopez-Perez MJ, Andreu AL, Montoya J. Bilateral striatal necrosis associated with a novel mutation in the mitochondrial ND6 gene. Ann Neurol. 2003;54:527-530. [PubMed] [DOI] |
| 15. | Liu CY, Lee CF, Hong CH, Wei YH. Mitochondrial DNA mutation and depletion increase the susceptibility of human cells to apoptosis. Ann N Y Acad Sci. 2004;1011:133-145. [PubMed] [DOI] |
| 16. | Abnet CC, Huppi K, Carrera A, Armistead D, McKenney K, Hu N, Tang ZZ, Taylor PR, Dawsey SM. Control region mutations and the 'common deletion' are frequent in the mitochondrial DNA of patients with esophageal squamous cell carcinoma. BMC Cancer. 2004;4:30. [PubMed] [DOI] |
| 17. | Beretta S, Mattavelli L, Sala G, Tremolizzo L, Schapira AH, Martinuzzi A, Carelli V, Ferrarese C. Leber hereditary optic neuropathy mtDNA mutations disrupt glutamate transport in cybrid cell lines. Brain. 2004;127:2183-2192. [PubMed] [DOI] |
| 18. | Fliss MS, Usadel H, Caballero OL, Wu L, Buta MR, Eleff SM, Jen J, Sidransky D. Facile detection of mitochondrial DNA mutations in tumors and bodily fluids. Science. 2000;287:2017-2019. [PubMed] [DOI] |
| 19. | Habano W, Sugai T, Nakamura SI, Uesugi N, Yoshida T, Sasou S. Microsatellite instability and mutation of mitochondrial and nuclear DNA in gastric carcinoma. Gastroenterology. 2000;118:835-841. [PubMed] [DOI] |