修回日期: 2004-10-10
接受日期: 2004-11-20
在线出版日期: 2004-12-15
目的: 观察Th1/Th2类细胞因子在胰腺癌组织中的表达模式及临床意义.
方法: 以IFN-γ和IL-2代表Th1类细胞因子, IL-4和IL-10代表Th2类细胞因子. 收集45例胰腺癌患者的手术切除组织蜡块, 以免疫组织化学PV-9000通用型二步法染色, DAB显色试剂盒显色, 检测胰腺癌组织中Th1/Th2类细胞因子的表达.
结果: IFN-γ和IL-2在胰腺癌和正常胰腺组织中的表达无明显差异(P>0.05), 说明Th1类细胞因子在胰腺癌和正常胰腺组织中的表达无明显差异; IL-4和IL-10在胰腺癌组织中的表达明显高于正常胰腺组织(P = 0.022<0.05; P = 0.023<0.05), 说明Th2类细胞因子在胰腺癌组织中的表达明显高于正常胰腺组织.
结论: 胰腺癌组织中Th2类细胞因子呈优势表达状态, 这可能是肿瘤免疫逃逸的机制.
引文著录: 张圣林, 邱法波, 吴力群, 卢云. 人胰腺癌组织中Th2类细胞因子的优势表达及其临床意义. 世界华人消化杂志 2004; 12(12): 2862-2864
Revised: October 10, 2004
Accepted: November 20, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2862-2864
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2862.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2862
自Th1和Th2的概念提出以来, 人们对其在机体免疫应答中的作用进行了大量的体内外实验研究, 但未见有胰腺癌组织中Th1/Th2偏移的研究报道. 我们以IFN-γ和IL-2代表Th1类细胞因子, IL-4和IL-10代表Th2类细胞因子, 以免疫组织化学方法检测胰腺癌组织中Th1/Th2类细胞因子的表达, 阐明Th1/Th2类细胞因子在胰腺癌中的表达特征, 这对于明确胰腺癌的发病机制及指导临床有重要意义.
收集青岛大学医学院附属医院肝胆血管外科1998-2004年间的45例胰腺癌患者病例资料及切除组织的蜡块标本, 男31例, 女14例, 年龄44-80岁, 平均年龄63.8岁. 其中胰头癌33例, 胰体尾癌10例, 钩突癌2例. 病理类型: 高分化腺癌5例, 中分化腺癌25例, 低分化腺癌15例. 对照组10例正常胰腺组织标本取自非正常死亡的健康成人尸体.
1.2.1 免疫组化染色: 胰腺癌组织蜡块预冷后4 μm连续切片, 二甲苯与梯度酒精脱蜡至水化, 30 mL/L过氧化氢10 min以消除内源性过氧化物酶. 置入0.01 mol/L枸橼酸缓冲液(pH = 6.0), 微波修复抗原. 一抗为兔抗人IFN-γ, IL-2, IL-4和IL-10(武汉博士德生物工程有限公司), IFN-γ, IL-2和IL-4以1:200稀释后使用, IL-10以1:50稀释. PV-9000通用型二步法染色, PV-9000试剂盒购自北京中杉金桥生物技术有限公司, 流程参考说明书. DAB显色试剂盒显色, 苏木素复染, 10 mL/L盐酸酒精分化, 1 mL/L氨水返蓝, 梯度酒精脱水, 干燥后中性树胶封片. 用已知阳性切片作阳性对照, 以PBS代替一抗作阴性对照.
1.2.2 结果判断: 胞质内含棕黄色颗粒为阳性, 并按表达情况和强度分为: (-)为阴性, (+)每张切片有<25%细胞表达, (++)25-50%细胞表达, (+++)>50%的细胞表达.
统计学处理 采用SPSS11.5软件进行分析, P<0.05认为有统计学意义.
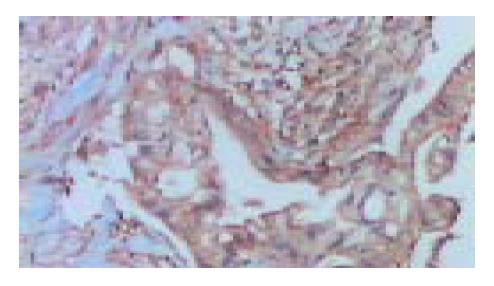
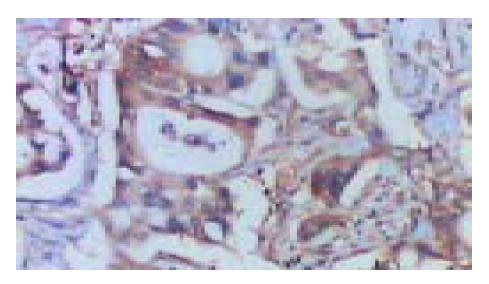
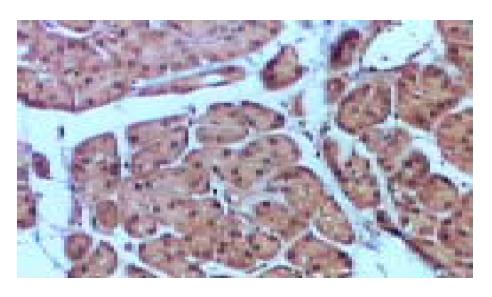
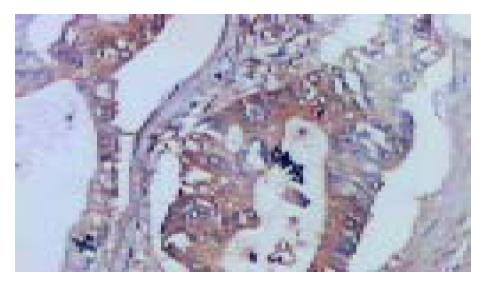
胰腺癌组织中四种细胞因子的表达情况(表1). IFN-γ在胰腺癌和正常胰腺组织中的表达无明显差异(P = 0.596>0.05, 图1); IL-2在胰腺癌和正常胰腺组织中的表达也无明显差异(P = 0.146>0.05, 图2); IL-4在胰腺癌组织中的表达明显高于正常胰腺组织(P =0.022<0.05, 图3); IL-10在胰腺癌组织中的表达也明显高于正常胰腺组织(P = 0.023<0.05, 图4).
以IFN-γ和IL-2代表Th1类细胞因子, 在胰腺癌和正常胰腺组织中的表达无明显差异; 以IL-4和IL-10代表Th2类细胞因子, 在胰腺癌组织中的表达明显高于正常胰腺组织. 这与国内外的有关报道基本相符合, 说明胰腺癌作为恶性肿瘤中的一种也是处于Th1/Th2类细胞因子偏移状态, Th2类细胞因子呈优势表达.
不同病理类型的胰腺癌组织中Th2类细胞因子的表达情况(表2). IL-4, IL-10的表达情况与胰腺癌的恶性程度呈明显的正相关(P = 0.013<0.05; P = 0.029<0.05).
| 病理类型 | IL-4 | IL-10 | ||||
| - | + | ++ | - | + | ++ | |
| 高分化 | 4 | 1 | 0 | 3 | 2 | 0 |
| 中分化 | 6 | 12 | 7 | 5 | 12 | 8 |
| 低分化 | 2 | 4 | 9 | 2 | 3 | 10 |
根据CD4+Th细胞所分泌的细胞因子不同, 将其分为Th0、Th1、Th2三种亚型. Th1类细胞分泌IFN-γ、IL-2、IL-18和IL-12等, 主要介导细胞免疫应答; Th2类细胞分泌IL-4、IL-5、IL-6和IL-10等, 主要介导体液免疫应答. 正常机体的Th1/Th2类细胞因子处于动态平衡, 当这个平衡失调并向Th1或Th2转化时, 称为Th1/Th2的偏移. Th1/Th2的偏移与许多疾病的发生、发展、治疗和转归有密切的关系. 近年来研究发现, 非小细胞肺癌、直肠癌、卵巢癌、绒癌、黑色素瘤、胃癌、骨肉瘤、淋巴瘤及鼻咽癌等多种肿瘤患者体内Th2类细胞因子占优势, 且Th1/Th2的偏移与肿瘤的恶性程度呈正相关[1]. Bellone et al[2]也发现胰腺癌组织中Th2类细胞因子的表达明显高于正常胰腺组织, 而其未对Th1类细胞因子和Th1/Th2的偏移做相关研究. 我们的结果显示, 45例胰腺癌组织中Th1类细胞因子的表达与正常胰腺组织无明显差异, Th2类细胞因子的表达明显高于正常胰腺组织, 提示Th2类细胞因子分泌量增多, 呈优势表达状态. 这不但与Bellone的结论基本符合而且还进一步阐述了胰腺癌患者的免疫状态.
机体的抗肿瘤免疫效应机制包括细胞免疫和体液免疫两个方面, 细胞免疫是主力, 在抗肿瘤免疫过程中发挥着重要作用[3]. 恶性肿瘤患者Th2优势表达可降低机体的抗肿瘤免疫能力, 致肿瘤细胞逃避细胞免疫应答, 使癌细胞在宿主体内得以长期的存活和发展[4], 另外Th2类细胞还可直接阻滞Th1类细胞介导的免疫应答[5], 并且随肿瘤分化程度的降低和病情的进展这种趋势会更加明显[6], 这可能是导致肿瘤免疫逃逸的机制.
检测胰腺癌患者的Th1/Th2类细胞因子, 既有助于疾病的诊断, 又可对疾病的发生发展进行监测, 还能以调整Th1/Th2的平衡为目的设计出相应的治疗方案[7]. 因此, 对恶性肿瘤患者, 检测机体的Th1/Th2类细胞因子水平有着重要的临床意义.
编辑: N/A
| 1. | Kharkevitch DD, Seito D, Balch GC, Maeda T, Balch CM, Itoh K. Characterization of autologous tumor-specific T-helper 2 cells in tumor-infiltrating lymphocytes from a patient with metastatic melanoma. Int J Cancer. 1994;58:317-323. [PubMed] [DOI] |
| 2. | Bellone G, Turletti A, Artusio E, Mareschi K, Carbone A, Tibaudi D, Robecchi A, Emanuelli G, Rodeck U. Tumor- associated transforming growth factor-beta and interleukin-10 contribute to a systemic Th2 immune phenotype in pancreatic carcinoma patients. Am J Pathol. 1999;155:537-547. [DOI] |
| 3. | Reome JB, Hylind JC, Dutton RW, Dobrzanski MJ. Type 1 and type 2 tumor infiltrating effector cell subpopulations in progressive breast cancer. Clin Immunol. 2004;111:69-81. [PubMed] [DOI] |
| 4. | Cua DJ, Hinton DR, Stohlman SA. Self-antigen-induced Th2 responses in experimental allergic encephalomyelitis (EAE)-resistant mice. Th2-mediated suppression of autoimmune disease. J Immunol. 1995;155:4052-4059. [PubMed] |
| 5. | Ruzek MC, Mathur A. Specific decrease of Th1-like activity in mice with plasma cell tumors. Int Immunol. 1995;7:1029-1035. [PubMed] [DOI] |
| 6. | Spachacz R, Kasprzak A, Stefańska K, Trejster E, Seidel J, Zabel M. Tissue expression of cytokines (IL-1alpha, IL-2, IL-6, IL-12, TNF-alpha) in B-cell lymphomas in children. Folia Morphol (Warsz). 2003;62:483-484. [PubMed] |