修回日期: 2004-10-13
接受日期: 2004-10-20
在线出版日期: 2004-12-15
目的: 探讨空肠弯曲菌28-31 ku外膜蛋白的免疫原性.
方法: 将BALB/c小鼠分为正常对照组和不同剂量抗原的免疫组, 正常对照组不予抗原免疫, 而免疫组采用28-31 ku蛋白(纯)或甘氨酸提取的外膜蛋白(粗), 分别加用或不加用完全弗氏佐剂(F), 采用sc, 在0, 1, 2, 3, 4 wk免疫, 于末次免疫后10 d, 用双向免疫琼脂扩散试验测定各免疫组抗血清效价, 待效价达到1:4至1:16时. 分别采集各免疫组及对照组小鼠的血清、空肠及回肠内的肠液, 用间接ELISA法检测各组标本的特异性抗体IgA, IgG.
结果: 不同剂量的抗原sc免疫BALB/c小鼠后, 免疫组血清及肠液中特异性IgA, IgG抗体水平较正常对照组及实验对照组显著升高(P<0.05).
结论: 空肠弯曲菌的28-31 ku外膜蛋白是一种良好的免疫原, 能够诱导BALB/c小鼠产生特异性抗体, 可能成为空肠弯曲菌亚单位疫苗候选的重要组分.
引文著录: 冯胜军, 孙万邦, 姚新生, 肖政. 空肠弯曲菌28-31 ku外膜蛋白的免疫原性. 世界华人消化杂志 2004; 12(12): 2813-2816
Revised: October 13, 2004
Accepted: October 20, 2004
Published online: December 15, 2004
AIM: To explore immunogenicity of 28-31 ku outer membrance protein of Campylobacter jejuni (C.jejuni ) and to pave the way for preparation of C.jejuni subunit vaccine.
METHODS: BALB/c mice were divided into normal control group, control group and immune group. Mice in immune group were subcutaneously (SC) injected 28-31 ku protein (Pur) or glycine extraction (A), adding or without adding the complete Freud's adjuvant (F). Mice in control group were treated with F and saline. Each mouse received five times of immunization at an interval of 6 days. At 10th day after the final immunization, the specific antibodies' titer in serum was measured with double immunodiffusion test. ELISA method was used to detect the specific IgG, IgA antibodies in serum and intestinal fluid.
RESULTS: After treated with different doses of antigen, the levels of specific IgG, IgA or secretory IgA (SIgA) antibodies in serum and intestinal fluid were significantly higher in immune group than those in normal control or control group (P < 0.05). No significant difference existed between normal control and control group.
CONCLUSION: Outer membrane protein of C.jejuni with molecular mass of 28-31 ku is a fine immunogen and it can induce response of specific antibodiesin BALB/c mice. It may be used as a promising component of subunit vaccine.
- Citation: Feng SJ, Sun WB, Yao XS, Xiao Z. Immunogenicity of 28-31 ku outer membrance protein in Campylobacter Jejuni. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2813-2816
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2813.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2813
空肠弯曲杆菌(campylobacter jejuni, C.jejuni)作为一种人兽共患病病原体, 系最常见的胃肠道炎症的致病菌之一[1-2], 还是Guillain-Barre综合征和Miller Fisher综合征的常见致病病原体[3-8], 其血清型繁多[9-10], 并且C.jejuni由于存在分子模拟等成分, 制备的全菌苗, 以及C.jejuni突变株菌苗[11]提供的保护性效果有限, 而不安全. 在亚单位组分的提取上, 众多血清型菌株分布, 使得C.jejuni共同抗原具有保护性的组分的鉴定及提取增加了难度, 同时也为C.jejuni疫苗的研制增加了阻力. 并且, 随着C.jejuni耐药菌株的增加[12-13], 研究安全、有效的C.jejuni亚单位疫苗具有重要的预防作用. 对于C.jejuni的亚细胞成分的研究最多的是其鞭毛蛋白[14], 但获得的保护性有限, 并且在不同来源的C.jejuni菌株间提供了不稳定的保护性. 本研究中, 我们参照Pei et al[15]的方法, 对C.jejuni 28-31 ku外膜蛋白进行免疫原性研究, 为深入探讨C.jejuni的有效的保守性亚单位组分奠定基础.
空肠弯曲杆菌(campylobacter jejuni , C.jejuni)标准株(CF-1, 购于上海市疾病预防控制中心菌种保存中心, 由中国科学院从腹泻肠炎患者中分离); BALB/c小鼠清洁级, 6-8 wk龄, 健康, 质量18-25 g, ♂, 购于重庆医科大学, 常规饲养; HRP标记羊抗小鼠IgG抗体 HRP标记羊抗小鼠IgA抗体购于Southern Biotech公司; 蛋白酶抑制剂购于Amersham公司; 小牛血清购于中德三利生物制品厂; OPD购于Sigma公司; 卡介苗购于中科院成都生物制品研究所; 改良布氏血琼脂培养基参照文献[16]配制.
C.jejuni在改良布氏血琼脂培养基中培养, 在42.5 ℃, 气体条件50 mL/L O2, 100 mL/L CO2, 850 mL/L N2条件下培养48 h. 取出, 用灭菌双蒸水洗刮下C.jejuni菌苔, 室温4 000 g, 20 min离心洗涤菌液. 重复洗涤1次, 去掉上清液, 取出CJ菌泥, 称重, 按每4 g CJ菌泥加入0.2 mol/L、pH2.2甘氨酸-盐酸缓冲液120 mL, 4 ℃搅拌30 min, 然后在4 ℃条件下12 000 g, 离心15 min. 透析, 用固体聚乙二醇6 000包埋浓缩, 该透析物为C.jejuni粗提物. 然后将该粗提物通过Sephadex G-75纯化, 获得C.jejuni的28-31 ku外膜蛋白, 80 mL/L浓缩胶、120 mL/L分离胶作SDS-PAGE分子质量鉴定. 蛋白质定量采用Bradford法蛋白定量. 抗原制备采用本室制备的福氏完全佐剂和福氏不完全佐剂, 无菌操作, 4 ℃保存, 备用.
1.2.1 动物分组免疫: 小鼠48只, 随机分组, 每组6只, 共8组(表1): 实验对照组采用福氏完全佐剂0.2 mL+生理盐水0.2 mL sc(NS+F组); 正常对照组不进行任何免疫处理. 上述动物均常规饲养. 免疫方法均采用背部皮下+腹部皮下多点注射. 加有福氏完全佐剂的疫苗按0.2 mL混合0.2 mL抗原(C.jejuni ku-31 ku外膜蛋白或C.jejuni甘氨酸提取物), 未加福氏完全佐剂用灭菌生理盐水0.2 mL代替. 每次每只小鼠共0.4 mL. 每隔6 d sc 1次, 共五次. 全程40 d(包括末次采血采用双向免疫琼脂扩散试验检测抗体效价的10 d). 免疫期间观察进食、大便、毛皮、四肢、体重、活动、死亡等情况.
| 分组 | 双向免疫琼脂扩散试验 |
| (1)50 μg(纯)+F | 1:4-1:8 |
| (2)50 μg(粗)+F | 1:4-1:16 |
| (3)100 μg(纯)+F | 1:4-1:16 |
| (4)100 μg(粗)+F | 1:4-1:16 |
| (5)100 μg(纯) | 1:4-1:8 |
| (6)100 μg(粗) | 1:4-1:16 |
| (7)200 μg(纯)+F | 1:4-1:16 |
| (8)200 μg(粗)+F | 1:4-1:16 |
1.2.2 小鼠血清中抗体效价检测: 每组取2只小鼠, 摘眼球从眼眶采血, 常规分离血清, 作双向免疫琼脂扩散试验检测血清中抗体效价. ELISA法检测血清IgG, IgA及肠液中IgG, SIgA水平: 经眼眶采血, 在采集前10 h禁食. 常规方法分离血清. 肠黏液收集, 在采集前10 h禁食. 眼眶采血处死后, 立即取空肠和回肠5 cm. 于Eppendorf管中, 加入胰蛋白酶抑制剂/PBS溶液0.5 mL, 用剪刀剪碎肠段, 并轻微搅拌约30 min. 置4 ℃冰箱保存10 h. 4 ℃离心, 13 000 g, 15 min. 收集上清液. 4 ℃保存, 备用. 用样本稀释液将血清按1:100稀释, 4 ℃保存. 用样本稀释液将肠黏液按1:10稀释, 4 ℃保存. C.jejuni甘氨酸提取物(pH 7.0, 浓度1 g/L), 100 μL/孔, 封板. 置湿盒中, 37 ℃孵育4 h. 弃去孔中液体, 50 mL/L小牛血清/PBS液4 ℃封闭24 h. 洗涤液洗涤3次, 每次3 min. 加入稀释好的样品(血清或肠黏液)100 μL/孔, 封板. 湿盒, 37 ℃孵育60 min. 洗涤液洗涤3次, 每次3 min. 加入HRP标记IgG或IgA抗体, 100 μL/孔, 封板. 置湿盒, 37 ℃孵箱中, 60 min. 加入底物液100 μL/孔, 封板. 置湿盒, 37 ℃孵育15 min. 加入终止液(2 mol/L H2SO4溶液)50 μL/孔, 终止反应. 酶标仪490 nm波长读取A值. 空白对照组为0.1 mol/L, pH7.4 PBS. 阳性结果P/N≥2.1, 即疫苗免疫组的样本测定孔的A值(P)-空白对照组值/正常对照组测定孔的A值(N)-空白对照组值≥2.1; 阴性结果P/N≤2.1. 即疫苗免疫组的样本测定孔的A值(P)-空白对照组值/正常对照组测定孔的A值(N)-空白对照组值≤2.1.
统计学处理 各组血清或黏液中的A值以mean±SD表示. 采用SPASSV10.0统计软件处理, 进行方差齐性检验后, 进行t检验、方差分析和相关性分析进行组间比较.
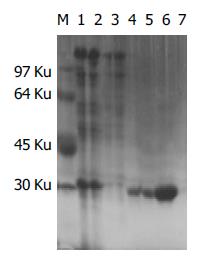
C.jejuni甘氨酸提取物进行SephadexG-75分子筛层析, 然后SDS-PAGE, 可以发现本次纯化出了分子质量为28-31 ku的外膜蛋白质, 且纯度较高(图1). 免疫期间小鼠每次注射后前16 h, 食量减少, 之后逐渐恢复至正常水平; 无稀便、干结; 毛发倒立、紊乱; 在第2次注射1 d后, 加有完全福氏佐剂组均有四肢关节肿胀、发红现象出现, 并伴眼睑红肿、结膜充血, 分泌物增加, 活动受限; 体质量明显减轻, 分别减少1-5 g左右; 活动迟缓; 无死亡.
BALB/c小鼠经过sc C.jejuni外膜蛋白28-31 ku免疫5次后10 d, 各免疫组特异性抗体IgG, IgA水平均较实验对照组或正常对照组显著升高(P<0.05), 而实验对照组与正常对照组间抗体水平无差异(P>0.05, 表2).
| 分组 | n | Serum | Intestinal fluid | ||
| IgG | IgA | IgG | sIgA | ||
| (1)50 μg(纯)+F | 6 | 1.71±0.04a | 0.15±0.01a | 1.50±0.12a | 0.71±0.07a |
| (2)50 μg(粗)+F | 6 | 1.78±0.03a | 0.19±0.01a | 1.56±0.04a | 0.50±0.08a |
| (3)100 μg(纯)+F | 6 | 1.71±0.08a | 0.17±0.01a | 1.47±0.08a | 0.70±0.15a |
| (4)100 μg(粗)+F | 6 | 1.82±0.28a | 0.26±0.07a | 1.52±0.16a | 0.76±0.08a |
| (5)200 μg(纯)+F | 6 | 1.76±0.02a | 0.26±0.03a | 1.49±0.12a | 0.57±0.06a |
| (6)200 μg(粗)+F | 6 | 1.75±0.21a | 0.53±0.07a | 1.48±0.09a | 0.74±0.08a |
| (7)100 μg(纯) | 6 | 1.52±0.05a | 0.21±0.02a | 1.59±0.17a | 0.49±0.05a |
| (8)100 μg(粗) | 6 | 1.64±0.34a | 0.18±0.01a | 1.53±0.12a | 0.52±0.13a |
| (9)NS+F | 6 | 0.21±0.16b | 0.121±0.07c | 0.23±0.14c | 0.22±0.16c |
| (10)正常对照 | 6 | 0.20±0.17 | 0.11±0.05 | 0.22±0.17 | 0.21±0.20 |
| 空白对照 | 6 | 0.12±0.02 | 0.10±0.04 | 0.15±0.015 | 0.20±0.12 |
26-30 ku蛋白介导C.jejuni体外黏附Hela细胞, 其中27 ku蛋白是C.jejuni的特异性成分, 目前研究表明27 ku就是28 ku. Peit et al[15]认为C.jejuni的甘氨酸提取物中蛋白质PEB1(28 ku)和PEB3(30 ku)分子, 具有保守性, 无血清型改变, 能够作为检测不同血清学来源的C.jejuni. 共同的PEB1组分具有高度的免疫原性并有黏附真核细胞的能力. 而29 ku及31 ku多肽亦是甘氨酸提取物中的主要抗原成分, 并有研究表明该蛋白存在于整个C.jejuni菌体表面, 亦是C.jejuni共同抗原, 可作为C.jejuni的候选[17]. 为了鉴定纯化的C.jejuni 28-31 ku外膜蛋白质(图1)或甘氨酸提取物(其中含有28-31 ku蛋白质)的免疫原性, 我们采用注射免疫小鼠的方法收集资料. 由于该类蛋白质分子量较小, 为了增强免疫原性, 采用福氏完全佐剂作为该类蛋白质的佐剂. 对BALB/c小鼠通过sc间隔6 d接种5次. 检测免疫组的血清中特异性抗体的效价, 采用双向琼脂扩散试验表明该抗体效价在1:4-1:16之间(表2). 并且, 在28-31 ku纯化物中, 出现了单一的白色沉定线(即28-31 ku与其抗体的复合物). 用间接ELISA检测血清或肠道中特异性IgG或IgA抗体水平, 以A值表示, 抗体效价采用P/N≥2.1为阳性, P/N<2.1为阴性进行结果分析, 发现免疫组的抗体分泌水平较对照组有显著升高(P<0.05). 由此表明C.jejuni的28-31 ku抗原或C.jejuni甘氨酸提取物均能够诱导血清或肠道中有效的特异性抗体IgG, IgA, SIgA产生. 采用福氏完全佐剂, 其缺点是sc操作不便, 在多点注射时, 由于卡介苗导致的局部皮肤的炎症反应, 容易形成皮下囊腔, 影响抗原的完全吸收, 小鼠注射局部的皮下出现囊腔可以证实. 我们在第2次免疫后, 观察到小鼠的关节肿胀、发红的炎症反应, 与报道的该类佐剂能够诱导佐剂性关节炎一致, 常用于复制佐剂性关节炎动物模型. 因此口服或皮下注射用佐剂上调抗原的免疫原性时, 可采用其他的佐剂取代, 如CT、LT、脂质体等佐剂的单用或联合应用, 该项工作本课题组正在开展中. 由于C.jejuni是通过粪-口途径感染, 因此作为抗胞外菌的C.jejuni而言, 黏膜免疫的研究具有了重要地位, 可以深入研究微粒体疫苗通过口服方式获得免疫力, 而以脂质体等为代表的免疫佐剂的联合应用具有了广阔的前景, 采用脂质体制备抗原包裹的微粒, 可克服口服时胃酸等肠液对抗原的破坏, 刺激小鼠产生Th1型免疫应答, 这正是我们的下一步工作的重点. 在本实验中, 采用福氏完全佐剂的免疫调节作用, 证实了C.jejuni的28-31 ku分子是一种良好的免疫原, 能够诱导BALB/c小鼠产生特异性抗体. 该类蛋白质的研究能够为C.jejuni亚单位疫苗的研制打下初步基础.
编辑: N/A
| 1. | Isenbarger DW, Hien BT, Ha HT, Ha TT, Bodhidatta L, Pang LW, Cam PD. Prospective study of the incidence of diarrhoea and prevalence of bacterial pathogens in a cohort of Vietnamese children along the Red River. Epidemiol Infect. 2001;127:229-236. [PubMed] [DOI] |
| 2. | Baqar S, Rice B, Lee L, Bourgeois AL, El Din AN, Tribble DR, Heresi GP, Mourad AS, Murphy JR. Campylobacter jejuni enteritis. Clin Infect Dis. 2001;33:901-905. [PubMed] [DOI] |
| 3. | Yuki N. Pathogenesis of Guillain-Barré and Miller Fisher syndromes subsequent to Campylobacter jejuni enteritis. Jpn J Infect Dis. 1999;52:99-105. [PubMed] |
| 4. | Godschalk PC, Heikema AP, Gilbert M, Komagamine T, Ang CW, Glerum J, Brochu D, Li J, Yuki N, Jacobs BC. The crucial role of Campylobacter jejuni genes in anti-ganglioside antibody induction in Guillain-Barre syndrome. J Clin Invest. 2004;114:1659-1665. [PubMed] [DOI] |
| 5. | Nishimoto Y, Yuki N. Intravenous immunoglobulin therapy for Guillain-Barré syndrome in Japan: changes in treatment after its inclusion in health insurance coverage. Rinsho Shinkeigaku. 2004;44:633-635. [PubMed] |
| 6. | Kuwabara S, Ogawara K, Misawa S, Koga M, Mori M, Hiraga A, Kanesaka T, Hattori T, Yuki N. Does Campylobacter jejuni infection elicit "demyelinating" Guillain-Barre syndrome? Neurology. 2004;63:529-533. [PubMed] [DOI] |
| 7. | Yuki N, Susuki K, Koga M, Nishimoto Y, Odaka M, Hirata K, Taguchi K, Miyatake T, Furukawa K, Kobata T. Carbohydrate mimicry between human ganglioside GM1 and Campylobacter jejuni lipooligosaccharide causes Guillain-Barre syndrome. Proc Natl Acad Sci USA. 2004;101:11404-11409. [PubMed] [DOI] |
| 8. | Odaka M, Yuki N, Tatsumoto M, Tateno M, Hirata K. Ataxic Guillain-Barré syndrome associated with anti-GM1b and anti-GalNAc-GD1a antibodies. J Neurol. 2004;251:24-29. [PubMed] [DOI] |
| 9. | Sopwith W, Ashton M, Frost JA, Tocque K, O'Brien S, Regan M, Syed Q. Enhanced surveillance of campylobacter infection in the north west of England 1997-1999. J Infect. 2003;46:35-45. [DOI] |
| 10. | Hopkins KL, Desai M, Frost JA, Stanley J, Logan JM. Fluorescent amplified fragment length polymorphism genotyping of Campylobacter jejuni and Campylobacter coli strains and its relationship with host specificity, serotyping, and phage typing. J Clin Microbiol. 2004;42:229-235. [PubMed] [DOI] |
| 11. | Ziprin RL, Hume ME, Young CR, Harvey RB. Inoculation of chicks with viable non-colonizing strains of Campylobacter jejuni: evaluation of protection against a colonizing strain. Curr Microbiol. 2002;44:221-223. [PubMed] [DOI] |
| 12. | Nachamkin I, Ung H, Li M. Increasing fluoroquinolone resistance in Campylobacter jejuni, Pennsylvania, USA,1982-2001. Emerg Infect Dis. 2002;8:1501-1503. [PubMed] [DOI] |
| 13. | Rautelin H, Vierikko A, Hanninen ML, Vaara M. Antimicrobial susceptibilities of campylobacter strains isolated from finnish subjects infected domestically or from those infected abroad. Antimicrob Agents Chemother. 2003;47:102-105. [DOI] |
| 14. | Lee LH, Burg E 3rd, Baqar S, Bourgeois AL, Burr DH, Ewing CP, Trust TJ, Guerry P. Evaluation of a truncated recombinant flagellin subunit vaccine against Campylobacter jejuni. Infect Immun. 1999;67:5799-5805. [PubMed] |
| 15. | Pei ZH, Ellison RT 3rd, Blaser MJ. Identification, purification, and characterization of major antigenic proteins of Campylobacter jejuni. J Biol Chem. 1991;266:16363-16369. [PubMed] |
| 16. | 李 影林. 中华医学检验全书(上卷). 北京: 人民出版社 1996; 1023-1173. |
| 17. | Kervella M, Pagès JM, Pei Z, Grollier G, Blaser MJ, Fauchère JL. Isolation and characterization of two Campylobacter glycine-extracted proteins that bind to HeLa cell membranes. Infect Immun. 1993;61:3440-3448. [PubMed] |