修回日期: 2004-09-13
接受日期: 2004-09-30
在线出版日期: 2004-12-15
目的: 研究HBsAg基因启动子I DNA结合蛋白1(SBP1)与白介素-18(IL-18)基因表达的关系, 研究SBP1在HBV致病的分子生物学机制中的作用.
方法: 构建质粒pcDNA3.1(-)-SBP1, pCAT3-IL-18, 转染HepG2细胞进行表达, 应用酶联免疫黏附法(ELISA)检测细胞中氯霉素乙酰转移酶(CAT)的表达活性.
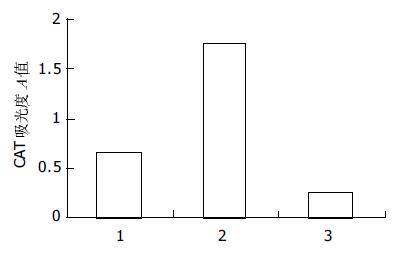
结果: 构建的表达载体pcDNA3.1(-)-SBP1经过序列分析和酶切鉴定正确. 真核表达载体pcDNA3.1(-)-SBP1和pCAT3-IL-18P共转染的HepG2细胞的pCAT表达活性是pCAT3空载体的0.37倍, 是转染pCAT3-IL-18P的0.17倍, 抑制率达到86.32%.
结论: SBP1可以下调IL-18启动子的活性, 抑制IL-18基因的表达.
引文著录: 杨瑗, 洪源, 成军, 赵英仁, 黄燕萍, 王建军. HBsAg基因启动子ⅠDNA结合蛋白1下调IL-18基因启动子. 世界华人消化杂志 2004; 12(12): 2797-2800
Revised: September 13, 2004
Accepted: September 30, 2004
Published online: December 15, 2004
AIM: To investigate the relationship between HBsAg promoterⅠDNA binding protein 1 (SBP1) and IL-18 promoter gene expression.
METHODS: Recombinant plasmid, named pcDNA3.1(-)-SBP1, were constructed by inserting a gene fragment of hepatitis B virus surface antigen promoterⅠDNA binding protein1 (SBP1) into pcDNA3.1(-). Then it was transfected into HepG2 cells transfected with pCAT3-IL-18P by FuGENE 6 transfection reagents. The activity of chloramphenicol acetyltransferase (CAT) in HepG2 cells was detected by enzyme-linked immunoassay (ELISA) after 48 h.
RESULTS: pcDNA3.1(-)-SBP1 was confirmed by restriction enzyme digestion and sequencing. The expression of CAT in HepG2 cells co-transfected with pCAT3-IL-18P and pcDNA3.1(-)-SBP1 was 0.37 times of that transfected with pCAT3-basic, and 0.17 times of that transfected with pCAT3-IL-18P. The inhibitory rate was about 86.32%.
CONCLUSION: SBP1 can down-regulate the expression of IL-18P promoter, which provides new evidence to explain the molecular biological mechanisms of SBP1 in the interactions between IL-18P and hepatocytes.
- Citation: Yang Y, Hong Y, Cheng J, Zhao YR, Huang YP, Wang JJ. Down-regulatory effects of HBsAg promoter ⅠDNA binding protein 1 on IL-18 gene expression. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2797-2800
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2797.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2797
应用酵母单杂交体系[1-3], 以SPⅠ核心序列为"诱饵", 对人肝细胞cDNA文库进行了筛选, 得到了一个未知基因, 命名为HBsAg基因启动子Ⅰ结合蛋白1(SBP1), 可下调SPⅠ的转录活性, 表达谱基因芯片技术研究SBP1可上调白介素-18(IL-18). 目前认为IL-18的抗病毒机制重要通过分泌INF-γ从而调节免疫发挥抗病毒的作用[4], 为了进一步研究SBP1与IL-18的作用的具体机制, 我们将SBP1和真核表达载体pcDNA3.1(-)连接, 构建了表达质粒; 与IL-18启动子的CAT报告载体-pCAT3-IL-18p共转染, 旨在研究SBP1对IL-18是否具有相互作用, 使下游CAT基因的表达发生变化.
人肝癌细胞系HepG2细胞及大肠杆菌DH5α菌株为本室保存, pCAT3-IL-18P为本室构建; Tag DNA聚合酶、T4 DNA连接酶及限制性内切酶均购自Takara公司; 质粒DNA提取试剂盒, 中间载体pGEM-T及报告质粒pCAT3-basic均购自Promega公司; CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司. 其他生化试剂购自Sigma公司. 由Blastn程序进行同源比对, 发现有3段cDNA片断与之同源, 分别为: BC033214, BI117624, BG981402, 进行同源拼接后, 发现该新基因开放读框(ORF)全长为279 bp, 编码蛋白全长92 aa, 位于第6号染色体, 无内含子序列. 根据确定的基因序列的翻译起始位点到下游的470 nt, 设计上游引物5'-CTC GAG ACC ATG CCA ACA GGC CTG GTC AG-3', 下游引物5'-GAA TTC TCT CCC CTG CAT GGC AAG TC-3'其上下游引物两端分别加入XhoⅠ和Eco RⅠ限制性内切酶识别序列, 以HepG2细胞mRNA逆转录后的cDNA为模板, 经聚合酶链反应(PCR)扩增得到了SBP1的DNA全序列, PCR产物经10 g/L琼脂糖凝胶电泳, 切胶, 回收纯化.
以T-A克隆法, 用T4 DNA连接酶将SBP1基因片段连入载体pGEM-T Easy. 将获得的质粒pGEM-T-SBP1和表达载体pcDNA3.1(-)分别用XhoⅠ和EcoRⅠ双酶切后用T4 DNA连接酶进行定向连接, 产物转化DH5α宿主菌, 筛选抗氨苄青霉素阳性菌落; 提取质粒, 再次双酶切及PCR鉴定正向插入用XhoⅠ和EcoRⅠ双酶切的pcDNA3.1(-), 命名为pcDNA3.1(-)-SBP1. DNA测序由上海博亚公司完成. HepG2细胞系在含100 mL/L胎牛血清的DMEM培养液中生长. 细胞生长至50-80%时采用脂质体转染法, 具体转染方法参照FuGENE6说明书进行, 设置pCAT3-basic为阴性对照组, (每组2孔), 质粒pCAT3-IL-18p转染48 h后收获细胞. HepG2细胞生长至50-80%时将pcDNA3.1(-)-SBP1+pCAT3-IL-18P加入细胞培养液中, 同时以转染pCAT3-Basic的HepG2细胞作阴性对照. 转染48 h后, 收集细胞裂解液, 用于CAT活性检测. 所有实验严格平行操作. CAT含量检测按照试剂盒说明书进行. 取1.0 ug/L的CAT标准品(试剂盒提供)及细胞裂解液200 μL加入已包被抗体的96孔板中, 37 ℃温育2 h, 再依次加入第1抗体(地高辛标记的抗-CAT)、第2抗体(偶联有过氧化物酶的地高辛抗体抗-DIG-POD)200 μL 37 ℃温育1 h后, 加入过氧化物酶的底物室温显色10-30 min. 用酶标仪检测标本在415 nm波长的吸光度, 其数值反映细胞提取物中的CAT表达水平. 以未作转染的细胞裂解液平行实验作空白对照.
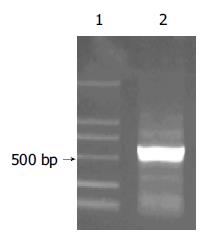
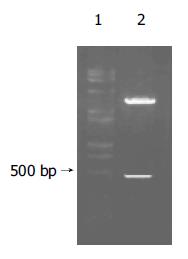
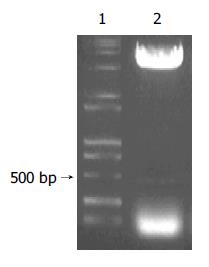
SBP1的PCR扩增产物以HepG2 cDNA为模板, 通过PCR扩增出全长为470 bp的SBP1序列(图1). 构建的中间载体pGEM-T-SBP1以XhoⅠ和EcoRⅠ双酶切电泳图谱为两条带470 bp(SBP1基因片段)和约3 000 bp(pGEM-T空载体, 图2). 重组质粒pcDNA3.1(-)-SBP1分别以XhoⅠ和EcoRⅠ双酶切及DNA序列测定均显示结果正确, pcDNA3.1(-)-SBP1鉴定电泳图(图3)表明, 该真核表达载体已构建成功. 重组质粒pcDNA3.1(-)-SBP1与pCAT3-IL-18P共转染实验空载体对照组pCAT3 basic的CAT的A值为0.653, pCAT3-IL-18P的CAT的A值为1.755, 共转染pCAT3-IL-18P/pcDNA3.1(-)-SBP1的HepG2细胞CAT的A值为0.240, 共转染pCAT3-IL-18P/pcDNA3.1(-)-SBP1的CAT的表达明显减弱, 抑制率为86.3%, 说明SBP1对IL-18基因启动子有反式调节作用, 使其下游CAT基因的表达下降(图4).
HBV SPⅠ是HBV的一个重要转录元件, 调节HBV表面抗原大蛋白的表达. 现已证实SPⅠ可与肝特异性核因子1(HNF1)、HNF3、HNF4特异结合, 这与HBV的嗜肝性有一定的关系[5-8], 另外还有大量的非组织特异性的转录因子的存在, 如转录因子Sp1, 八聚体转录因子(Oct-1)等也同样在HBV转录过程中发挥着重要的作用[9-12]. Raney et al提出在HNF1结合位点下游的5-10 bp可能还有其他肝特异性蛋白的结合位点. 为了寻找新的肝特异结合蛋白, 我们以SP I核心序列为"诱饵", 整合入酵母基因组, 构建了酵母报告株; 经加入人肝cDNA文库进行筛选, 得到了12个双阳性克隆, 为了对这一结果进行验证并深入研究HBV的转录调控机制, 我们选取了其中的一个未知功能基因为研究对象, 经用计算机分析、拼接后, 得到了他的编码序列, 命名为SBP1. 我们已应用CAT-ELISA和基因芯片技术对SBP1的功能进行了初步研究, 现已证实SBP1可下调SPⅠ, SBP1基因芯片的研究结果显示可增强IL-18的表达. IL-18作为一种干扰素α(IFNα)的诱导因子, 可在白介素-12(IL-12)存在的情况下作用于Th1细胞, 去极化的T细胞, NK细胞, B细胞, 树突细胞产生IFNα[13-16], IL-2和粒细胞巨噬细胞集落刺激因子(GM-CSF), 从而发挥重要作用[17-20]. IL-18是一新的上调Fas配体(FasL)表达的细胞因子.
在慢性乙肝患者中IL-18的转录和表达水平与血清ALT水平呈明显相关性[21]. IL-18在体内通过激活Fas通路发挥促肝细胞凋亡的作用[22]. 在患者感染了HBV后, 病毒本身与IL-18之间存在着复杂的相互作用, HBcAg调节 IL-18基因的转录, 通过诱导半胱天冬酶-1来介导IL-18的分泌[23]. HBxAg是一种主要的病毒转录因子, 通过从转录水平调节IL-18从而参与肝脏的炎症调控[24], 我们已证实HBx可上调IL-18启动子的活性. 在HBV DNA疫苗的研究中发现, IL-18可增强免疫鼠中特异的细胞毒T细胞(CTL)活性和TH1应答, 提示IL-18和HBV DNA疫苗的共免疫在慢性HBV感染的治疗中起着关键的作用, 对于HBV预防性和治疗性疫苗提供了一种免疫策略, IL-18是一种很有前景的免疫佐剂[25]. HBV转基因鼠的肝脏中IL-18通过依赖IFNγ和干扰素α/β(IFNα/β)的模式来发挥抑制HBV的非细胞病变的复制, 并且这种抗病毒的效果是与IL-12协同作用的结果. IL-18的抗病毒效果是通过诱导自然杀伤(NK)和自然杀伤T(NKT)细胞产生IFNγ, 另外, IL-18在IFNα/β缺乏的鼠中不能抑制HBV的复制, 提示IFNα/β也有助于抗病毒效果的发挥. 这些结果提示IL-18通过在感染期间的自身限制达到控制HBV复制的效果, 并且对慢性肝炎患者有治疗的价值[26].
基因芯片的研究发现SBP1可增强IL-18, 为了验证SBP1和IL-18的结合以及SBP1对IL-18的调节作用, 以pCAT3-IL-18p为报告载体, 在人肝癌细胞系中对二者的相互作用进行了共转染验证. 结果证实, SBP1的表达可下调IL-18的启动子活性, 表现为加入SBP1后使IL-18p下游的CAT表达活性降低. 这一结果证实了SBP1可与IL-18p结合, 且对IL-18的启动子活性有下调作用, 这点与基因芯片的结果不一致. 因此, 我们还需做大量的工作进一步研究SBP1的功能.
编辑: N/A
| 2. | Deplancke B, Dupuy D, Vidal M, Walhout AJ. A gateway-compatible yeast one-hybrid system. Genome Res. 2004;14:2093-2101. [PubMed] [DOI] |
| 4. | Sun Y, Chen HY, Xin SJ. Effect of IL-18 on peripheral blood mononuclear cells of chronic hepatitis B and hepatitis B virus DNA released by HepG2.2.15 cell lines. Hepatobiliary Pancreat Dis Int. 2004;3:230-234. [PubMed] |
| 5. | Jung D, Kullak-Ublick GA. Hepatocyte nuclear factor 1 alpha: a key mediator of the effect of bile acids on gene expression. Hepatology. 2003;37:622-631. [PubMed] [DOI] |
| 6. | Locker J, Ghosh D, Luc PV, Zheng J. Definition and prediction of the full range of transcription factor binding sites--the hepatocyte nuclear factor 1 dimeric site. Nucleic Acids Res. 2002;30:3809-3817. [PubMed] [DOI] |
| 7. | Tang H, McLachlan A. Mechanisms of inhibition of nuclear hormone receptor-dependent hepatitis B virus replication by hepatocyte nuclear factor 3beta. J Virol. 2002;76:8572-8581. [PubMed] [DOI] |
| 8. | Tang H, McLachlan A. Avian and Mammalian hepadnaviruses have distinct transcription factor requirements for viral replication. J Virol. 2002;76:7468-7472. [PubMed] [DOI] |
| 9. | Kwun HJ, Jang KL. Natural variants of hepatitis B virus X protein have differential effects on the expression of cyclin-dependent kinase inhibitor p21 gene. Nucleic Acids Res. 2004;32:2202-2213. [PubMed] [DOI] |
| 10. | Yan P, Mao X, Wang L, Zha X, Lu C. HBV C promoter Sp1 binding sequence functionally substitutes for the yeast ARS1 ABF1 binding site. DNA Cell Biol. 2002;21:737-742. [PubMed] [DOI] |
| 11. | Han HJ, Jung EY, Lee WJ, Jang KL. Cooperative repression of cyclin-dependent kinase inhibitor p21 gene expression by hepatitis B virus X protein and hepatitis C virus core protein. FEBS Lett. 2002;518:169-172. [PubMed] [DOI] |
| 12. | Sytina EV, Pankratova EV. [Oct-1 transcription factor--plasticity and polyfunctionality]. Mol Biol (Mosk). 2003;37:755-767. [PubMed] [DOI] |
| 13. | Nakanishi K, Yoshimoto T, Tsutsui H, Okamura H. Interleukin-18 regulates both Th1 and Th2 responses. Annu Rev Immunol. 2001;19:423-474. [PubMed] [DOI] |
| 14. | Papadakis KA, Prehn JL, Landers C, Han Q, Luo X, Cha SC, Wei P, Targan SR. TL1A synergizes with IL-12 and IL-18 to enhance IFN-gamma production in human T cells and NK cells. J Immunol. 2004;172:7002-7007. [PubMed] [DOI] |
| 15. | Mavropoulos A, Sully G, Cope AP, Clark AR. Stabilization of IFN-gamma mRNA by MAPK p38 in IL-12- and IL-18-stimulated human NK cells. Blood. 2005;105:282-288. [PubMed] |
| 16. | Tsutsui H, Adachi K, Seki E, Nakanishi K. Cytokine-induced inflammatory liver injuries. Curr Mol Med. 2003;3:545-559. [PubMed] [DOI] |
| 17. | Sun Y, Chen HY, Xin SJ. Effect of IL-18 on peripheral blood mononuclear cells of chronic hepatitis B and hepatitis B virus DNA released by HepG2.2.15 cell lines. Hepatobiliary Pancreat Dis Int. 2004;3:230-234. [PubMed] |
| 18. | Malmgaard L. Induction and regulation of IFNs during viral infections. J Interferon Cytokine Res. 2004;24:439-454. [PubMed] [DOI] |
| 19. | Biet F, Locht C, Kremer L. Immunoregulatory functions of interleukin 18 and its role in defense against bacterial pathogens. J Mol Med (Berl). 2002;80:147-162. [PubMed] [DOI] |
| 20. | Dinarello CA, Fantuzzi G. Interleukin-18 and host defense against infection. J Infect Dis. 2003;187 Suppl 2:S370-S384. [PubMed] [DOI] |
| 21. | Stuyt RJ, Netea MG, van Krieken JH, van der Meer JW, Kullberg BJ. Recombinant interleukin-18 protects against disseminated Candida albicans infection in mice. J Infect Dis. 2004;189:1524-1527. [PubMed] [DOI] |
| 22. | Finotto S, Siebler J, Hausding M, Schipp M, Wirtz S, Klein S, Protschka M, Doganci A, Lehr HA, Trautwein C. Severe hepatic injury in interleukin 18 (IL-18) transgenic mice: a key role for IL-18 in regulating hepatocyte apoptosis in vivo. Gut. 2004;53:392-400. [PubMed] [DOI] |
| 23. | Manigold T, Böcker U, Chen J, Gundt J, Traber P, Singer MV, Rossol S. Hepatitis B core antigen is a potent inductor of interleukin-18 in peripheral blood mononuclear cells of healthy controls and patients with hepatitis B infection. J Med Virol. 2003;71:31-40. [PubMed] [DOI] |
| 24. | Lee MO, Choi YH, Shin EC, Kang HJ, Kim YM, Jeong SY, Seong JK, Yu DY, Cho H, Park JH. Hepatitis B virus X protein induced expression of interleukin 18 (IL-18): a potential mechanism for liver injury caused by hepatitis B virus (HBV) infection. J Hepatol. 2002;37:380-386. [PubMed] [DOI] |
| 25. | Chen JZ, Zhu HH, Liu KZ, Chen Z. Enhancing cellular immune response to HBV M DNA vaccine in mice by codelivery of interleukin-18 recombinant. J Zhejiang Univ Sci. 2004;5:467-471. [PubMed] [DOI] |