修回日期: 2004-12-07
接受日期: 2004-12-10
在线出版日期: 2004-12-15
血清蛋白组学模式诊断技术是一种新型的蛋白组学平台, 在此平台上通过高维质谱所获得的蛋白指纹图谱可用做疾病的诊断标准. 此技术在早期肿瘤的检测中具有巨大应用前景. 目前发现通过SELDI蛋白指纹技术所获得的生物标记物, 大多数是在特异性肿瘤微环境中所产生的低分子质量蛋白碎片. 通过多种肿瘤的检测表明, 其敏感性和特异性均优于传统的肿瘤标记物, 对某些肿瘤的敏感性已达100%, 特异性也超过95%, 因而在肿瘤早期诊断和早期预警中具有重要临床应用价值.
引文著录: 张建中, 郑燕华, 冯凯, 邹德威. SELDI蛋白指纹技术在肿瘤早期诊断中的应用. 世界华人消化杂志 2004; 12(12): 2773-2777
Revised: December 7, 2004
Accepted: December 10, 2004
Published online: December 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(12): 2773-2777
- URL: https://www.wjgnet.com/1009-3079/full/v12/i12/2773.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i12.2773
肿瘤早期诊断急需有意义的生物标记物, 但目前能用于临床的此类标记物的敏感性和特异性均达不到早期诊断的要求. 血清蛋白组中低分子质量(<15 ku)蛋白可能包含有大量生物标记物. 在疾病过程中一系列酶解或蛋白水解切割产生了大量蛋白片段, 其中大部分通过肾脏排除, 因此血液中所携带的血清标记物丰度很低, 常规蛋白检测技术很难发现[1-2]. SELDI蛋白指纹技术的出现为癌症早期生物标记物的检测提供了重要工具, 目前已用于多种肿瘤的早期检测和早期诊断研究[3-11], 其敏感性和特异性均在80%以上, 其中对卵巢癌的敏感性达100%(已获美国FDA批准用于临床)[12], 远远超过目前任何一种血清学诊断方法, 可能具有广阔的临床应用前景.
SELDI蛋白指纹技术, 是表面增强激光解吸电离飞行时间质谱分析(surface-enhanced laser desorption/ionization time of flight mass spectrometry, SELDI-TOF-MS)的俗称. 所谓"蛋白指纹技术(protein fingerprinting)"是一种形象比喻, 指的是就像每个人的指纹不同于他人一样, 每种疾病发生发展过程中所形成的特定蛋白质组或其降解产物也不一样, 因此构成了该疾病特征性"蛋白指纹"模式(pattern). 通过这种模式识别, 可达到疾病诊断的目的.
识别和鉴定人类蛋白质组的技术有很多[13], 例如传统的酶联免疫吸附实验(ELISA)、双向电泳技术(2D-PAGE)、激光捕获微切割技术(LCM)、Western blotting和荧光差异凝胶电泳(differential cell electrophoresis, DIGE)等, 这些技术在蛋白质检测中起到了不同作用, 为基础研究和临床诊断提供了各种有用的指标. 但是此类技术均具有某些缺点和不足, 例如需要大量标本和复杂的蛋白纯化过程. 另外, 有些检测还需要进行染色(如DIGE), 有的不能将低丰度小分子质量的蛋白区分开(如2D-PAGE, Western blotting), 从而大大限制了其临床应用范围. SELDI飞行时间质谱仪的问世为临床蛋白组学开展提供了强有力的工具, 可以克服上述技术所固有的缺陷.
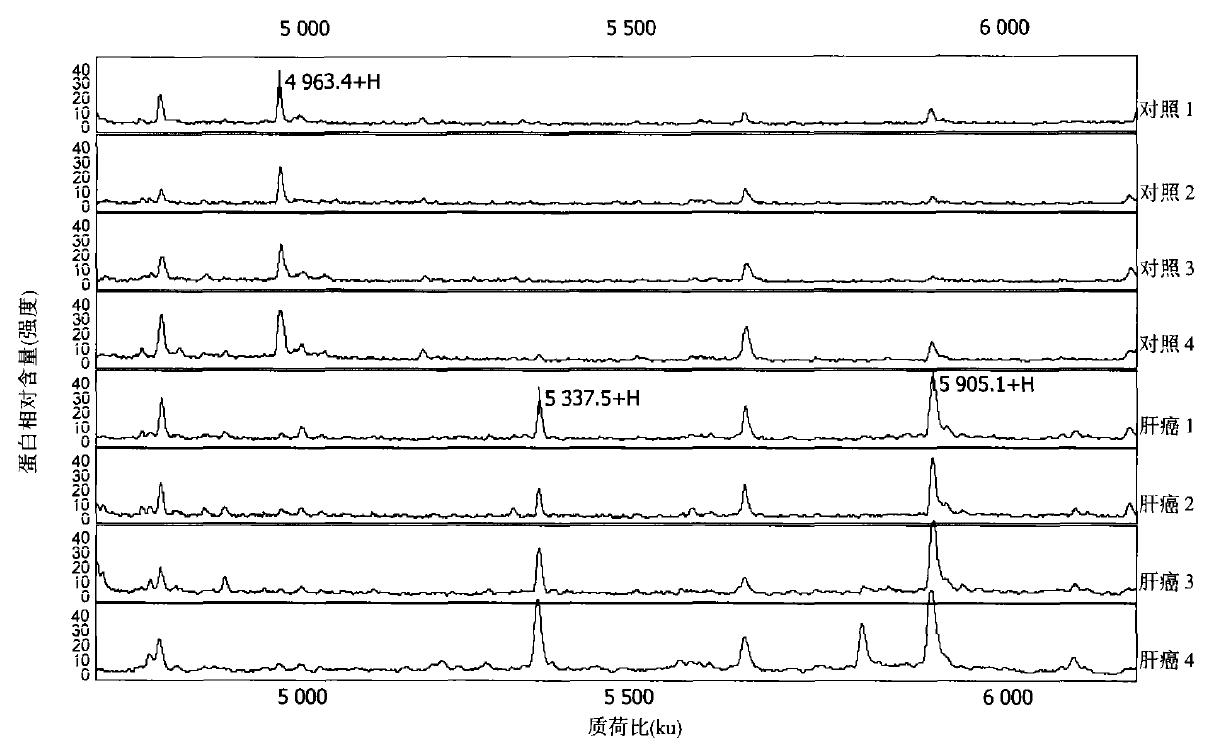
飞行时间质谱仪由蛋白芯片和质谱阅读器及其分析软件组成. 早期的飞行时间质谱为基质辅助激光解吸电离飞行时间质谱(MALDI技术), 基质先被分析的蛋白质离子化, 然后再进行质谱分析. SELDI技术把基质改为以色谱原理设计的蛋白芯片, 增强了分离能力. 我们知道, 蛋白质与DNA不同, 前者是三维结构, 制作蛋白芯片最困难的是在不损害其功能和不增加背景的条件下, 在芯片表面通过固定某些蛋白起分离作用. 传统技术很难解决这一问题, 在飞行质谱的检测系统中, 芯片表面经化学(阳离子、阴离子、疏水、亲水和重离子鳌合等)或生物化学(抗体、受体、核酸等)处理, 特异性地与被测标本中蛋白结合, 再通过选择性清洗, 获得高分辨率的保留蛋白谱(第一次分离). 当加入能量吸收分子后, 芯片上保留的蛋白形成晶体. 在特异的激光照射下, 晶体发生解离作用, 带电分子在通过电场时加速, 检测仪记录飞行时间的长短. 质量越轻, 相对所带电荷越多, 质荷比(M/Z)越小, 飞行时间越短, 就会被最先地检测到. 信号由高速的模拟数字转化器转换并记录下来, 被测定蛋白质以一系列峰值的形式呈现. 这些特异性波峰即构成了该疾病特有的指纹图谱. SELDI蛋白指纹图谱中横轴表示蛋白类型, 而纵轴蛋白质的强度和丰度. 单个蛋白在图谱上的位置取决于飞行时间(图1).
因此, SELDI蛋白指纹技术在吸收传统质谱技术的基础上, 克服了常规蛋白检测技术的一些缺点, 增加了特异性蛋白芯片阅读系统和生物信息学分析软件, 能快速处理、分析大量信息, 至少具有以下特点: (1)待测样本来源广, 不需要特殊处理, 可以直接点样检测, 如血清、尿、组织液等; (2)检测样本用量小且范围广(0.5-400 μL)、敏感性高(<1 fmole); (3)小型实验或高通量检测可自由选择, 一次可测8、16、96或192个样品, 可满足临床检测、普查或大样本筛查之需要; (4)可检测蛋白质分子质量范围大(0-500 ku); (5)应用范围广, 如肿瘤的早期诊断、疗效监测、复发早期预警及患者预后评估, 发病机制的探讨, 药物毒理学研究和毒物检测、蛋白质纯化及功能鉴定, 抗原、抗体、受体、配体、底物等检测, DNA、RNA及蛋白质调控研究, 蛋白质甲基化、磷酸化、糖基化研究等; (6)检测快速, 可重复性较好; (7)检测敏感性和特异性较高, 对常见肿瘤的诊断达80-90%以上, 目前其他方法无法比拟. 因此, SELDI蛋白指纹技术在肿瘤等疾病的早期诊断等研究中具有广阔的应用前景.
Adam et al[11]应用SELDI蛋白指纹技术发现前列腺癌患者早在可检测到PSA出现升高的5年前, 血清中就已检测到前列腺癌特异性蛋白指纹图谱. 自此以来, 人们对该技术在癌症早期诊断和早期预警的应用价值产生了极大的兴趣, 吸引了众多研究者的关注[14]. 我们知道, 目前临床上常用的肿瘤标记物均为单一的指标, 而肿瘤是由多基因突变、多步骤发生的异质性非常明显的病变, 单一指标诊断的敏感性和特异性不高是可想而知的; 而SELDI蛋白指纹技术是以整个蛋白质组作为检测对象, 是一种显示疾病过程中多重蛋白质变化的复合图像的模式诊断方法(pattern diagnostics), 理论上其敏感性和特异性应远远大于单指标的诊断方法, 而且实际应用中也得到了充分验证(表1).
| 肿瘤 | 生物标记物 | 样本 | 敏感性(%) | 特异性(%) | 作者 |
| 膀胱癌 | 5(7个蛋白簇) | 尿 | 87 | 66 | Ulahouet al, 2001 |
| 前列腺癌 | 9种 | 血清 | 83 | 97 | Adamet al, 2002 |
| 乳腺癌 | 3种 | 血清 | 91 | 91 | Liet al, 2002 |
| 胰腺癌 | HIP/PAP-I | 胰液 | 75 | 87 | Rostyet al, 2002 |
| 卵巢癌 | 8种 | 血清 | 100 | 95 | Petrioinet al, 2003 |
| 卵巢癌 | α-haptoglobin | 血清 | 84 | 未报 | Banderaet al, 2003 |
| 大肠癌 | 10种 | 血清 | 97 | 100 | 高春芳et al, 2003 |
| 大肠癌 | 7种 | 血清 | 83 | 89 | Yuet al. 2004 |
| 食管癌 | 12种 | 血清 | 91 | 86 | 王英et al, 2004 |
| 子宫颈癌 | 7种 | 组织匀浆 | 87 | 100 | Wonget al, 2004 |
| 肝癌 | 17个 | 血清 | 91 | 97 | 郑燕华et al, 2004 |
甲胎蛋白(AFP)是目前临床上最常用的肿瘤标记物, 但对于肝癌诊断的敏感性只有43%, 特异性46%. 我们利用SELDI技术发现肝癌患者和正常人的血清蛋白质指纹图谱之间有17个稳定的标志蛋白, 其中有6个标志蛋白在肝癌患者血清中高表达, 11个标志蛋白在肝癌患者血清中低表达(图1). 分析系统筛选出13 752 u及11 472 u标志蛋白建立起一个肝癌的诊断模型, 对肝癌的诊断特异性为97.06%, 灵敏度为91.18%, 及阳性预测率为96.88%. 此结果对肝癌的早期发现、早期治疗无疑具有重要价值. 此外, 在大样本双盲验证实验中我们还遇到个别晚期肝硬化患者亦存有某些肝癌相关性蛋白指纹改变, 此改变是否提示肝硬化癌变的早期信号, 需要进一步密切随访观察来验证.
CA125是目前卵巢癌血清学诊断最常用的肿瘤标记物, 但该抗原多在晚期肿瘤患者中才能检测出来, 而Ⅰ期患者阳性率仅在50%左右. 美国癌症研究所等单位应用SELDI技术对50例卵巢癌、66例非恶性肿瘤患者和63名正常人血清进行检测, 发现卵巢癌的敏感性达100%、特异性95%、阳性预测值94%[12]. 提示该技术可用于卵巢癌的早期诊断, 进而大大改善了患者5年存活率. 在此基础上, Zhang et al[4]收集了美国4所肿瘤研究所的503份血清样本, 进行盲筛和交叉验证, 从中发现了3种对早期卵巢癌有意义的生物标记物并对其进行了纯化鉴定. 使用这三种标记物与CA125联合进行免疫酶联检测, 特异性达97%.
前列腺癌是美国男性中最常见的恶性肿瘤之一, PSA对于前列腺癌的特异性仅为20-40%, 而许多前列腺肥大患者亦可出现PSA升高. 应用SELDI技术对前列腺癌患者9种特异性蛋白标记物的检测, 可将正常人、良性前列腺肥大和前列腺癌明确区分开, 其敏感性和特异性均在90%左右[9,15]. 该技术对于早期前列腺癌的筛查将起到越来越重要的作用.
粪便潜血是最常见的大肠癌早期指征之一, 但仅有50%大肠癌和30%大肠腺瘤潜血实验阳性; 大肠癌血清标记物CEA的敏感性为60%, 但特异性仅为23%, 远远不能满足早期诊断的要求. 高春芳et al[21]利用SELDI技术对62名正常人和32例大肠癌患者进行血清蛋白相对含量的分析, 发现10个蛋白在两组中有显著性差异, 对于大肠癌的识别的准确率为98.3%, 敏感性和特异性分别为97.3%和100%. 陈益定et al[22]也应用血清蛋白质质谱模型对55例大肠癌患者和92名正常人进行了检测, 发现对大肠癌的检出率为82.6%, 排除率为91.9%. 上述结果表明该技术对于大肠癌的早期检出不论在敏感性还是在特异性均优于传统的诊断技术.
胰腺癌是肿瘤的第4大死因, 在实性肿瘤中预后最差, 归其原因主要是由于早期诊断困难, 只有10-15%的患者在发现时是可切除的小肿瘤. 目前尚无可用于胰腺癌筛查的有效方法, 血清学肿瘤标记物CA19-9的敏感性和特异性尚不能满足胰腺癌早期诊断的需要. Koopmann et al[16]应用SELDI技术对胰腺癌、非恶性肿瘤患者和正常人各60例进行筛查, 发现了2种血清标记物对于区分胰腺癌与非肿瘤有97%的特异性, 明显优于目前临床上使用的任何一种肿瘤标记物. Rusty et al[23]在胰腺癌和胰腺炎患者胰液中发现一种16 u蛋白, 命名为肝癌-小肠-胰腺/胰腺炎相关蛋白I(HIP/PAP-I), 继而证实该蛋白由胰腺腺泡细胞分泌, ELISA检测发现胰腺癌血清中HIP/PAP-I明显增高, 胰液中的HIP/PAP-I是血清的1 000倍. 因而提示胰液中HIP/PAP-I的高表达对胰腺癌具有诊断意义.
Vlahou et al[17]对94例膀胱癌患者尿液进行了质谱分析, 发现了5种有意义的差异蛋白, 对于膀胱癌的诊断敏感性为87%, 特异性为66%, 他明显优于传统的检测方法, 为膀胱癌的早期诊断提供了一个无创伤的技术平台. Zhang et al[18]应用SELDI技术对46例移行细胞癌、32例良性泌尿道疾病患者和40名正常人的尿液进行检测, 发现对泌尿道移行细胞癌诊断的敏感性为84.8%, 而特异性达91.7%. 因此, 该技术可用于高危人群中膀胱癌的大规模筛查.
Paweletz et al[19]利用SELDI技术对乳腺癌和正常女性的乳汁进行了比较, 发现二者蛋白谱系有显著性差异. Li et al[20]在169例乳腺癌血清中检测到3种蛋白标记物, 对早期乳腺癌诊断的敏感性为93%, 而特异性也达到91%.
Wong et al[24]收集了62例宫颈上皮细胞标本、35例浸润性宫颈癌和27名年龄匹配的正常人宫颈标本进行蛋白组学模式分析, 利用在宫颈癌和正常宫颈中差异表达的7种蛋白, 建立分类记分系统. 应用该系统对于宫颈癌早期诊断的敏感性为89%, 特异性100%, 阳性预测值为100%, 而阴性预测值为86%, 因而对于宫颈癌的早期预警特别有价值. Yang et al[25]用SELDI技术在子宫内膜癌患者血清中筛查到一种特异性肿瘤标记物-chaperonin 10, 对于该肿瘤的早期诊断具有重要意义; Wilson et al在复发性黑色素瘤(25例)和无复发的黑色素瘤(24例)中发现了3种差异蛋白表达, 用此指标对原发性黑色素瘤根治切除术后患者的早期复发预测的敏感性和特异性分别为72%和75%, 具有早期预警意义. Lin et al[26]利用SELDI技术对滤泡性淋巴瘤组织匀浆进行了肿瘤标记物检测, 发现多种与肿瘤转化有关的蛋白改变, 其中32.5 ku蛋白(cyclin D3)上调和11.8 ku蛋白(caspase 3)下调. 因此, 该技术对于阐明肿瘤细胞转化和演进的分子机制亦具有重要价值.
SELDI技术除在肿瘤早期诊断中的用途外, 在其他疾病的诊断、疗效检测、发病机制探讨、新药发现和药理学研究、医学鉴定和毒物检测以及基础理论研究等方面亦具有广泛应用. 但是, 应当指出目前全世界SELDI飞行时间质谱仪实验室在质控血清建立及仪器标准化状态、自动化应用等方面存在着不统一的标准, 因此, 对于SELDI发现的生物标记物在用于临床诊断及其干预治疗之前, 必须进行严格的多中心和三期临床质控验证, 以最大可能的排除实验技术因素所产生的检测误差, 进一步提高诊断特异性和预警可靠性.
Ciphergen公司的高分辨率SELDI质谱, 或称杂合四极飞行时间质谱仪(QSTAR-TOF-MS)业已投入使用, 其分辨率至少可提高50倍以上, 可将低分辨SELDI-TOP-MS检测的宽而顿挫的蛋白波峰分开, 使每次实验所产生的信息量大大增加, 为小分子质量肿瘤标记物的检测提供了更灵敏的工具, 因而也对生物信息学分析软件的研发提出了更高的要求. 但高分辨率QSTAR质谱仍不能对测出蛋白质直接定性, 还需要进行常规的蛋白纯化和鉴定. 另外, 所获得的蛋白指纹不一定能够直接研发血清免疫检测方法, 因为离子的幅度不能直接反映相应标记物的浓度. 如果该标记物是一种大蛋白的裂解片段, 制备只识别这种裂解片段、而不识别原完整蛋白的抗体是很困难的. 可以制备多克隆抗体以结合裂解片段(肿瘤标记物)和完整蛋白, 然后再质谱洗脱分离和分析鉴定.
总之, 大量的研究已经证明以质谱为基础的蛋白指纹模式诊断有可能成为一种优于以抗体为基础的免疫检测技术. 目前的质谱平台敏感性是在飞摩尔(10-15)范围, 随着新技术的发展其敏感性会进一步提高. 很明显, 多种生物标记物组成的诊断模式比单一的标记物包含有更高水平的甄别信息, 特别是对于那些异质性明显的广大患者群体更为适合. 随着SELDI技术不断被大家接受, 多家大规模参考实验室已经启动了常规临床诊断应用的探讨协作研究计划(http://www.questdiagnostics.com; http://labcorp.com). 目前, 我们知道绝大多数生物标记物是与大分子循环载体蛋白一体存在的, 这一发现使我们对生物标记物分析的注意力转移到了载体蛋白及其生物标记物含量. 产生于微环境的蛋白组学模式可能预示着早期病变的存在, 这些早期肿瘤标记物或称甄别分子(discriminatory molecules)可能是代谢产物、酶切片段、修饰蛋白、多肽或细胞因子. 事实上, 最重要的肿瘤标记物可能是某些正常宿主蛋白, 这些蛋白发生了异常切割或丰度减低. 模式分析考虑到了质谱中某些离子的丢失或获得. 过去常规的肿瘤标记物的筛测方法舍弃了那些高丰度大分子"污染"蛋白, 而把重点放在低分子质量蛋白上, 从而漏掉了大多数具有重要诊断意义的标记物. Pitricoin et al[2]将蛋白质组学与纳米技术结合起来发明了一种新的工具, 通过纳米收集递质(nanoharvesting agents)放置在循环中或血液收集器皿中黏附和放大肿瘤标记物, 这些纳米颗粒与诊断分子结合物可直接被质谱仪检出, 从而有利于发现那些低分子质量肿瘤标记物的蛋白指纹图谱.
编辑: N/A
| 1. | Tirumalai RS, Chan KC, Prieto DA, Issaq HJ, Conrads TP, Veenstra TD. Characterization of the low molecular weight human serum proteome. Mol Cell Proteomics. 2003;2:1096-1103. [PubMed] [DOI] |
| 2. | Petricoin EF, Liotta LA. SELDI-TOF-based serum proteomic pattern diagnostics for early detection of cancer. Curr Opin Biotechnol. 2004;15:24-30. [PubMed] [DOI] |
| 3. | Grizzle WE, Semmes OJ, Basler J, Izbicka E, Feng Z, Kagan J, Adam BL, Troyer D, Srivastava S, Thornquist M. The early detection research network surface-enhanced laser desorption and ionization prostate cancer detection study: A study in biomarker validation in genitourinary oncology. Urol Oncol. 2004;22:337-343. [PubMed] [DOI] |
| 4. | Zhang Z, Bast RC Jr, Yu Y, Li J, Sokoll LJ, Rai AJ, Rosenzweig JM, Cameron B, Wang YY, Meng XY, Berchuck A, Van Haaften-Day C, Hacker NF, de Bruijn HW, van der Zee AG, Jacobs IJ, Fung ET, Chan DW. Three biomarkers identified from serum proteomic analysis for the detection of early stage ovarian cancer. Cancer Res. 2004;64:5882-5890. [PubMed] [DOI] |
| 5. | Conrads TP, Hood BL, Issaq HJ, Veenstra TD. Proteomic patterns as a diagnostic tool for early-stage cancer: a review of its progress to a clinically relevant tool. Mol Diagn. 2004;8:77-85. [PubMed] |
| 6. | Wilson LL, Tran L, Morton DL, Hoon DS. Detection of differentially expressed proteins in early-stage melanoma patients using SELDI-TOF mass spectrometry. Ann N Y Acad Sci. 2004;1022:317-322. [PubMed] [DOI] |
| 7. | Wong YF, Cheung TH, Lo KW, Wang VW, Chan CS, Ng TB, Chung TK, Mok SC. Protein profiling of cervical cancer by protein-biochips: proteomic scoring to discriminate cervical cancer from normal cervix. Cancer Lett. 2004;211:227-234. [PubMed] [DOI] |
| 8. | Fowler LJ, Lovell MO, Izbicka E. Fine-needle aspiration in PreservCyt: a novel and reproducible method for possible ancillary proteomic pattern expression of breast neoplasms by SELDI-TOF. Mod Pathol. 2004;17:1012-1020. [PubMed] [DOI] |
| 9. | Cazares LH, Adam BL, Ward MD, Nasim S, Schellhammer PF, Semmes OJ, Wright GL Jr. Normal, benign, preneoplastic, and malignant prostate cells have distinct protein expression profiles resolved by surface enhanced laser desorption/ionization mass spectrometry. Clin Cancer Res. 2002;8:2541-2552. [PubMed] |
| 10. | Menon U, Jacobs I. Screening for ovarian cancer. Best Pract Res Clin Obstet Gynaecol. 2002;16:469-482. [PubMed] [DOI] |
| 11. | Adam BL, Qu Y, Davis JW, Ward MD, Clements MA, Cazares LH, Semmes OJ, Schellhammer PF, Yasui Y, Feng Z. Serum protein fingerprinting coupled with a pattern-matching algorithm distinguishes prostate cancer from benign prostate hyperplasia and healthy men. Cancer Res. 2002;62:3609-3614. [PubMed] |
| 12. | Petricoin EF, Ardekani AM, Hitt BA, Levine PJ, Fusaro VA, Steinberg SM, Mills GB, Simone C, Fishman DA, Kohn EC. Use of proteomic patterns in serum to identify ovarian cancer. Lancet. 2002;359:572-577. [PubMed] [DOI] |
| 15. | Meehan KL, Holland JW, Dawkins HJ. Proteomic analysis of normal and malignant prostate tissue to identify novel proteins lost in cancer. Prostate. 2002;50:54-63. [PubMed] [DOI] |
| 16. | Koopmann J, Zhang Z, White N, Rusenzweig J, Fedarko N, Jagannath S, Canto ML, Yeo CJ, Chan DW, Goggins M. Serum diagnosis of pancreastic adenocarcinoma using surface-enhanced laser desorption and ionization mass spectrometry. Clin Cancer Res. 2004;10:860-868. [DOI] |
| 17. | Vlahou A, Schellhammer PF, Mendrinos S, Patel K, Kondylis FI, Gong L, Nasim S, Wright Jr GL Jr. Development of a novel proteomic approach for the detection of transitional cell carcinoma of the bladder in urine. Am J Pathol. 2001;158:1491-1502. [PubMed] [DOI] |
| 18. | Zhang YF, Wu DL, Guan M, Liu WW, Wu Z, Chen YM, Zhang WZ, Lu Y. Tree analysis of mass spectral urine profiles discriminates transitional cell carcinoma of the bladder from noncancer patient. Clin Biochem. 2004;37:772-779. [PubMed] [DOI] |
| 19. | Paweletz CP, Trock B, Pennanen M, Tsangaris T, Magnant C, Liotta LA, Petricoin EF 3rd. Proteomic patterns of nipple aspirate fluids obtained by SELDI-TOF: potential for new biomarkers to aid in the diagnosis of breast cancer. Dis Markers. 2001;17:301-307. [PubMed] [DOI] |
| 20. | Li J, Zhang Z, Rosenzweig J, Wang YY, Chan DW. Proteomics and bioinformatics approaches for identification of serum biomarkers to detect breast cancer. Clin Chem. 2002;48:1296-1304. [PubMed] |
| 21. | 高 春芳, 赵 光, 宋 国英, 李 冬晖, 王 秀丽, 许 扬, 马 龙华. 用飞行时间质谱仪筛选界直肠癌患者中特异性生物标记物的临床意义. 中华检验医学杂志. 2003;26:658-661. |
| 23. | Rosty C, Christa L, Kuzdzal S, Baldwin WM, Zahurak ML, Carnot F, Chan DW, Canto M, Lillemoe KD, Cameron JL. Identification of hepatocarcinoma-intestine-pancreas/pancreatitis-associated protein I as a biomarker for pancreatic ductal adenocarcinoma by protein biochip technology. Cancer Res. 2002;62:1868-1875. [PubMed] |
| 24. | Wong YF, Cheung TH, Lo KW, Wang VW, Chan CS, Ng TB, Chung TK, Mok SC. Protein profiling of cervical cancer by protein-biochips: proteomic scoring to discriminate cervical cancer from normal cervix. Cancer Lett. 2004;211:227-234. [PubMed] [DOI] |
| 25. | Yang EC, Guo J, Diehl G, DeSouza L, Rodrigues MJ, Romaschin AD, Colgan TJ, Siu KW. Protein expression profiling of endometrial malignancies reveals a new tumor marker: chaperonin 10. J Proteome Res. 2004;3:636-643. [PubMed] [DOI] |
| 26. | Lin Z, Jenson SD, Lim MS, Elenitoba-Johnson KS. Application of SELDI-TOF mass spectrometry for the identification of differentially expressed proteins in transformed follicular lymphoma. Mod Pathol. 2004;17:670-678. [PubMed] [DOI] |