修回日期: 2004-09-13
接受日期: 2004-10-11
在线出版日期: 2004-11-15
目的: 构建人源化抗肝癌双价抗体, 并实现其在大肠杆菌中的可溶性表达.
方法: 缩短人源化抗肝癌单链抗体hscFv25的连接肽为5肽, 构建(hscFv25)2基因, 克隆入原核表达载体后, 转化入大肠杆菌表达, 并纯化目的蛋白, 细胞ELISA、免疫组织化学法检测其生物活性.
结果: 目的基因在大肠杆菌中得到了可溶性表达, 纯化蛋白的相对亲和力比亲本抗体提高了10倍左右, 对肝癌组织切片的免疫组织化学染色呈强阳性, 阳性率为75%.
结论: 成功制备了人源化抗肝癌双价抗体, 该抗体具有较高的亲和力, 为进一步的临床研究奠定了基础.
引文著录: 孙志伟, 赵君, 王双, 俞炜源, 刘彦仿. 抗肝癌人源化Diabody在大肠杆菌中的可溶性表达及活性鉴定. 世界华人消化杂志 2004; 12(11): 2740-2742
Revised: September 13, 2004
Accepted: October 11, 2004
Published online: November 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2740-2742
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2740.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2740
Diabody是单链抗体的二聚体形式, 相对分子质量大约Mr 55 000的双价抗体, 具有较高的亲和力和较强的穿透能力, 同时血清廓清时间又比较合适, 因此是比较理想的肿瘤放射免疫诊断和治疗载体[1]. 我们已经制备了一株亲和力较好、特异性较高的人源化抗肝癌单链抗体hscFv25, 该抗体具有良好的靶向定位功能[2]. 我们将hscFv25的连接肽改成5肽(GGGGS), 构建人源化抗肝癌双价抗体基因并在大肠杆菌中对该基因进行可溶性表达研究, 目的获得高亲和力的人源化抗肝癌双价抗体(hscFv25)2, 为进一步的临床应用研究奠定基础.
E.coli BL21(DE3)菌株为本室保存. 表达载体pTIG为军事医学科学院生物工程研究所赵志虎副研究员惠赠, 含促进可溶性表达的伴侣分子硫氧还蛋白基因(Trx), Trx与下游抗体基因之间引入了翻译终止启始序列TAAATG. IPTG、琼脂糖、SDS-PAGE所用材料及限制性内切酶等, 购自Sigma公司. Taq DNA聚合酶和T4 DNA连接酶为Promega公司产品. PCR引物由上海生物工程公司合成, 序列如下: P1:5'-CGGAATTCTAAATGGAGGTACAGCTGGTTGA ATC-3'(VH 5'端引物, 引入EcoR I酶切位点和终止启始序列TAAATG); P2:5'-CAGGAGCTCTGGACACTGGCCTGGCTT-3'(VH 3'端引物, 3'端引入SacI酶切位点); P3:5'-CGGAGCTC GGAGGT GGAGGTTCTATGACCCAGACTCCATCTCC-3'(VL 5'端引物, 包含5肽Linker和引入的SacI酶切位点); P4:5'-CCCAAGCTTACGCGGT TCCAGCGGA TCCGG-3'(3'端引物, 于模板上VL 3'端后面的检测标签E-tag相配对, 同时引入HindⅢ酶切位点).
1.2.1 重链可变区(VH)、含5个连接肽的轻链突变体(Linker-VL-E-tag)基因的PCR扩增: 以pTIG-hscFv25-E-tag为模板, P1和P2为引物, PCR扩增VH基因片段; 以P3和P4为引物, PCR扩增Linker-VL-E-tag基因片段.
1.2.2 重组表达载体pTIG(hscFv25)2的构建: 上述PCR产物经胶回收后分别用EcoR I、SacI和SacI、HindⅢ酶切并与EcoR I、HindⅢ酶切的表达载体pTIG大片段进行3片段连接, 构建重组表达载体pTIG(hscFv25)2, 转化E.coli BL21(DE3)感受态细菌, 碱裂解法提取质粒并用EcoR I和HindⅢ双酶切鉴定, 对酶切鉴定阳性克隆进行序列测定.
1.2.3 诱导表达: 含重组表达载体pTIG(hscFv25)2的宿主菌BL21(DE3), 以IPTG(终浓度为0.2 mmol/L)于28 ℃诱导表达6 h, 离心收集菌体, 超声碎菌. 进行12% SDS-PAGE及以鼠抗E-tag抗体为二抗的Western blot鉴定.
1.2.4 可溶性表达产物的纯化: 诱导表达pTIG(hscFv25)2菌体100 mL, 离心收集菌体, 超声碎菌15 min后, 取上清, 用Ni-NTA Agarose亲和层析法纯化表达产物(载体多克隆位点下游含6×His). 表达产物的纯度采用SDS-PAGE鉴定, 经核酸蛋白检测仪定量后, 除菌分装, 4 ℃保存备用.
1.2.5 (hscFv25)2的活性的鉴定
1.2.5.1 细胞ELISA检测(hscFv25)2: 相对亲和力和特异性SMMC-7721肝癌细胞及正常肝细胞HL-02铺96孔板, 经固定和封闭后, 以上述纯化产物(hscFv25)2为一抗(做倍比稀释, 最高终浓度为20 mg/L), 以鼠抗E-tag抗体为二抗, 进行细胞ELISA, 酶标仪测定A492/630值, 达到饱和后的A492/630值降低到50%时的抗体浓度为(hscFv25)2的相对亲和力. 以亲本单链抗体hscFv25-E-tag为平行对照.
1.2.5.2 临床肝癌患者石蜡切片免疫组织化学染色: 上述纯化的(hscFv25)2对60例临床确诊的肝癌、3例肝硬化及2例正常肝的石蜡切片进行常规免疫组织化学染色, 显微镜下观察结果.
VH基因PCR扩增片段、Linker-VL- E-tag PCR基因扩增片段与pTIG表达载体大片段进行3片段连接, 转化E.coli BL21(DE3)感受态细菌, 提取质粒. 该质粒经EcoR I和Sal I双酶切, 可切出约760 bp大小的片段, 与目的基因大小相符, 后经序列测定证实序列与设计一致, 说明重组表达载体pTIG(hscFv25)2构建成功.
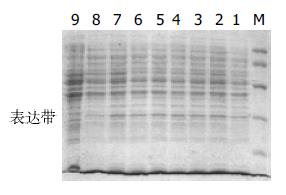
将重组pTIG(hscFv25)2表达载体转化的宿主菌BL21(DE3), 经IPTG诱导(以未诱导的同一菌株为对照)表达, 碎菌上清进行的12% SDS-PAGE显示, 约在Mr 30 000处出现1条新生蛋白带(图1), 与目的蛋白的大小相一致, 表达量约占细菌裂解上清总蛋白量的8%左右, 说明是可溶性表达, 可溶性表达产物经Nie柱(His亲和层析柱)纯化, 纯度达到电泳纯. 可溶性表达产物经Western blot鉴定, 证实为目的基因表达产物.
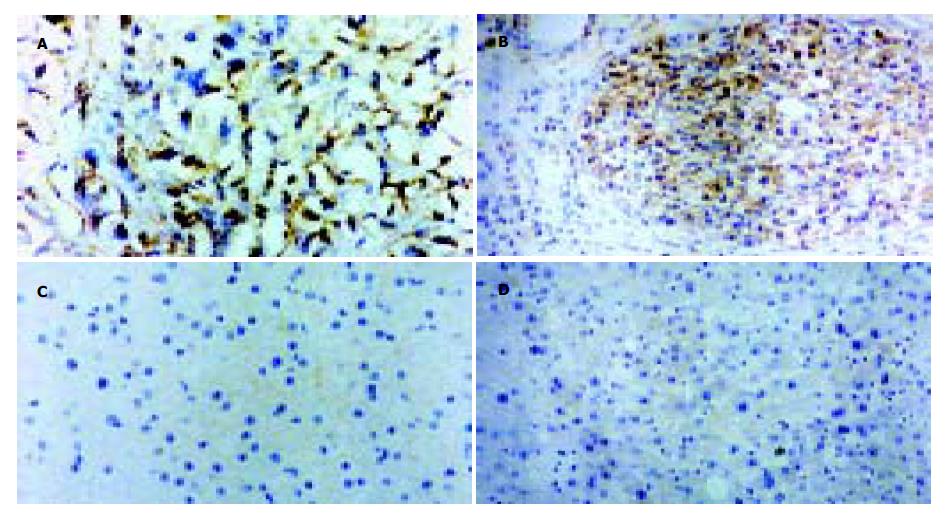
细胞ELISA检测结果显示, 所纯化的表达产物可与SMMC-7721肝癌细胞结合而与正常肝细胞HL-02不结合, Diabody的相对亲和力约为0.25 mg/L, 而亲本单链抗体的相对亲和力约为2.50 mg/L, 即Diabody的相对亲和力提高了10倍左右. 肝癌石蜡切片脱蜡、封闭后, 加纯化产物37 ℃作用1 h, 洗涤三次, 加鼠抗E-tag抗体(1:2 000), 37 ℃作用1 h, 洗涤三次, 加HRP标记的兔抗鼠抗体, 37 ℃作用30 min后显色, 衬染封片后在显微镜下观察. 结果显示, 有45例为阳性, 阳性率为75%, 抗原主要定位于肿瘤细胞膜上, 少数病例细胞质或细胞核也呈阳性, 癌旁肝、正常肝及肝硬化组织未见阳性着色(图2), 这于亲本单克隆抗体相一致, 说明我们所制备的人源化抗肝癌(hscFv25)2较好地保持了亲本抗体的特异性, 其相对亲和力比其亲本单链抗体大约高10倍.
我国是肝癌高发区, 10年前的统计数字就显示, 我国每年有11万人死于肝细胞肝癌, 今年来虽未见明确的统计数字, 但可以肯定的是其发病率还在呈上升趋势. 对于肿瘤的治疗, 基因工程抗体再次成为肿瘤诊断和治疗研究的热点. 对于实体瘤的体内诊断和治疗, 小分子抗体是比较理想的靶向载体, 目前已有数株小分子抗体作为放射免疫诊断或治疗载体被批准上市, 但尚无肝癌体内诊断性或治疗性抗体上市[3]. 在我国, 目前有一株同位素标记的, 通过全抗体消化而制备的鼠源性抗肝癌抗体片段进入临床研究的报道, 在国外还未见类似报道. Diabody具有穿透能力强、亲和力较高和半衰期较合适等特点, 同时又具有基因操作简单, 容易进行高效表达和大规模生产, 因此是比较理想的放射免疫诊断或治疗载体[2,4]. Diabody是单链抗体通过自然折叠而形成的二聚体形式, 两条链间无共价键连接, 但和单链抗体一样, 轻重链可变区之间也需要连接肽连接, 连接肽的长度以5-10个氨基酸为宜, 多数报道为5肽, 即GGGGS. 连接肽长度不宜过长, 否则活性蛋白会以单链抗体的形式存在, 但也不宜过短, 否则活性蛋白会以多聚体的形式存在(三价抗体活四价抗体)[5-6].
我们已经制备了一株抗肝癌人源化单链抗体, 该抗体与肿瘤坏死因子α、PE38等基因融合表达的抗肝癌双功能抗体, 对荷肝癌移植裸鼠具有一定的导向杀伤作用[7], 表明单链抗体具有良好的靶向性能, 因此我们将该单链抗体改造成Diabody, 为应用该型抗体进行临闯肝癌的放射免疫诊断或治疗奠定基础.
编辑: N/A
| 1. | Yazaki PJ, Wu AM, Tsai SW, Williams LE, Ikler DN, Wong JY, Shively JE, Raubitschek AA. Tumor targeting of radiometal labeled anti-CEA recombinant T84.66 diabody and t84.66 minibody: comparison to radioiodinated fragments. Bioconjug Chem. 2001;12:220-228. [PubMed] [DOI] |
| 4. | Tahtis K, Lee FT, Smyth FE, Power BE, Renner C, Brechbiel MW, Old LJ, Hudson PJ, Scott AM. Biodistribution properties of (111)indium-labeled C-functionalized trans-cyclohexyl diethylenetriaminepentaacetic acid humanized 3S193 diabody and F(ab')(2) constructs in a breast carcinoma xenograft model. Clin Cancer Res. 2001;7:1061-1072. [PubMed] |
| 5. | Todorovska A, Roovers RC, Dolezal O, Kortt AA, Hoogenboom HR, Hudson PJ. Design and application of diabodies, triabodies and tetrabodies for cancer targeting. J Immunol Methods. 2001;248:47-66. [PubMed] [DOI] |
| 6. | Wu AM, Chen W, Raubitschek A, Williams LE, Neumaier M, Fischer R, Hu SZ, Odom-Maryon T, Wong JY, Shively JE. Tumor localization of anti-CEA single-chain Fvs:improved targeting by non-covalent dimers. Immunotechnology. 1996;2:21-26. [DOI] |