修回日期: 2004-05-30
接受日期: 2004-06-09
在线出版日期: 2004-11-15
目的: 通过筛选HBsAg基因启动子I(surface promoter I, SP Ⅰ)结合蛋白, 为HBV复制机制的研究探索新的途径.
方法: 应用噬菌体展示技术, 以HBsAg基因启动子I的聚合酶链反应(PCR)产物DNA作为固相筛选分子, 对噬菌体人肝细胞cDNA文库进行4轮"黏附-洗脱-扩增"筛选过程, 经噬斑的PCR扩增后, 构建克隆载体, 最后对所筛选克隆进行DNA序列分析和同源性搜索.
结果: 噬菌体经富集后, 从随机筛选的14个克隆中得到8个阳性克隆, 成功构建了克隆载体. 序列测定后经过同源性搜索, 确定了和HBV表面抗原基因启动子I特异结合的肝细胞蛋白, 共编码7种蛋白. 其中3个克隆编码未知功能蛋白; 其余的克隆分别编码4-氨基丁酸氨基转移酶、触珠蛋白、复制蛋白等蛋白.
结论: 用噬菌体人肝cDNA文库筛选得到HBsAg基因启动子I的结合蛋白, 分析了该蛋白的编码基因.
引文著录: 杨艳杰, 成军, 陈东风, 王春花, 黄燕萍, 吴煜, 刘敏, 王建军, 钟彦伟, 刘妍, 张黎颖. 应用噬菌体展示技术筛选HBsAg启动子I的DNA结合蛋白. 世界华人消化杂志 2004; 12(11): 2737-2739
Revised: May 30, 2004
Accepted: June 9, 2004
Published online: November 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2737-2739
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2737.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2737
乙型肝炎病毒(HBV)持续感染导致全球性健康问题. 世界人口约6%是病毒携带者, 因此HBV是慢性肝病的重要病原体, 且是引发肝细胞癌(HCC)的重要因素[1-5], 而病毒基因组编码的蛋白与宿主肝细胞之间的相互作用, 可能是病毒致肝细胞癌的重要分子机制[6-12]. HBV基因组分为结构基因序列和调节基因序列两大部分. 调节基因序列和结构基因序列相互重叠, 即使结构基因序列本身也有部分重叠, 因此, HBV具有结构紧密的特点. HBsAg基因含有两个串联的启动子SP Ⅰ和SP Ⅱ. 其中SP Ⅰ(2 219-2 780 nt)调节2.4 kb mRNA的转录, 编码表面抗原大蛋白. 在HBV复制中具有十分重要的作用. SP Ⅰ含有典型TATA盒序列, 其上游50 bp处为肝细胞特异性核因子(hepatocyte nuclear factor, HNF)1结合位点. 该结合位点是HBV转录调节的重要组分, 也是HBV嗜肝性的重要原因之一; 这一位点可能还有其他肝特异因子与之结合, 从而调节2.4 kb mRNA的转录[13-14]. 另外, SPⅠ的腺嘌呤(A)、胸腺嘧啶(T)核苷酸丰富区中还有一个AFP-1(一种可与AFP基因的增强子及启动子结合的核因子)结合位点, 也可能与肝细胞特异性的转录有关. 因此, 作为指导前-S基因组RNA转录的SPI启动子在HBV的生活周期中具有十分重要的作用. 为了寻找与SP Ⅰ结合的肝特异性转录作用因子, 进一步探讨SP Ⅰ的转录调节机制, 我们应用噬菌体展示技术, 利用人肝细胞cDNA文库, 以生物素化的SP Ⅰ的DNA作为固相分子进行筛选, 研究影响HBV DNA复制的肝细胞蛋白的结构和功能.
T7 select人肝细胞cDNA文库, 受体菌BLT5615(Novagen公司), 质粒pGEM-Teasy和pcDNA3.1(-)(Promega公司), Taq酶、琼脂糖、dNTP、T4连接酶、RNA酶、玻璃奶DNA回收试剂盒(博大科技), EcoRⅠ、BamHⅠ、MluⅠ、NheⅠ(购于宝生物公司), 热循环仪、凝胶成像仪、酶联吸附读数仪、大肠杆菌DH5α、pCP10质粒为本实验室保存.
1.2.1 肝细胞cDNA文库的筛选: HBV SP Ⅰ启动子的扩增根据HBV ayw的基因序列, 在编码区的上游和下游分别设计合成一对寡核苷酸引物, 并用生物素标记, P1: 5'-ACGCGTGAACATCTAGTTAATC-3', P2: 5'-GCT AGC GCT GTA GAT CTT GTT C-3'在引物5'端分别引入MluⅠ和NheⅠ位点, 由赛百盛公司合成. 在0.5 mL Ep管中依次加入17 μL双蒸水, 2.5 μL的10×缓冲液(含20 mmol/L MgCL2), 2 μL 2 mmol/L dNTP, 1 μL 12.5 μmol/L P1和P2, 1 μL pCP10质粒, 0.5 μL Taq酶(5 Mu/L). 放入PE 9 600 PCR仪中扩增. 扩增条件: 94 ℃变性60 s, 57 ℃退火60 s, 72 ℃延伸60 s, 循环33次后, 72 ℃保温10 min. 10 g/L琼脂糖凝胶电泳鉴定扩增结果. 玻璃奶法回收DNA片段. 文库扩增: 将BLT5615新鲜克隆在3 mL LB/Amp内振摇, 37 ℃过夜. 在3 mL LB/Amp内加入30 μL振摇细菌, 将细菌浓度摇至A600值0.5, 加入30 μL IPTG, 再振摇30 min后加入噬菌体文库5 μL. 37 ℃振摇1-3 h直到观察到细菌裂解. 8 000 g离心10 min, 将上清移至另一无菌Ep管中, 4 ℃保存. 链亲和素20 μL(1 g/L)包被微孔板, 4 ℃过夜. 1×TBS洗涤, 加入100 μL SP Ⅰ启动子DNA回收片段, 4 ℃过夜. 1×TBST(5 g/L Tween-20)洗涤5遍, 加入文库扩增裂解液100 μL, 4 ℃过夜. 1×TBST洗板5次, 加入100 μL T7洗脱缓冲液, 室温孵育20 min, 将洗脱液移至另一无菌Ep管中. 将15 μL洗脱噬菌体加入3 mL中对数生长期的细菌培养液, 37 ℃振摇培养, 直到看到细菌裂解. 8 000 g离心10 min, 将上清移到一新Ep管, 4 ℃保存备下一轮筛选用. 每轮筛选后, 均做噬斑分析. 按上述步骤再筛选5遍.
1.2.2 噬斑的PCR扩增: 刮取第5轮筛选后的阳性噬斑, 置于100 μL pH 8.0的10 mol/L EDTA的Ep管中, 65 ℃加热10 min, 14 000 g离心10 min至澄清. 在0.5 mL管中依次加入40 μL双蒸水, 5 μL的10×缓冲液(含20 mmol/L MgCL2), 4 μL 2 mmol/L dNTP, 1 μL 12.5 μmol/L T7 select上游引物P3: 5'-GGA GCT GTC GTA TTC CAG TC-3'和下游引物P4: 5'-AAC CCC TCA AGA CCC GTT TA-3', 1 μL pCP10质粒, 0.5 μL Taq酶(5 Mu/L)放入PE 9 600 PCR仪中扩增. 扩增条件: 94 ℃变性60 s, 50 ℃退火55 s, 72 ℃延伸60 s, 循环35次后, 72 ℃保温10 min. 10 g/L琼脂糖凝胶电泳鉴定扩增结果. 玻璃奶法回收DNA片段.
1.2.3 序列比对和同源性分析: 将纯化的噬斑PCR产物与pGEM-Teasy载体混合, 在16 ℃条件下用T4 DNA连接酶连接过夜, 随后转化用氯化钙法制备的大肠杆菌DH5α感受态细胞, 在铺有IPTG/X-gal的氨苄西林平板上进行蓝白斑菌落筛选, 挑取白色菌落用碱裂解法提取质粒, 进行酶切鉴定. 以酶切鉴定阳性的重组子为模板, 进行目的基因的DNA序列测定, 序列测定由上海博亚生物公司完成. 同源性搜索由以下网址上的BLASTn软件完成(http: //http://www.ncbi.nlm.nih.gov/blastn).
以固相化的SPI启动子DNA片段作为支持分子, 对肝细胞cDNA文库进行4轮"吸附-洗脱-扩增"的筛选. 噬菌体的富集结果见表1. 从固相平板洗脱的噬菌体数显示了明显的增加趋势, 第4轮与第1轮相比, 富集了356倍(富集倍数=第4轮产出率/第1轮产出率 产出率=洗脱的噬菌体数量/所用的噬菌体数量).
| 筛选次数 | 噬菌体数 | 产出率 | |
| 投入 | 捕获 | ||
| 第1轮 | 3.5×108 | 2.5×1011 | 7.1×102 |
| 第2轮 | 2.5×1011 | 2.6×1015 | 1.0×104 |
| 第3轮 | 2.6×1015 | 1.5×1020 | 5.8×104 |
| 第4轮 | 1.5×1020 | 3.8×1025 | 2.5×105 |
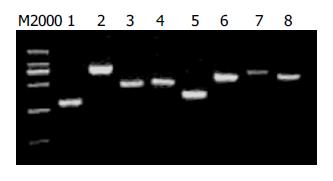
经过4轮筛选, 随机挑取14个噬斑为模板, 用T7 select引物进行PCR扩增, PCR产物用10 g/L琼脂糖凝胶电泳. 结果产生片段大小不等的条带(图1), 用同一噬斑裂解液重复PCR得到相同结果.
对阳性克隆基因的DNA序列测定, 及根据GenBank数据库提供的数据库进行BLASTn同源性搜索, 8个阳性克隆筛选到启动子DNA结合蛋白, 共编码7种蛋白. 其中3个克隆编码未知功能蛋白; 其余的克隆分别编码4-氨基丁酸氨基转移酶、触珠蛋白、复制蛋白等蛋白(表2).
| 编号 | 编码蛋白 | 同源性(%) | 克隆数 |
| 1 | isolate 183 mitochondrion(孤立线粒体183) | 99 | 1 |
| 2 | RF-C/activator 1 homolog(释放因子C/激活因子1同源体) | 100 | 1 |
| 3 | hypothetical protein MGC9515(人类假想蛋白MGC9515) | 99 | 2 |
| 4 | haptoglobin(触珠蛋白) | 99 | 1 |
| 5 | 4-aminobutyrate aminotransferase(4-氨基丁酸氨基转移酶) | 100 | 1 |
| 6 | chromosome 3 clone RP11-801L18(复制蛋白11-801L18) | 100 | 1 |
| 7 | hypothetical protein FLJ22056(人类假想蛋白FLJ22056) | 100 | 1 |
作为调节元件的一段DNA序列, 可与某些细胞蛋白或病毒蛋白结合, 正性或负性调节转录. HBV的SP Ⅰ启动子是HBV的一个重要调节元件. 转录因子HNF1和HNF3对SPⅠ的转录调节具有重要作用, 他们作用的位置在肝脏而不在其他组织. 这两种因子协同作用可能抑制2.4 kb mRNA的转录. 在多聚腺苷酸(PolyA)加尾信号、糖皮质激素应答元件(GRE)、增强子Ⅰ(ENHⅠ)、增强子Ⅱ(ENHⅡ)和HBxAg及其他的细胞因子作用下顺式或反式激活SP Ⅰ, 开始发挥调节功能[15-16]. SP Ⅰ调节2.4 kb的mRNA转录, 编码大蛋白. 对HBV转基因鼠的研究显示, 2.4 kb mRNA在肝组织内呈严格分布, 具有高度的嗜肝性. 由于大蛋白的增加易导致病毒包膜蛋白在细胞内蓄积, 引起细胞病变效应[17-18]. HBV各种包膜蛋白的这种比例不仅有利于感染性HBV颗粒成熟和释放, 而且有利于宿主细胞的生存, 使二者能共生共存[19-20]. 因此, 3种外膜蛋白的产量有正常比例, 大蛋白过量时, 将顺式干扰SP Ⅱ, 从而降低基因的转录水平. Li et al[21]从1例慢性肝炎患者血清中分离到S基因启动子缺失变异株, 转染肝癌细胞后, 大蛋白过度表达, 而中、主蛋白表达减少, 因而病毒及亚病毒颗粒的分泌都受到抑制, 肝细胞内大蛋白堆积, 认为可能是慢性肝炎肝细胞毛玻璃样变性的原因. 他们进一步研究发现, 过度表达的大蛋白在肝细胞内质网通过激活grp78和grp94启动子, 改变宿主细胞的生理功能[22-24]. 转基因小鼠模型已经证实, 若大蛋白过度表达, 在肝细胞内堆积, 将导致肝细胞内质网肿胀, 肝细胞变性. 因此, 在感染过程中, 改变大、中、小蛋白的比例将影响疾病的进程.
我们以已知启动子DNA序列筛选出与其相结合的蛋白编码基因, 通过生物息信分析来确定该蛋白质的名称. 经过4轮"吸附-洗脱-扩增"筛选过程, 结果得到了8个阳性克隆, 共表达7种蛋白. 其中有3个为未知功能蛋白, 对已知功能蛋白, 如4-氨基丁酸氨基转移酶、触珠蛋白(haptoglobin)、复制蛋白等蛋白的结合作用, 尚未见有文献报道, 需体外结合及真核细胞共转染等实验进一步证实. 总之, 本实验应用噬菌体展示技术, 试图寻找与HBV SP Ⅰ启动子结合的肝特异蛋白及HBV、特别是表面抗原大蛋白严格嗜肝性的原因, 探索病毒表面抗原大蛋白转录、翻译的调控机制. 通过本实验, 我们筛选到了一些与SP Ⅰ启动子序列特异结合的蛋白, 为今后更好地了解HBV的转录调控机制及其生活史打下了基础.
编辑: N/A
| 1. | Dai LC, Yao X, Lu YL, Ping JL, Zhang BW, Ni CR. [Expression of midkine and its relationship with HBV infection in hepatocellular carcinomas]. Zhonghua Yixue Zazhi. 2003;83:1691-1693. [PubMed] |
| 2. | Huo TI, Wu JC, Lui WY, Lee PC, Huang YH, Chau GY, Tsay SH, Chang FY, Lee SD. Diabetes mellitus is a recurrence-independent risk factor in patients with hepatitis B virus-related hepatocellular carcinoma undergoing resection. Eur J Gastroenterol Hepatol. 2003;15:1203-1208. [DOI] |
| 3. | Fujioka S, Shimomura H, Iwasaki Y, Fujio K, Nakagawa H, Onishi Y, Takagi S, Taniguchi H, Umeoka F, Nakajima H. Hepatitis B virus gene in liver tissue promotes hepatocellular carcinoma development in chronic hepatitis C patients. Dig Dis Sci. 2003;48:1920-1924. [PubMed] [DOI] |
| 4. | Wang T, Wang Y, Wu MC, Guan XY, Yin ZF. Activating mechanism of transcriptor NF-kappaB regulated by hepatitis B virus X protein in hepatocellular carcinoma. World J Gastroenterol. 2004;10:356-360. [PubMed] |
| 5. | Kwon JA, Rho HM. Transcriptional repression of the human p53 gene by hepatitis B viral core protein (HBc) in human liver cells. Biol Chem. 2003;384:203-212. [PubMed] [DOI] |
| 7. | 成 军, 钟 彦伟, 施 双双, 倪 勤, 夏 小兵, 董 菁, 王 刚, 刘 友昭, 王 琳, 刘 妍. 乙型肝炎病毒表面抗原人源单链可变区抗体基因的克隆与鉴定. 肝脏. 2000;5:130-132. |
| 8. | Kao JH, Chen PJ, Lai MY, Chen DS. Basal core promoter mutations of hepatitis B virus increase the risk of hepatocellular carcinoma in hepatitis B carriers. Gastroenterology. 2003;124:327-334. [PubMed] [DOI] |
| 9. | Raimondo G, Costantino L, Caccamo G, Pollicino T, Squadrito G, Cacciola I, Brancatelli S. Non-sequencing molecular approaches to identify preS2-defective hepatitis B virus variants proved to be associated with severe liver diseases. J Hepatol. 2004;40:515-519. [PubMed] [DOI] |
| 10. | Dong J, Cheng J, Wang QH, Liu Y, Wang G, Shi SS, Xia XB, Shao Q, Si CW. The preliminary study on hepatitis B virus (HBV) quasispecies in patients with chronic HBV infection. China J Infect Dis. 2001;19:199-203. |
| 11. | 董 菁, 成 军, 王 勤环, 皇甫 竞坤, 施 双双, 张 国庆, 洪 源, 李 莉, 斯 崇文. 乙型肝炎病毒DNA序列异质性及准种特点的研究. 中华医学杂志. 2002;82:81-85. |
| 12. | Cheng J. Progress in gene therapy for liver diseases. J Gastroenterol Hepatol. 1999;14:A261-262. |
| 13. | Cai YN, Zhou Q, Kong YY, Li M, Viollet B, Xie YH, Wang Y. LRH-1/hB1F and HNF1 synergistically up-regulate hepatitis B virus gene transcription and DNA replication. Cell Res. 2003;13:451-458. [PubMed] [DOI] |
| 14. | Schulte-Frohlinde E, Seidler B, Burkard I, Freilinger T, Lersch C, Erfle V, Foster GR, Classen M. Different activities of type I interferons on hepatitis B virus core promoter regulated transcription. Cytokine. 2002;17:214-220. [PubMed] [DOI] |
| 15. | Li J, Xu Z, Zheng Y, Johnson DL, Ou JH. Regulation of hepatocyte nuclear factor 1 activity by wild-type and mutant hepatitis B virus X proteins. J Virol. 2002;76:5875-5881. [PubMed] [DOI] |
| 16. | Waris G, Siddiqui A. Interaction between STAT-3 and HNF-3 leads to the activation of liver-specific hepatitis B virus enhancer 1 function. J Virol. 2002;76:2721-2729. [PubMed] [DOI] |
| 17. | Tu Y, Qi Z, Yang P, Pan Y, Yu S, Du M, Li G. [Transgenic mice model of human hepatitis B virus x gene]. Zhongguo Yixue Kexueyuan Xuebao. 2000;22:263-265. [PubMed] |
| 18. | Raney AK, Eggers CM, Kline EF, Guidotti LG, Pontoglio M, Yaniv M, McLachlan A. Nuclear covalently closed circular viral genomic DNA in the liver of hepatocyte nuclear factor 1 alpha-null hepatitis B virus transgenic mice. J Virol. 2001;75:2900-2911. [PubMed] [DOI] |
| 19. | Bock CT, Kubicka S, Manns MP, Trautwein C. Two control elements in the hepatitis B virus S-promoter are important for full promoter activity mediated by CCAAT-binding factor. Hepatology. 1999;29:1236-1247. [PubMed] [DOI] |
| 20. | Cha JY, Kim H, Kim KS, Hur MW, Ahn Y. Identification of transacting factors responsible for the tissue-specific expression of human glucose transporter type 2 isoform gene. Cooperative role of hepatocyte nuclear factors 1alpha and 3beta. J Biol Chem. 2000;275:18358-18365. [PubMed] [DOI] |
| 21. | Li J, Ou JH. Differential regulation of hepatitis B virus gene expression by the Sp1 transcription factor. J Virol. 2001;75:8400-8406. [PubMed] [DOI] |
| 22. | Reifenberg K, Wilts H, Löhler J, Nusser P, Hanano R, Guidotti LG, Chisari FV, Schlicht HJ. The hepatitis B virus X protein transactivates viral core gene expression in vivo. J Virol. 1999;73:10399-10405. [PubMed] |