修回日期: 2004-09-13
接受日期: 2004-09-19
在线出版日期: 2004-11-15
目的: 构建并鉴定真核表达质粒pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα.
方法: 据GeneBank中大鼠MCP-1和Groα cDNA序列设计并合成引物, 提取急性胰腺炎模型大鼠总RNA, RT-PCR扩增, 并将扩增产物TA克隆至pGEM-T easy载体, 然后分别双酶切pGEM-MCP-1和pGEM-Groα回收目的片段再克隆至真核表达载体pcDNA3.1(+).
结果: pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα真核表达质粒构建完成后, 用限制性内切酶、PCR及DNA序列分析等多种方法进行鉴定, 证实其构建成功.
结论: pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα真核表达质粒构建成功, 为进一步研究该真核表达质粒的免疫保护效果及制备急性胰腺炎pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-GroαDNA疫苗奠定了基础.
引文著录: 任玥欣, 宋于刚, 陈学清, 智发朝, 钟世顺, 南清振, 武金宝, 崔忠林. pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Gro α真核表达质粒的构建及鉴定. 世界华人消化杂志 2004; 12(11): 2623-2626
Revised: September 13, 2004
Accepted: September 19, 2004
Published online: November 15, 2004
AIM: To construct and identify the eukaryotic expression plasmid for rat MCP-1 and Groα.
METHODS: Accoding to the published MCP-1 Groα cDNA sequence in GeneBank, a pair of primers were respectively designed and synthesized. The total RNA was isolated froml rats with acute pancreatitis. After amplification with reverse transcription polymerase chain reaction (RT-PCR), the product was cloned into pGEM-T easy vector using TA cloning followed by Bam HⅠ and Eco RⅠdigestion. The target sequences were then subcloned into a highly efficient eukaryotic expression vector pcDNA3.1(+). The recombinants were finally sequenced and identified by restrictive endonuclease digestion.
RESULTS: pcDNA3.1(+)-MCP-1 and pcDNA3.1(+)-Groα eukaryotic expression vectors were successfully constructed, and they were identified by PCR, double restrictive endonuclease digestion and sequence analysis. The target fragment MCP-1 was the same as AF058786 in GenBank and the fragment Groα was different from NM_030845 (nt92-nt94) in GenBank. Repeated tests confirmed that NM_030845 (nt21-nt23) in GenBank was not correct.
CONCLUSION: The MCP-1 and Groα eukaryotic expression vectors are successfully constructed and identified.
- Citation: Ren YX, Song YG, Chen XQ, Zhi FC, Zhong SS, Nan QZ, Wu JB, Cui ZL. Construction and identification of eukaryotic expression plasmid pcDNA3.1(+)-MCP-1 and pcDNA3.1(+)-Gro α. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2623-2626
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2623.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2623
急性胰腺炎是临床常见病, 重症胰腺炎死亡率可高达17-20%, 其发病机制尚不完全清楚[1-3]. 以往的观点认为, 胰腺炎是一种自身消化性疾病, 是由胰酶激活并自身消化所致. 但近来的研究结果发现, 胰腺腺泡细胞在接受刺激后, 可以分泌大量的炎性因子[4-5]; 急性胰腺炎作为炎症的一种形式, 炎性因子在其发病中可能占居着主导作用[6-11]. 我们用基因芯片技术, 研究了早期急性胰腺炎中的基因变化, 发现实验性大鼠急性胰腺炎早期诱导腺泡细胞高表达某些基因, 其编码翻译产物可被分泌入胰液或细胞间隙. 促炎因子多数在模型制备后2-3 h开始高表达, 但其中单核细胞趋化因子(monocyte chemotactic protein-1, MCP-1)、生长调节致癌基因α(growth-related oncogene α, GRO-α)被快速诱发高表达. 我们构建真核表达质粒pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα的目的, 在于进一步明确MCP-1和GRO-α在急性胰腺炎发病中的作用, 并为研制pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα急性胰腺炎DNA疫苗奠定基础.
大肠杆菌DH5α由本研究所保存. pGEM-T easy载体购自Promega公司, 高效真核表达载体pcDNA3.1(+)为Invitrogen公司产品. MCP-1引物根据基因库AF058786(rattus norvegicus JE/MCP-1 mRNA, complete cds)原始序列, 由nt64-nt607; Groα引物据基因库NM_030845(rattus norvegicus gro)原始序列, 由nt3-nt448; 利用引物设计软件Primer Primier 5.0和Oligo 6.22上游引物设计加入Bam HⅠ限制性酶切位点 , 由上海博亚生物公司合成. 引物序列为MCP-1上游: 5' GGA TCC ACC ACT ATG CAG G 3', 下游: 5'TTC TAG TAT TCA TGG AAG GGA 3'; Groα上游: 5'GGA TCC AGC TCC AGC ACT C 3', 下游: 5'ATA AAT AGG ACC CTC AAT AGA AA 3'.
♂Wistar大鼠18只, 体重200-280 g, 由南方医科大学动物中心提供, 清洁级, 由抽签随机分为3组(n = 6), 即正常对照组、蛙皮素组(C-9026, Sigma)(C组)及牛磺胆酸组(T组). C组: 禁食过夜(>12 h), 超大剂量蛙皮素(10 μg/kg)静脉注射, 注射后1 h、2 h、4 h各以过量的戊巴比妥处死大鼠. T组: 禁食过夜, 常规麻醉, 在无菌操作下开腹, 作上腹正中切口3 cm左右, 找到胃十二指肠交界处, 再向下寻找到胰胆管十二指肠开口处. 在左右肝管汇合处以小动脉夹夹闭以防止向肝脏方向反流, 将4.5号针头平面朝上于胰胆管十二指肠开口处行被膜下穿刺, 并向胰管方向推进约2-3 mm, 用另一血管夹固定针头, 将生理盐水稀释的10 g/L牛磺胆酸(T-4009, Sigma)50 μL缓慢逆行推注至胰管中(>20 s), 使整个胰胆管均匀隆起, 退出针头, 即用手压迫进针处约3-5 min, 3-5 min后去除肝总管动脉夹, 关腹, 并同时开始计时观察. 造模后1 h、3 h分别以过量的戊巴比妥处死大鼠, 取胰腺组织进行组织学分析、水肿评价及总RNA制备. 常规组织学处理, 用PBS(Ph7.4)缓冲的4%多聚甲醛固定、石蜡包埋及HE染色. 常规切片, 光镜观察.
1.2.1 总RNA提取、逆转录及PCR扩增: 用Trizol reagent(Invitrogen, Carlsbad, CA)一步法提取胰腺总RNA, 并用RNeasy spin column(Qiagen Inc., Valencia, CA)进一步纯化总RNA, 并用以此为模板制备MCP-1、Groα片段. RT-PCR简要步骤: 用cDNA合成试剂盒(Superscript Choice System, Invitrogen)、以3'端加有T7RNA启动子的24寡脱氧胸腺嘧啶(oliga(dT))为引物, 总RNA5 μg被逆转录为双链cDNA; 随后分别应用各自相对应引物, 用Pyrobest高保真DNA聚合酶(大连Takara公司)进行PCR反应 (95 ℃ 30 s, 53 ℃ 20 s, 72 ℃ 1.5 min, 30循环), 大量合成第二链: MCP-1、Groα片段. 对PCR反应液进行20 g/L琼脂糖凝胶电泳, 用UVP-GD800凝胶分析仪观察并记录结果, 选择MCP-1、Groα表达较高者切胶回收目的DNA片段.
1.2.2 MCP-1和Groα片段pGEM-T easy载体克隆: 扩增产物取适量回收的 MCP-1, Groα片段与pGEM-T easy载体进行TA克隆, 并转化DH5α, 经氨苄西林及α-互补蓝白斑筛选阳性菌落, 根据pGEM-T easy靠近凸出T端5'上游含EcoRⅠ酶切位点的特性, 用限制性内切酶Bam HⅠ和Eco RⅠ(Promega公司)酶切做初步鉴定, 并将构建好的重组体命名为pGEM-MCP-1和pGEM-Groα, 送上海博亚试剂公司测序.
1.2.3 pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα真核表达载体的构建: 质粒提取、酶切、连接、感受态细胞的制备及转化等常规实验技术按《分子克隆实验指南》相关章节进行. 简要步骤: 先将pGEM-MCP-1和pGEM-Groα重组体用Bam HⅠ和Eco RⅠ限制性内切酶双酶切, 然后切胶回收酶切产物. 再将pcDNA3.1(+)空载体用Bam HⅠ和Eco RⅠ双酶切, 并切胶回收酶切产物. 按照载体和目的基因摩尔比1:6的比例T4连接酶(Promega公司)16 ℃连接过夜, 转化DH5α感受态细菌, 培养观察. 将克隆成功的重组质粒命名为pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα. 随机挑取转化成功菌落, 并抽提质粒进行双酶切鉴定. 将鉴定含有插入目的基因的阳性克隆送上海博亚公司测序鉴定.
给予实验动物高剂量蛙皮素和逆行性牛磺胆酸注射, 导致胰腺组织破坏, 造模后1h内可见腺泡细胞破坏, 3-4 h后更明显, 并可见组织水肿, 这表明两种急性胰腺炎模型均已成功建立.
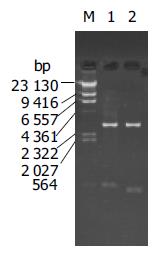
对照DNA相对分子质量标准, 分别扩增出的约544 bp和446 bp, 与预计片段大小相同(图1). PCR产物经纯化回收后与pGEM-T easy载体连接, 转化DH5α挑取阳性菌落, 将质粒纯化后经双酶切鉴定重组体. 紧邻pGEM-T easy载体克隆位点上下游约10 bp处各有一个EcoRⅠ酶切位点, BamHⅠ和EcoRⅠ双酶切pGEM-MCP-1重组体产生3.0 kb及约550 bp DNA片段者为阳性克隆, pGEM-Groα重组体经双酶切后产生3.0 Kb及约450 bp两特异性条带(图2).
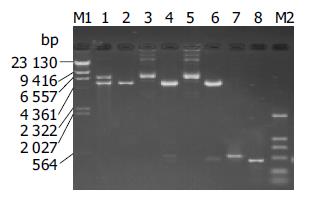
将重组体pGEM-MCP-1和pGEM-Groα双酶切后, 用琼脂糖凝胶电泳胶回收MCP-1片段和Groα, 与同样经Bam HⅠ和EcoRⅠ双酶切真核表达载体pcDNA3.1(+)进行体外连接反应, 并对转化成功后的阳性重组体经BamHⅠ和EcoRⅠ双酶切电泳鉴定, 结果重组体pcDNA3.1(+)-MCP-1产生5.4 kb及550 bp两个特异性条带, 而pcDNA3.1(+)-Groα产生5.4 kb及450 bp两个特异性条带(图3). PCR鉴定以pcDNA3.1(+)-MCP-1为模板, 用MCP-1上下游引物扩增出544 bp的产物, pcDNA3.1(+)-Groα为模板, 用Groα上下游引物扩增出446 bp的产物, 而以pcDNA3.1(+)为模板者未能扩增出相应产物(图3).
真核表达重组质粒pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα经上海博亚生物技术公司测序分析, 目的基因片段MCP-1测序结果与基因库AF058786(Rattus norvegicus JE/MCP-1 mRNA, complete cds)完全一致, 目的基因Groα测序结果与基因库NM_030845(Rattus norvegicus gro)nt92-nt94序列不同, 测得序列为CTG, 而GenBank中序列为TGC, 经重复多次实验及多次测序, 均为此结果, GeneBank中NM_030845 nt21-nt23序列有误.
急性胰腺炎关键的启动因素是腺泡细胞内胰酶活化导致胰腺自身消化[12-14]. 而腺泡细胞接受刺激后可分泌大量的炎性因子并促进炎性细胞浸润, 导致局部炎症反应. 细胞因子及其他化学性炎症递质活化、释出进入血液循环, 形成全身炎症反应. 因此, 炎症递质在胰腺炎及随后的全身炎症反应的发病机制中起重要作用. 我们对实验性急性胰腺炎的基因芯片研究也表明: 趋化因子在腺泡损伤后短时间内即可表达增高, 可能是最早引导白细胞移向胰腺损伤区域的关键刺激, 而不同的趋化因子对不同的白细胞亚群具有趋化和活化效应.
趋化因子是一族小分子(8-10 ku)、可诱导、分泌性的细胞因子, 按结构分为CXC和CC亚族, CXC趋化因子可以进一步分为两组, 一组包含保守的氨基酸序列ELR, 另一组没有此结构单元. 包含ELR结构单元的CXC趋化因子, 包括几种中性粒细胞趋化因子和激活因子, 如GRO-α、IL8和巨噬细胞炎症蛋白2(MIP2), 而缺乏ELR结构单元者很少有中性粒细胞激活活性. CC趋化因子可趋化单核细胞、巨噬细胞、淋巴细胞和树突状细胞, 如单核细胞趋化蛋白1(MCP1), 主要作用于单核细胞. 趋化因子受体属视紫红质超家族, 跨膜与G蛋白耦联, 配受体结合使细胞内钙浓度升高和蛋白激酶C活化.
急性胰腺炎时胰腺局部损伤和由局部损伤到全身炎症反应的发展中, 中性粒细胞起到重要作用. 多篇文献报道: 应用抗中性粒细胞抗体对抗血液循环中的中性粒细胞可减轻实验性急性胰腺炎的胰腺损伤并保护肺部不受损伤[15-17]. 在多种炎症损伤动物模型中, GRO-α可诱导中性粒细胞聚集, 对GRO-α特异性拮抗可减轻炎症反应[18-21]. 因此, GRO-α可能成为急性胰腺炎的治疗靶点.
Grady et al[5]应用mRNA差异显示、Northen bloting分析和免疫荧光等方法在体内、体外实验中均证明: 腺泡细胞表达趋化因子MCP1是急性胰腺炎发病中的早期事件. Brady et al[22]的研究表明, 经给予过量蛙皮素或逆行性胆胰管注射胆盐诱导的大鼠实验性急性胰腺炎中, 造模后1 h即可检测到胰腺组织的GRO-α和MCP1mRNA表达, 表明GRO-α和MCP1是急性胰腺炎中的早期炎症递质. 我们的基因芯片研究也证实了这一点. 因此, 趋化因子GRO- α和MCP1可能成为急性胰腺炎中抗炎治疗的理想靶点. Sckido et al[23]研究表明, 用阻断抗体或受体拮抗剂中和IL-8的作用可以减轻局部和全身炎症反应. DNA疫苗作为一种新型疫苗已引起人们广泛的注意. DNA疫苗在宿主细胞内表达目的抗原, 抗原经与自然感染相似的过程加工、修饰后, 可直接与MHCⅠ类和Ⅱ类分子结合, 引发特异性的细胞免疫和体液免疫. 与传统疫苗相比, DNA疫苗易于构建, 没有减毒病原体可能在体内复制致病的危险, 且可根据分子生物学和免疫学原理改良抗原, 以降低致病性或改变抗原性[24-30]. 我们成功构建了针对大鼠的真核表达质粒pcDNA3.1(+)-MCP-1和pcDNA3.1(+)-Groα. pcDNA3.1(+)质粒含有人类巨细胞病毒(CMV)的高效启动子和增强子, 是一种外源基因在哺乳动物细胞中高效表达及研制DNA疫苗的理想载体. 本研究为进一步明确急性胰腺炎早期分子机制和探索其基因治疗打下了实验基础. 并且我们在实验中意外发现: Genebank中NM_030845 nt21-nt23序列有误.
编辑: N/A
| 1. | Lerch MM, Gorelick FS. Early trypsinogen activation in acute pancreatitis. Med Clin North Am. 2000;84:549-563. [DOI] |
| 2. | Steer LM. Etiology and pathogenesis of acute pancreatitis. Ann Ital Chir. 1995;66:159-163. [PubMed] |
| 3. | Steer ML, Meldolesi J. Pathogenesis of acute pancreatitis. Annu Rev Med. 1988;39:95-105. [PubMed] [DOI] |
| 4. | Bhatia M, Brady M, Kang YK, Costello E, Newton DJ, Christmas SE, Neoptolemos JP, Slavin J. MCP-1 but not CINC synthesis is increased in rat pancreatic acini in response to cerulein hyperstimulation. Am J Physiol Gastrointest Liver Physiol. 2002;282:G77-G85. [PubMed] |
| 5. | Grady T, Liang P, Ernst SA, Logsdon CD. Chemokine gene expression in rat pancreatic acinar cells is an early event associated with acute pancreatitis. Gastroenterology. 1997;113:1966-1975. [DOI] |
| 6. | Vaquero E, Gukovsky I, Zaninovic V, Gukovskaya AS, Pandol SJ. Localized pancreatic NF-kappaB activation and inflammatory response in taurocholate-induced pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1197-G1208. [PubMed] |
| 7. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [DOI] |
| 8. | Cook JW, Karakozis S, Kim D, Provido H, Gongora E, Kirkpatrick JR. Interleukin-10 attenuates proinflammatory cytokine production and improves survival in lethal pancreatitis. Am Surg. 2001;67:237-241; discussion 241-242. [PubMed] |
| 9. | Kim H, Seo JY, Roh KH, Lim JW, Kim KH. Suppression of NF-kappaB activation and cytokine production by N-acetylcysteine in pancreatic acinar cells. Free Radic Biol Med. 2000;29:674-683. [PubMed] [DOI] |
| 10. | Gukovsky I, Gukovskaya AS, Blinman TA, Zaninovic V, Pandol SJ. Early NF-kappaB activation is associated with hormone-induced pancreatitis. Am J Physiol. 1998;275:G1402-G1414. [PubMed] |
| 11. | Satoh A, Shimosegawa T, Fujita M, Kimura K, Masamune A, Koizumi M, Toyota T. Inhibition of nuclear factor-kappaB activation improves the survival of rats with taurocholate pancreatitis. Gut. 1999;44:253-258. [PubMed] [DOI] |
| 12. | Grady T, Mah'Moud M, Otani T, Rhee S, Lerch MM, Gorelick FS. Zymogen proteolysis within the pancreatic acinar cell is associated with cellular injury. Am J Physiol. 1998;275:G1010-G1017. [PubMed] |
| 13. | Raraty M, Ward J, Erdemli G, Vaillant C, Neoptolemos JP, Sutton R, Petersen OH. Calcium-dependent enzyme activation and vacuole formation in the apical granular region of pancreatic acinar cells. Proc Natl Acad Sci USA. 2000;97:13126-13131. [PubMed] [DOI] |
| 14. | Yang BM, Demaine AG, Kingsnorth A. Chemokines MCP-1 and RANTES in isolated rat pancreatic acinar cells treated with CCK and ethanol in vitro. Pancreas. 2000;21:22-31. [PubMed] [DOI] |
| 15. | Krug A, Rothenfusser S, Hornung V, Jahrsdörfer B, Blackwell S, Ballas ZK, Endres S, Krieg AM, Hartmann G. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol. 2001;31:2154-2163. [PubMed] [DOI] |
| 16. | Bhatia M, Saluja AK, Hofbauer B, Lee HS, Frossard JL, Steer ML. The effects of neutrophil depletion on a completely noninvasive model of acute pancreatitis-associated lung injury. Int J Pancreatol. 1998;24:77-83. [PubMed] |
| 17. | Inoue S, Nakao A, Kishimoto W, Murakami H, Itoh K, Itoh T, Harada A, Nonami T, Takagi H. Anti-neutrophil antibody attenuates the severity of acute lung injury in rats with experimental acute pancreatitis. Arch Surg. 1995;130:93-98. [PubMed] [DOI] |
| 18. | Hirasawa N, Watanabe M, Mue S, Watanabe K, Tsurufuji S, Ohuchi K. Induction of neutrophil infiltration by rat chemotactic cytokine (CINC) and its inhibition by dexamethasone in rats. Inflammation. 1992;16:187-196. [PubMed] [DOI] |
| 19. | Yamasawa H, Ishii Y, Kitamura S. Cytokine-induced neutrophil chemoattractant in a rat model of lipopolysaccharide-induced acute lung injury. Inflammation. 1999;23:263-274. [PubMed] |
| 20. | Suzuki H, Suematsu M, Miura S, Liu YY, Watanabe K, Miyasaka M, Tsurufuji S, Tsuchiya M. Rat CINC/gro: a novel mediator for locomotive and secretagogue activation of neutrophils in vivo. J Leukoc Biol. 1994;55:652-657. [PubMed] |
| 21. | Davenpeck KL, Zagorski J, Schleimer RP, Bochner BS. Lipopolysaccharide-induced leukocyte rolling and adhesion in the rat mesenteric microcirculation: regulation by glucocorticoids and role of cytokines. J Immunol. 1998;161:6861-6870. [PubMed] |
| 22. | Brady M, Bhatia M, Zagorski J. CINC and MCP-1expression in early acute pancreatitis (Abstract). Pancreas. 1999;19:416. |
| 23. | Sekido N, Mukaida N, Harada A, Nakanishi I, Watanabe Y, Matsushima K. Prevention of lung reperfusion injury in rabbits by a monoclonal antibody against interleukin-8. Nature. 1993;365:654-657. [PubMed] [DOI] |
| 24. | McDonnell WM, Askari FK. DNA vaccines. N Engl J Med. 1996;334:42-45. [PubMed] [DOI] |
| 25. | 孙 波, 何 苗, 杨 骅, 金 晶, 满 晓华, 龚 燕芳, 屠 振兴, 杜 奕奇, 李 兆申. 携带幽门螺杆菌中性粒细胞激活蛋白活减毒鼠伤寒沙门菌口服重组DNA疫苗株的构建. 世界华人消化杂志. 2004;12:1317-1320. [DOI] |
| 27. | 孙 利, 周 永兴, 郝 春秋, 冯 志华, 赵 君, 胡 沛臻, 付 勇, 马 福成, 常 吉庆, 王 九平. DNA疫苗对小鼠HCV-C皮下移植瘤的防治. 世界华人消化杂志. 2003;11:165-168. [DOI] |