修回日期: 2004-06-10
接受日期: 2004-06-24
在线出版日期: 2004-11-15
目的: 探讨外源性酸性成纤维细胞生长因子(aFGF)对大鼠肠缺血再灌注后小肠绒毛细胞凋亡以及凋亡相关基因bax和bcl-2表达的影响.
方法: 采用肠系膜上动脉(SMA)夹闭45 min后松夹造成缺血再灌注(I/R)损伤的动物模型, 将108只Wistar大鼠随机分成假手术组(C)、肠缺血组(I)、肠缺血-再灌注组(R)和aFGF治疗组(A). 根据缺血后再灌注时间的不同又将R组和A组又分成0.25, 0.5, 1, 2, 6, 12, 24和48 h共8组, 每组6只动物. A组和R组在松开动脉夹的同时, 分别经尾静脉注入20 μg/kg aFGF和生理盐水0.15 mL. 各时相点取小肠组织, 通过末端脱氧核糖转移酶介导的生物素化脱氧尿嘧啶缺刻标记技术(TUNEL)检测细胞凋亡率; 利用免疫组织化学方法检测bax和bcl-2蛋白表达; 用RT-PCR方法测定bax和bcl-2基因的表达水平.
结果: 缺血再灌注后2, 6, 和12 h, A组中大鼠小肠绒毛组织的细胞凋亡率分别为(41.17±3.49%), (42.83±5.23%)和(53.33±6.92%), 显著低于C组中各对应时间点上的细胞凋亡率(P<0.05). I/R后小肠绒毛细胞内bax基因表达逐渐增强, 蛋白含量升高, 而bcl-2基因转录迅速降低, 蛋白含量减少. 在再灌注2-12 h, A组中bcl-2基因转录水平和蛋白含量都较C组增加, 而bax基因的mRNA含量和蛋白水平均较C组降低.
结论: 外源性aFGF能够减轻缺血再灌注对小肠绒毛的损伤, 其机制可能与aFGF促进bcl-2基因转录、抑制bax基因表达相关.
引文著录: 陈伟, 付小兵, 葛世丽, 孙同柱, 赵京禹, 都义日, 盛志勇. 酸性成纤维细胞生长因子对缺血再灌注小肠绒毛细胞内bax和bcl-2表达的影响. 世界华人消化杂志 2004; 12(11): 2599-2604
Revised: June 10, 2004
Accepted: June 24, 2004
Published online: November 15, 2004
AIM: To detect the effects of acid fibroblast growth factor (aFGF) on apoptosis and Bax and bcl-2 expression in rat intestine after I/R injury, and to explore the protective mechanisms of aFGF on intestinal villus.
METHODS: One hundred and eight Wistar rats were randomly divided into 4 groups, namely intestinal ischemia/reperfusion group (R, n = 48), intestinal ischemia group (I, n = 6), aFGF treatment group (A, n = 48) and sham-operated group (C, n = 6). The rats sustained 45 min of arteria mesenterica (SMA) occlusion to establish the ischemia model. At the beginning of reperfusion, rats in group R and A were treated with normal saline (0.15 mL) and aFGF (20 μg/kg, 0.15 mL) respectively. Then each six rats as a sub-group were reperfused for a duration of 0.25, 0.5, 1, 2, 6, 12, 24, 48 h respectively. Cell apoptotic rates in intestinal villus were determined with terminal deoxynucl-eotidy transferase mediated dUTP-biotin nick-end-labeling technique (TUNEL). RT-PCR was used to detect the expressions of bax and bcl-2 gene in intestinal villus. Immunohistochemical methods were adopted to detect bax and bcl-2 protein expressions and distributions.
RESULTS: The improvement of intestinal histological structures was observed at 2 h, 6 h and 12 h after the reperfusion in group A, compared with group R. The apoptotic rates were (41.17±3.49 %), (42.83±5.23 %) and (53.33±6.92 %) at 2, 6, 12 h after reperfusion respectively in group A, and these rates were significantly lower than those in group R (P < 0.05). The expressions of bax gene and bax protein in intestinal villus were gradually increased after ischemia/reperfusion, while the transcription of bcl-2 gene and expression of bcl-2 protein were decreased. During the 2-12 h of reperfusion, the transcription of bcl-2 gene and expression of bcl-2 protein were significantly increased in group A compared with those in group R (P < 0.05). However, the expressions of bax gene and bax protein were significantly higher than those in group R (P < 0.05).
CONCLUSION: Intravenous aFGF could alleviate I/R-induced injury, in which its effects on the facilitation of bcl-2 transcription and inhibition of bax expression may play an important role.
- Citation: Chen W, Fu XB, Ge SL, Sun TZ, Zhao JY, Du YR, Sheng ZY. Effects of extrogenous aFGF on bax and bcl-2 expression in intestinal cells after ischemia/reperfusion. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2599-2604
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2599.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2599
在腹部外伤、失血性休克、严重创伤、感染、烧伤等病理状态下, 常出现肠道缺血再灌注损伤和功能障碍, 肠屏障功能降低, 肠内细菌和毒素通过受损肠黏膜进入体循环, 激活网状内皮系统, 引起大量炎症递质和细胞因子释放, 造成全身炎症反应综合征和多器官功能衰竭的发生. 因此采取有效措施减轻外界胁迫作用对肠道损害有着至关重要的作用. 近年来研究发现, 外源性酸性成纤维因子(aFGF)可减轻心、肾、骨骼肌等的缺血再灌注损伤引起的细胞凋亡发生[1-2]. 细胞凋亡是由凋亡相关基因编码的蛋白调节控制, 其中bcl-2家族成员起着十分重要的作用[3-7]. 为此, 我们以大鼠肠I/R损伤为模型, 给予静脉注射外源性aFGF, 观察小肠组织细胞凋亡的变化规律及其可能的调节机制, 为临床应用aFGF促进肠道损伤的修复提供理论依据.
健康Wister大鼠(军事医学科学院动物中心)108只, 体质量220±20 g, 随机分为假手术组(C, n = 6), 单纯缺血组(I, n = 6), 肠I/R组(R, n = 48)和aFGF治疗组(A, n = 48). 根据缺血再灌注时间不同(15 min, 30 min, 1, 2, 6, 12, 24和48 h), 将R组和A组又分成R15 min, R30 min, R1, R2, R6, R12, R24, R48 h和A15 min, A30 min, A1, A2, A6, A12, A24, A48 h, 共16组, 每组6只. 采用肠系膜上动脉(SMA)夹闭45 min后松夹, 复制肠道缺血再灌注模型. 经腹腔注射戊巴比妥钠麻醉后, 分离SMA根部. C组仅分离SMA根部但不夹闭, 其余各组动物在肠系膜上动脉根部用微血管夹夹闭, 完全阻断血流45 min, 然后松夹形成再灌注. R组和A组分别于SMA夹闭45 min松夹, 即刻从尾静脉注射生理盐水(0.15 mL)或aFGF(20 μg/kg, 0.15 mL). 按设定时间点活杀动物. 在无菌的条件下, 取距离回盲部上端10 cm以上的肠管, 一部分立即液氮冻存, 用于进行逆转录-多聚酶链反应(RT-PCR); 另一部分标本经40 g/L中性甲醛液固定, 脱水, 石蜡包埋后切片, 4 ℃保存待用.
1.2.1 细胞凋亡检测: 将石蜡切片(厚5 μm)脱蜡, 梯度乙醇脱水, 甩干后用蛋白酶K在37 ℃条件下孵育30 min, 然后用PBS冲洗2次, 加50 μL末端脱氧核糖转移酶介导的生物素化脱氧尿嘧啶缺口标记技术(TUNEL)的反应液(德国Boehringer Mannheim公司产品), 37 ℃孵育60 min. 在用PBS冲洗3次后加50 μL亲和素辣根过氧化物酶, 37 ℃湿盒放置30 min, PBS冲洗3次, 最后用DAB显色15 min, 苏木素复染并系列脱水封片. 在400倍光镜下观察, 细胞核中有棕色颗粒者为阳性细胞.
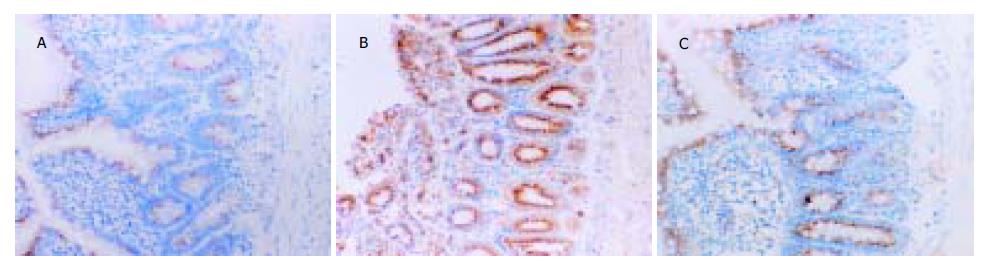
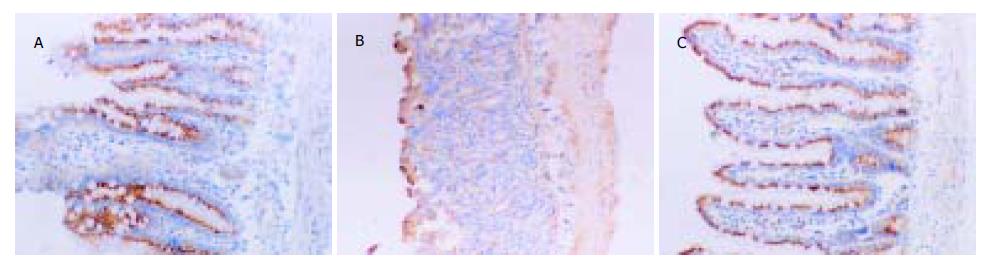
1.2.2 小肠组织中bax和bcl-2蛋白含量的检测: 采用免疫组织化学SP法. bax(SC-7480)、bcl-2(SC-7382)的抗体和SP试剂盒均购自Santa Cruz公司. 实验操作按试剂盒说明书进行, 将石蜡切片脱蜡至水并进行抗原热修复后, 系列染色, 其中一抗用抗体稀释液按1:100稀释. 光镜观察, 结果以胞质或/和胞核着棕色者为阳性染色. 另用PBS代替一抗为阴性对照. 随机选取60个小肠绒毛组织, 计数阳性染色细胞数, 并计算阳性细胞率.
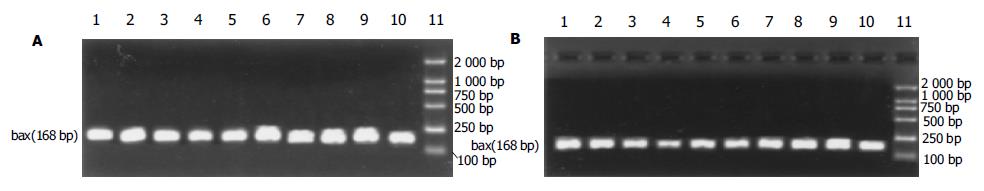
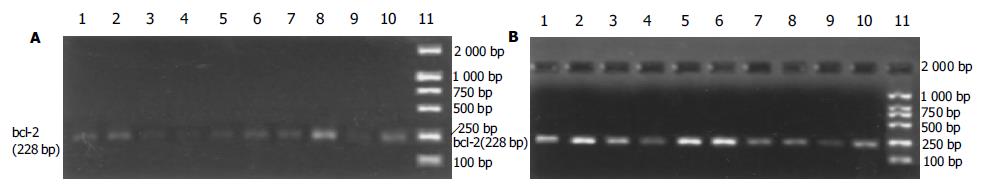
1.2.3 bax和bcl-2基因转录的检测: 提取C组、I组、R组和A组的小肠组织细胞的总RNA, 用紫外分光分析和凝胶电泳检测所提取总RNA的质量和浓度. 按照PolyATtract mRNA Isolation System系统分离纯化mRNA, 紫外分光分析其纯度. 采用RT-PCR方法. 每份样品取等量mRNA, 用Promega公司的逆转录试剂盒(A3500), 按说明书进行cDNA的合成. 根据人bax, bcl-2和β-actin基因的cDNA序列, 按照引物设计原则设计引物, 引物序列(见表1). PCR的条件为: 变性: 94 ℃, 3 min扩增: 94 ℃ (30 s), 60 ℃ (30 s), 72℃ (30 s); 延伸: 72 ℃, 10 min. 每个基因进行32个循环. 所有样品取等量的模板进行PCR扩增. 取PCR产物5 μL, 在15 g/L琼脂糖中电泳后紫外光下扫描; 用凝胶图像分析系统(UVP-GDS800, 英国)对目的基因的表达产物进行灰密度测定. 基因表达量是以目的基因与β-actin基因的灰密度值的比值表示.
| 基因 | 上游引物 | 下游引物 |
| bax | 5'-AGGTCTTTTTCCGAGTGGCAGC-3' | 5'-CCCGGAGGAAGTCCAATGTCC-3' |
| bcl-2 | 5'-GACTTCGCCGAGATGTCCAG-3' | 5'-GTGCAGGTGCCGGTTCAGG-3' |
| β-actin | 5'-AGCCATGTACGTAGCCATCC-3' | 5'-GCCATCTCTTGCTCGAAGTC-3' |
统计学处理 借助SPSS11.0软件对结果进行统计学处理, 各组数据均以平均值±标准差(mean±SD, n = 6)表示. 阳性率资料组间采用ANOVA方差分析和SNK多重比较检测.
小肠组织在缺血再灌注后早期病变较轻, 表现为黏膜和黏膜下层充血、水肿, 固有层多量中性粒细胞浸润, 少数可见黏膜上皮脱落. 在缺血再灌注后6-12 h, 黏膜大片糜烂, 固有层有大量淋巴细胞、巨噬细胞及中性粒细胞浸润. 再灌注后24 h小肠黏膜结构基本恢复到正常黏膜结构. aFGF治疗后, 小肠黏膜充血、水肿、炎性细胞及上皮糜烂坏死的程度在各时间点均较R组显著改善, 以再灌注后2和6 h最为明显.
大鼠缺血再灌注后, 小肠组织中细胞凋亡率逐渐升高. 再灌注后1 h, 细胞凋亡率明显高于假手术组; 缺血再灌注后12 h, 小肠绒毛细胞凋亡率升至最高, 是C组的3.3倍, 此后, 细胞凋亡率恢复到C组水平. aFGF治疗后, 缺血再灌注的小肠组织中的阳性细胞率虽也呈升高趋势, 但增加幅度均低于R组. 在缺血再灌注后2-12 h, A组中的细胞凋亡率明显低于R组中相应的时间点(P<0.05), 再灌注后24 h, 小肠绒毛细胞的细胞凋亡率与R组相比差异不显著(表2).
在正常大鼠的小肠绒毛中bax蛋白主要分布于小肠绒毛顶端细胞的细胞质中. 缺血和再灌注的初期, bax蛋白的表达未发生明显改变, 随着再灌注时间的延长, bax蛋白的表达水平逐渐升高, 并且在小肠绒毛的各层细胞内都有该蛋白的阳性表达颗粒. 缺血再灌注后2-12 h, bax蛋白的阳性细胞率显著高于C组, 再灌注后24 h, bax蛋白的阳性细胞率又降低至C组水平. aFGF治疗后, 再灌注后2-12 h期间, 小肠绒毛组织细胞中的bax阳性细胞率明显低于R组(P<0.05, 表3, 图1). C组大鼠小肠绒毛上皮细胞表达较多的bcl-2蛋白, 该蛋白主要分布于隐窝和绒毛黏膜细胞的胞质和胞核内. 缺血和再灌注的初期, bcl-2蛋白的阳性细胞率未发生明显改变, 随着再灌注时间的延长逐渐增强, 该蛋白阳性细胞率逐渐降低. 在缺血再灌注后1 h, 阳性细胞率明显低于C组(P<0.05), 缺血再灌注后24 h, 阳性表达率又恢复到C组水平. aFGF治疗组较R相应时间点bcl-2表达水平增加, 在缺血再灌注后2-12 h期间, bcl-2蛋白在A组中的阳性细胞率都显著高于R组中各相应的时间点(P<0.05)(表3, 图2).
| 分组 | bax | bcl-2 | ||
| R组 | A组 | R组 | A组 | |
| C组 | 19.8±3.7 | 19.8±3.7 | 35.3±4.6 | 35.3±4.6 |
| I组 | 23.8±7.7 | 23.8±7.7 | 28.2±4.1 | 28.2±4.1 |
| 再灌注后15 min | 25.0±5.9 | 19.8±5.3 | 29.8±6.1 | 31.2±5.0 |
| 再灌注后30 min | 28.0±9.2 | 20.3±4.8 | 28.8±5.9 | 30.2±6.0 |
| 再灌注后1 h | 37.8±4.8a | 24.2±4.5c | 24.5±6.2a | 26.0±5.1a |
| 再灌注后2 h | 47.7±7.3a | 37.5±7.0ac | 20.7±7.2a | 29.7±4.8c |
| 再灌注后6 h | 54.7±5.3a | 47.0±3.5ac | 18.8±5.4a | 27.8±2.7c |
| 再灌注后12 h | 46.3±4.3a | 37.7±3.8ac | 19.5±4.4a | 25.7±4.0ac |
| 再灌注后24 h | 29.0±4.4 | 25.0±4.3 | 28.7±2.9 | 29.3±6.0 |
| 再灌注后48 h | 26.2±3.5 | 22.8±3.2 | 29.0±3.7 | 30.5±4.9 |
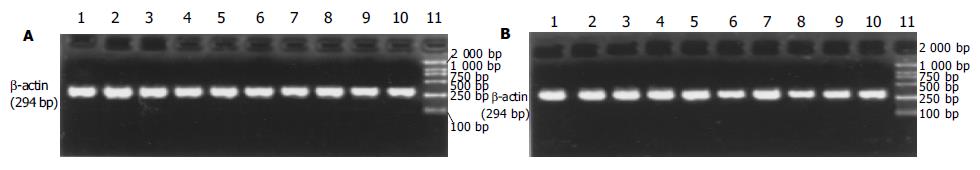
bax和bcl-2基因的mRNA经RT-PCR扩增后, 得到特异性的DNA片段长度分别为168 bp和228 bp(图3, 4). 如表4所示, 缺血和再灌注可导致小肠绒毛细胞内bax基因转录迅速增加, 在再灌注后1 h达到高峰, 然后降低到与C组相近的水平. aFGF治疗后, 缺血再灌注的小肠组织细胞内bax基因转录量都低于R组, 其中在再灌注后15 min, 1, 2和6 h呈显著性差异变化(P<0.05, 图3). 不同处理的小肠组织细胞内bcl-2基因转录的变化规律与bax基因不同. 缺血和再灌注可导致bcl-2基因转录水平显著低于C组(P<0.05). aFGF治疗的大鼠小肠组织细胞内, 在缺血再灌注15 min后, bcl-2基因转录就明显低于C组, 并且这一变化趋势直至再灌注后6 h; 在再灌注后12-48 h期间, 小肠组织细胞中bcl-2基因的mRNA含量恢复至C组水平. 除再灌注后15 min时间点外, 在其他再灌注各时间点上, aFGF治疗组中小肠组织内bcl-2基因表达水平都显著高于R组中各相应的时间点(P<0.05, 表4, 图4). 在不同处理的小肠绒毛中, 作为内参的b-actin基因都有表达, 并且表达量没有显著性差异(P>0.05, 图5).
| 分组 | bax | bcl-2 | ||
| R组 | A组 | R组 | A组 | |
| C组 | 81.0±8.1 | 85.7±7.5 | 24.6±3.2 | 27.8±3.3 |
| I组 | 106.0±8.9a | 97.8±9.6a | 11.2±2.8a | 10.7±3.5a |
| 再灌注后15 min | 93.9±3.3a | 83.9±6.7c | 23.1±4.6 | 20.5±5.0a |
| 再灌注后30 min | 94.1±4.6a | 94.3±3.7 | 12.9±3.1a | 18.0±1.7ac |
| 再灌注后1 h | 108.4±12.7a | 76.1±6.3c | 11.8±3.2a | 20.5±2.2ac |
| 再灌注后2 h | 90.2±6.6 | 76.7±6.2c | 9.1±2.2a | 20.7±1.5ac |
| 再灌注后6 h | 85.8±6.0 | 62.4±3.5ac | 6.5±2.5a | 15.5±1.8ac |
| 再灌注后12 h | 87.0±6.3 | 80.2±6.8 | 7.9±2.1a | 27.3±3.6c |
| 再灌注后24 h | 85.2±9.1 | 90.5±5.1 | 15.9±2.4a | 30.4±2.3c |
| 再灌注后48 h | 86.7±7.3 | 94.8±14.4 | 14.8±3.3a | 23.9±2.7c |
小肠绒毛组织对缺血再灌注的作用十分敏感, 小肠I/R损伤可能会导致细菌和毒素通过肠道屏障进入机体血液, 改变小肠组织中炎症因子、细胞因子和生长因子的浓度, 导致肠绒毛细胞凋亡的增加[8-13]. 我们发现, 缺血再灌注能够导致小肠绒毛细胞凋亡增加, 发生凋亡的细胞位置从正常小肠绒毛顶端扩展到整个小肠绒毛组织; aFGF能够减少缺血再灌注后小肠上皮细胞的凋亡率, 小肠绒毛结构明显改善. aFGF抑制缺血再灌注后小肠上皮细胞凋亡的机制是什么, 成为人们所关注的热点. 以往的研究结果表明, 凋亡相关基因表达的变化可能在缺血再灌注影响心肌细胞[14]、脑组织细胞[15]、骨骼肌细胞[16]、皮肤细胞[17]和肾上腺皮质细胞[18]的细胞凋亡过程中起重要的作用. 为此本研究探讨了aFGF治疗后, 缺血再灌注小肠绒毛细胞内凋亡相关蛋白bax和bcl-2表达的变化规律, 以期揭示aFGF抗凋亡的机制.
细胞凋亡可能由凋亡相关基因编码的蛋白调节控制, 是多种促进因素和抑制因素共同作用的结果. bcl-2家族成员是细胞凋亡过程中的一类调节因子, 该基因家族包含两类功能相反的基因, 一类是抑制细胞凋亡的基因如bcl-2基因, 另一类为包含bax等基因在内的促进细胞凋亡的基因[19-21]. bcl-2基因的表达产物广泛分布于线粒体、内质网膜和核膜上. bax蛋白是一种可溶性分子, 主要位于细胞质中, 与bcl-2具有同源性. bcl-2和bax都能以同源二聚体形式存在, 他们之间也可形成异二聚体. 当外界信号引起细胞凋亡时, bax转移到线粒体并与线粒体膜相结合, 两个bax蛋白相互聚合形成同二聚体, 作为细胞色素C通过线粒体膜进入胞质的通道, 促进细胞凋亡. 当bcl-2基因表达增强, 细胞内bcl-2蛋白含量升高时, 越来越多的bax-bax二聚体相互分开, 与bcl-2形成比bax-bax更稳定的bax-bcl-2异二聚体, 从而抑制bax的促凋亡作用[22-27]. 我们发现, 从缺血再灌注30 min开始, 导致小肠组织细胞凋亡率就明显升高, 再灌注12 h后, 细胞凋亡率升至最高, 而aFGF治疗后, 大鼠小肠组织细胞凋亡率明显减少, 小肠组织结构显著改善; 另外本研究结果还显示, 缺血再灌注导致bax基因表达迅速增强, 蛋白含量的变化规律与细胞凋亡的规律相似, 在缺血再灌注2-12 h期间显著高于假手术组, 而aFGF治疗则导致小肠组织中bax基因表达和蛋白含量显著降低; 缺血再灌注导致bcl-2基因表达和蛋白含量明显降低, 而aFGF则抑制bcl-2基因和蛋白表达水平降低. 这提示, bcl-2/bax比例降低可能是缺血再灌注导致小肠组织细胞凋亡率增加的机制之一, 而aFGF治疗后, bcl-2/bax蛋白比例升高, 可能是aFGF抑制细胞趋向凋亡, 减轻缺血再灌注对肠道损伤的机制. 另外, 我们还发现, 缺血再灌注30 min后, 小肠绒毛细胞凋亡率开始升高, 再灌注24 h后, 细胞凋亡率恢复到假手术组水平. 这一变化的原因可能是由于在缺血再灌注初期, 凋亡促进基因, 如bax基因表达增强, 蛋白含量升高, 而凋亡抑制蛋白, 如bcl-2表达降低. 随着再灌注时间的延长, 机体通过自身调控和主动修复, 凋亡促进基因和凋亡抑制基因的转录水平恢复到正常, 抑制小肠绒毛细胞凋亡的发生, 减弱缺血再灌注对机体的损伤, 但此时大鼠的生命体征较差, 精神萎靡, 食欲不振; 而aFGF处理后, 但经过长时间的缺血再灌注, 大鼠的生命体征明显好于R组, 存活率也显著提高. 另外本研究还发现, 在缺血再灌注初期即再灌注30 min, 小肠绒毛细胞的凋亡率和bax基因转录水平都显著升高, 而aFGF处理后这两种指标与对照组相比无明显增多. 这提示在机体损伤后, 应及时利用aFGF进行治疗, 减轻外界胁迫作用对小肠绒毛细胞的损伤.
总之, 使用外源性aFGF能够减轻缺血再灌注对大鼠小肠绒毛组织的损伤, 其原因可能是由于aFGF通过影响凋亡相关基因, 如bax和bcl-2基因转录和蛋白表达, 抑制缺血再灌注引起的细胞凋亡增加, 保护肠屏障免受损伤和破坏. 由于aFGF具有多种生物功能, 本研究只是从两种凋亡调控蛋白的表达水平变化的一个侧面探索aFGF治疗缺血再灌注的调控机制, 但尚有许多问题需进一步研究, 例如aFGF是怎样调控bcl-2和bax等基因表达; 与细胞凋亡密切相关的几种重要的生长因子与上述基因调节网络的关系; 其他与细胞凋亡相关的基因是否参与调控小肠绒毛的细胞凋亡等方面都有待进一步探讨.
编辑: N/A
| 1. | Cuevas P, Carceller F, Martinez-Coso V, Asin-Cardiel E, Giménez-Gallego G. Fibroblast growth factor cardioprotection against ischemia-reperfusion injury may involve K+ ATP channels. Eur J Med Res. 2000;5:145-149. [PubMed] |
| 2. | Fu XB, Cuevas P, Gimenez-Gallego G, Sheng ZY, Tian HM. Acidic fibroblast growth factor reduces rat skeletal muscle damage caused by ischemia and reperfusion. Chin Med J. 1995;108:209-214. |
| 3. | Srinivasan A, Li F, Wong A, Kodandapani L, Smidt R Jr, Krebs JF, Fritz LC, Wu JC, Tomaselli KJ. Bcl-xL functions downstream of caspase-8 to inhibit Fas- and tumor necrosis factor receptor 1-induced apoptosis of MCF7 breast carcinoma cells. J Biol Chem. 1998;273:4523-4529. [PubMed] [DOI] |
| 4. | Mills JC, Lee VM, Pittman RN. Activation of a PP2A-like phosphatase and dephosphorylation of tau protein characterize onset of the execution phase of apoptosis. J Cell Sci. 1998;111:625-636. [PubMed] |
| 5. | Noda T, Iwakiri R, Fujimoto K, Matsuo S, Aw TY. Programmed cell death induced by ischemia-reperfusion in rat intestinal mucosa. Am J Physiol. 1998;274:G270-G276. [PubMed] |
| 6. | Cory S, Huang DC, Adams JM. The Bcl-2 family: roles in cell survival and oncogenesis. Oncogene. 2003;22:8590-8607. [PubMed] [DOI] |
| 7. | Rossé T, Olivier R, Monney L, Rager M, Conus S, Fellay I, Jansen B, Borner C. Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature. 1998;391:496-499. [PubMed] [DOI] |
| 8. | Fu XB, Xing F, Yang YH, Sun TZ, Guo BC. Activation of phosphorylating-p38 mitogen-activated protein kinase and its relationship with localization of intestinal stem cells in rats after ischemia-reperfusion injury. World J Gastroenterol. 2003;9:2036-2039. [PubMed] [DOI] |
| 9. | Fu XB, Yang YH, Sun TZ, Chen W, Li JY, Sheng ZY. Rapid mitogen-activated protein kinase by basic fibroblast growth factor in rat intestine after ischemia/reperfusion injury. World J Gastroenterol. 2003;9:1312-1317. [PubMed] [DOI] |
| 10. | Wang XJ, Wei JG, Wang CM, Wang YC, Wu QZ, Xu JK, Yang XX. Effect of cholesterol liposomes on calcium mobilization in muscle cells from the rabbit sphincter of Oddi. World J Gastroenterol. 2002;8:144-149. [PubMed] [DOI] |
| 11. | Yin ZY, Ni XD, Jiang F, Li N, Li YS, Wang XM, Li JS. Auxiliary en-bloc liver-small bowel transplantation with partial pancreas preservation in pigs. World J Gastroenterol. 2004;10:1499-1503. [PubMed] [DOI] |
| 14. | Chang TH, Liu XY, Zhang XH, Wang HL. Effects of dl-praeruptorin A on interleukin-6 level and Fas, bax, bcl-2 protein expression in ischemia-reperfusion myocardium. Acta Pharmacol Sin. 2002;23:769-774. [PubMed] |
| 15. | Zhou H, Ma Y, Zhou Y, Liu Z, Wang K, Chen G. Effects of magnesium sulfate on neuron apoptosis and expression of caspase-3, bax and bcl-2 after cerebral ischemia-reperfusion injury. Chin Med J (Engl). 2003;116:1532-1534. [PubMed] |
| 16. | Hatoko M, Tanaka A, Kuwahara M, Yurugi S, Iioka H, Niitsuma K. Difference of molecular response to ischemia-reperfusion of rat skeletal muscle as a function of ischemic time: study of the expression of p53, p21(WAF-1), Bax protein, and apoptosis. Ann Plast Surg. 2002;48:68-74. [PubMed] [DOI] |
| 17. | Hatoko M, Tanaka A, Kuwahara M, Yurugi S. Molecular response to ischemia-reperfusion of rat skin: study of expression of p53, p21WAF-1, and Bax proteins, and apoptosis. Ann Plast Surg. 2001;47:425-430. [PubMed] [DOI] |
| 18. | Baskin DS, Ngo H, Didenko VV. Thimerosal induces DNA breaks, caspase-3 activation, membrane damage, and cell death in cultured human neurons and fibroblasts. Toxicol Sci. 2003;74:361-368. [PubMed] [DOI] |
| 19. | Deng W, Wang DA, Gosmanova E, Johnson LR, Tigyi G. LPA protects intestinal epithelial cells from apoptosis by inhibiting the mitochondrial pathway. Am J Physiol Gastrointest Liver Physiol. 2003;284:G821-G829. [PubMed] [DOI] |
| 22. | Chang YC, Xu YH. Expression of Bcl-2 inhibited Fas-mediated apoptosis in human hepatocellular carcinoma BEL-7404 cells. Cell Res. 2000;10:233-242. [PubMed] [DOI] |
| 23. | Guo BC, Xu YH. Bcl-2 over-expression and activation of protein kinase C suppress the trail-induced apoptosis in Jurkat T cells. Cell Res. 2001;11:101-106. [PubMed] [DOI] |
| 24. | Foyouzi-Youssefi R, Arnaudeau S, Borner C, Kelley WL, Tschopp J, Lew DP, Demaurex N, Krause KH. Bcl-2 decreases the free Ca2+ concentration within the endoplasmic reticulum. Proc Natl Acad Sci USA. 2000;97:5723-5728. [PubMed] [DOI] |
| 25. | Zhang M, Zhang HQ, Xue SB. Effect of Bcl-2 and caspase-3 on calcium distribution in apoptosis of HL-60 cells. Cell Res. 2000;10:213-220. [PubMed] [DOI] |
| 26. | Gross A, Pilcher K, Blachly-Dyson E, Basso E, Jockel J, Bassik MC, Korsmeyer SJ, Forte M. Biochemical and genetic analysis of the mitochondrial response of yeast to BAX and BCL-X(L). Mol Cell Biol. 2000;20:3125-3136. [PubMed] [DOI] |
| 27. | Cui J, Engelman RM, Maulik N, Das DK. Role of ceramide in ischemic preconditioning. J Am Coll Surg. 2004;198:770-777. [PubMed] [DOI] |