修回日期: 2004-08-10
接受日期: 2004-08-20
在线出版日期: 2004-11-15
目的: 探讨CpG-ODN活化的人外周血单个核细胞(PBMC)体外对HBV复制和表达的抑制作用.
方法: CpG-ODN体外刺激PBMC, ELISA测培养液IFN-α及IFN-γ的分泌; 将CpG-ODN介导活化的PBMC与HepG2.2.15细胞按一定比例共孵育1 d、2 d和3 d后, ELISA检测培养上清液中HBsAg、HBeAg的分泌, 荧光定量PCR检测HepG2.2.15细胞内HBV DNA和HBV mRNA的含量; 并以MTT和酶学检测活化的PBMC对HepG2.2.15细胞的杀伤作用.
结果: CpG-ODN有效诱导PBMC分泌IFN-α和IFN-γ; CpG-ODN本身虽不能直接抑制HBV的复制, 但由CpG-ODN介导活化的PBMC却能显著减少HepG2.2.15细胞对HBsAg、HBeAg的分泌, 同时对HBV DNA和HBV mRNA的抑制作用亦明显增强; CpG-ODN介导活化的PBMC对HepG2.2.15的杀伤作用增强.
结论: CpG-ODN可通过活化机体免疫细胞, 而具有明显的抗HBV复制和表达作用.
引文著录: 李宁, 范学工, 陈朝晖, 朱才, 刘洪波. CpG-ODN介导活化的人免疫细胞体外抗乙型肝炎病毒作用. 世界华人消化杂志 2004; 12(11): 2585-2589
Revised: August 10, 2004
Accepted: August 20, 2004
Published online: November 15, 2004
AIM: To investigate the inhibitory effect of peripheral blood mononuclear cells (PBMCs) activated by synthetic oligodeoxynucleotides (ODN) containing unmethylated CpG dinucleotides (CpG-ODN) on hepatitis B virus (HBV) in vitro.
METHODS: CpG-ODN was co-cultured with PBMCs. The IFN-α and IFN-γ in the supernatant were measured by ELISA. PBMCs activated by CpG-ODN were added to HBV transfected HepG2.2.15 cells After 1, 2 and 3 days, HBsAg and HBeAg in the supernatant were measured by ELISA; HBV DNA and HBV mRNA in HepG2.2.15 cells were detected by fluorogenic quantitative PCR method. MTT method and enzyme assays were used to detect PBMC-mediated lytic activity against HepG2.2.15 cells.
RESULTS: CpG-ODN induced high amounts of IFN-α as well as IFN-γ production (382.69±136.62, 37.42±6.55). Though CpG-ODN was unable to inhibit HBV replication directly, PMBC activated by CpG-ODN significantly reduced HBsAg and HBeAg secretion of HepG2.2.15 cells with rates of 82.6% and 52.4% at 72 h respectively (P < 0.05). The remarkable inhibitory effects of PMBC activated by CpG-ODN on HBV DNA (21.5%) and HBV mRNA (81.3%) in HepG2.2.15 cells were also observed (P < 0.05, P < 0.01).
CONCLUSION: PMBC activated by CpG-ODN can indirectly inhibit HBV replication and expression in vitro.
- Citation: Li N, Fan XG, Chen ZH, Zu C, Liu HB. Anti-hepatitis B virus effects of human peripheral blood mononuclear cells activated by CpG-ODN. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2585-2589
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2585
近年来研究发现, 细菌DNA包含有非甲基化CpG基序组成的免疫刺激序列, 在体内外可发挥免疫刺激效应, 而包含有一个或多个CpG基序的人工合成的寡核苷酸链(CpG-ODN)[1-2]也具有相似的免疫刺激功能[3-6]. 已有较多的研究表明, CpG-ODN作为免疫刺激剂, 通过激活免疫系统, 使小鼠获得对多种细菌和病毒, 如幽门螺杆菌[7]、疟原虫[8]、利什曼原虫[9]和2型单纯疱疹病毒(HSV-2)[10-11]等感染的保护性免疫. 但目前尚没有CpG-ODN抗乙型肝炎病毒(HBV)的研究报道. 为此, 我们以能表达HBV多种产物并分泌HBV颗粒的HepG2.2.15细胞[12-14] (简称2.2.15细胞)为模型[15-18], 观察了CpG-ODN介导活化的免疫细胞体外抑制HBV作用, 并对其可能的机制进行了初步的探讨.
淋巴细胞分离液购自上海生化二厂; 2.2.15细胞由本室引进并保存; 人IFN-α和IFN-γELISA试剂盒购自武汉博士德公司; HBsAg, HBeAg定量检测试剂盒购自苏州新波生物技术有限公司; HBV DNA荧光定量PCR试剂盒购自上海申友生物技术有限公司; MTT为Serva公司产品; 新鲜健康人血由本院输血科提供; 时间分辨荧光测定仪为WALLAC公司产品; 荧光定量PCR仪为美国BIORAD公司产品. CpG-ODN(ODN 2216)序列参见文献[19], 对照序列(ODN 2243)是将ODN 2216中的CpG替换成GpC.两序列均由上海生物工程公司合成, 高效液相色谱(HPLC)纯化, 溶于生理盐水(NS).
CpG-ODN对外周血单个核细胞(PBMC)的活化. 在无菌条件下取12名健康人外周血, 肝素抗凝, 淋巴细胞分离液常规分离PBMC, 调细胞浓度为5×109/L, 接种24孔板, 每孔1 mL. 实验分三组: A组为PBMC; B组为PBMC+ODN 2243; C组为PBMC+ODN 2216. ODN终浓度均为6 mg/L, 细胞置37 ℃, 50 mL/L CO2条件下培养2 d, 收集上清, 分装并-70 ℃保存. 收集PBMC上清液, 按试剂盒说明对IFN-α及IFN-γ含量进行ELISA检测.
1.2.1 活化的免疫细胞对2.2.15细胞分泌HBsAg和HBeAg的抑制作用: 实验分5组: 2.2.15细胞组; 2.2.15+ODN 2216组; 2.2.15+PBMC组; 2.2.15+PBMC+ODN 2243组; 2.2.15+PBMC+ODN 2216组. 2.2.15细胞以1×105/孔接种24孔板, 常规培养过夜后, 按1:50比例每孔加入新鲜分离的健康人PBMC 5×106个, 同时分别加入ODN使其终浓度均为6 mg/L.细胞置37 ℃, 50 mL/L CO2条件下培养24、48和72 h, 分别收集培养上清及细胞. 不同时间段的各组细胞培养上清HBsAg和HBeAg含量的检测采用双抗体夹心时间分辨免疫荧光分析法(time-resolved immunofluorometric assay)[20], 具体方法见说明书. HBsAg结果采用μg/L表示, 浓度值≥0.2 μg/L的样品为阳性, 否则为阴性. HBeAg结果采用NCU/L(national centr clinical laboratory unite, NCU)表示, 浓度值≥30 NCU/L的样品判断为阳性, 否则为阴性.按下式计算HBV抗原表达的抑制率: 抑制率=(对照孔浓度-实验孔浓度)÷对照孔浓度×100%.
1.2.2 荧光定量PCR检测2.2.15细胞内HBV DNA和HBV mRNA: 上述5组细胞分别培养24, 48和72 h后, 提取2.2.15细胞内HBV DNA和HBV RNA, 操作按说明书. 以荧光染料掺入法定量检测2.2.15细胞内HBV DNA和HBV RNA. 细胞内HBV DNA的检测采用直接PCR, 细胞内HBV mRNA定量参见文献[21]. 先按常规方法将mRNA逆转录成cDNA, 然后取cDNA2 μL用于PCR定量扩增, 具体方法见说明书, 最低检测限度为106拷贝/L. 按下式计算HBV DNA分泌的抑制率: 抑制率 = (对照孔拷贝数log值-实验孔拷贝数log值)÷对照孔拷贝数log值×100%.
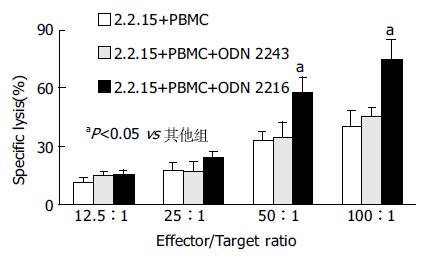
1.2.3 CpG-ODN介导活化的免疫细胞对2.2.15细胞的杀伤作用: 常规培养2.2.15, 调整细胞密度, 取5×103细胞/孔加入96孔板. 以新鲜分离的PBMC为效应细胞, 在每孔中加入不同数量的PBMC, 使其与2.2.15细胞比例分别为12.5:1, 25:1, 50:1和100:1, 将每孔总体积定容到200 μL, 同时分别加入ODN使其终浓度为6 mg/L. 实验设3个复孔, 效应细胞对照孔加入100 μL完全培基. 细胞于37 ℃, 50 mL/L CO2培养箱孵育3 d, 加入5 g/L MTT20 μL继续培养5 h, 离心培养板(2 000 r/min, 10 min), 弃上清, 每孔加DMSO 150 μL, 于570nm处测定A值. 相同实验均重复3次. 根据以下公式计算各组细胞的杀伤活性: 杀伤活性=[1-(实验孔A均值-效应细胞对照孔A均值)/靶细胞对照孔A均值]×100%.
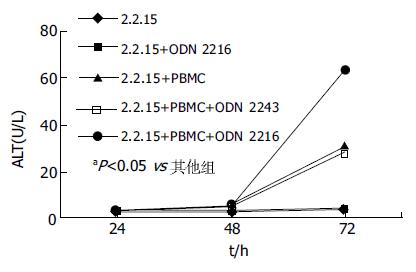
1.2.3 酶学检测: 取生长期2.2.15细胞, 调整其浓度, 以5×103细胞/孔加入96孔板, 过夜培养后, 在每孔中加入活化的PBMC, 使其与2.2.15细胞比例为50:1. 实验设3个复孔. 常规培养24、48和72 h后, 离心收集上清, ELISA法检测丙氨酸转氨酶(ALT).
统计学处理 所有资料均采用SPSS7.5统计软件分析, 数据以均数±标准差(mean±SD)表示. 两组间比较采用方差检验, P<0.05, 确认为有统计学意义.
正常人PBMC经ODN 2216刺激培养48 h后, 上清IFN-α及IFN-γ表达水平较空白对照明显增加, 两组之间有显著性差异, 而对照序列ODN 2243则没有明显激活PBMC的作用(表1).
ODN介导活化的PBMC以50:1的比例与2.2.15细胞共培养24、48和72 h. 结果(表2)显示, ODN 2216本身对2.2.15细胞HBV抗原的分泌无直接抑制作用. 在ODN 2216组, 细胞培养液中的HBsAg和HBeAg从培养24 h后开始下降, 至72 h, 二者均已降至最低, 而在PBMC组和PBMC+ODN2243组, 培养液中HBsAg、HBeAg随着培养时间的进展, 其抑制率较空白对照组虽有所上升, 但与ODN 2216组相比, 后者抑制率上升更为明显, 经统计学分析, 两组之间具有显著性差异(P<0.05).
| HBV | 分组 | 24 h | 48 h | 72 h | |||
| 浓度 | 抑制率(%) | 浓度 | 抑制率(%) | 浓度 | 抑制率(%) | ||
| HBsAg | 2.2.15 | 4.01±0.43 | 0.0 | 11.82±1.81 | 0.0 | 18.24±5.29 | 0.0 |
| 2.2.15+ODN 2216 | 3.65±0.38 | 5.2 | 10.18±1.92 | 6.1 | 15.53±3.57 | 7.2 | |
| 2.2.15+PBMC | 2.21±0.27 | 37.7 | 5.37±0.61 | 49.5 | 9.55±3.26 | 47.6 | |
| 2.2.15+PBMC+ODN 2243 | 2.08±0.40 | 42.3 | 4.21±0.56 | 46.7 | 8.77±2.01 | 51.9 | |
| 2.2.15+PBMC+ODN 2216 | 1.36±0.46 | 57.8 | 1.62±0.89 | 76.4a | 6.55±1.79 | 82.6a | |
| HBeAg | 2.2.15 | 0.19±0.03 | 0 | 0.32±0.02 | 0 | 0.55±0.05 | 0 |
| 2.2.15+ODN 2216 | 0.18±0.07 | 3.0 | 0.33±0.07 | 6.1 | 0.52±0.08 | 7.2 | |
| 2.2.15+PBMC | 0.18±0.04 | 9.8 | 0.28±0.09 | 12.5 | 0.49±0.14 | 17.6 | |
| 2.2.15+PBMC+ODN 2243 | 0.17±0.05 | 11.2 | 0.26±0.19 | 18.7 | 0.48±0.16 | 21.9 | |
| 2.2.15+PBMC+ODN 2216 | 0.12±0.01 | 20.5 | 0.15±0.11 | 47.4a | 0.24±0.11 | 52.4a | |
在不同ODN的刺激下, PBMC与2.2.15细胞共培养72 h后, 不论是HBV DNA或HBV mRNA水平, ODN 2216均对其产生抑制作用, 其抑制率明显高于其他组(表3), 其中以对mRNA水平的影响最为明显, 抑制率高达81.3%. 此外, ODN 2216本身对HBV DNA的分泌无直接抑制作用.
我们用ODN 2243及空白管作为对照, 进行了3次实验. 结果显示, ODN 2216介导的PBMC杀伤活性明显强于相应效-靶比的对照组, 随着效-靶比增大, PBMC的杀伤活性明显提高, 当效靶比为50:1和100:1时, ODN 2216组的杀伤活性明显高于ODN 2243组和空白对照组的杀伤活性(P<0.05, 图1).
2.2.15细胞与不同ODN介导的PBMC共同孵育72 h后, ODN 2216组的ALT值明显升高, 与其他组相比具有显著性差别(P<0.05, 图2).
CpG-ODN参与对多种细胞的激活, 其免疫效应主要取决于CpG模体, 将序列的CpG甲基化或将CpG替换成GpC或其他序列, 均将丧失或降低免疫刺激作用.根据CpG-ODN对不同刺激细胞所产生的免疫效应不同, CpG-ODN可分为K型和D型.前者主要促B细胞增生并分泌IgG2α, IgM等; 而后者主要活化浆细胞样树突状细胞(plasmacytoid dendritic cell, pDC)、单核/巨噬细胞等, 使他们释放高水平的IFN-α/β, IL-12, IL-18等细胞因子和高表达B7, MHCⅡ分子等[22-24], 继而诱导活化NK细胞分泌IFN-α, 引发Th1型特征的细胞免疫[25-27]. 我们所采用的ODN 2216为典型的D型CpG-ODN, 不仅能激活PBMC产生大量的IFN-γ, 同时亦可明显提高NK细胞分泌IFN-α能力, 如置换ODN 2216中CpG模体所获得的OND 2243, 则显著降低其产生IFN-α及IFN-γ的能力, 这提示CpG-ODN 2216免疫刺激效应是通过CpG模体所介导.Krug et al[28]认为CpG-ODN刺激产生的内源性IFN较体外重组的IFN, 其抗病毒效应更有效、更稳定, 而活化的DC, NK等免疫细胞亦可直接或间接参与抗病毒作用. 以Harandi et al[10]和Ashkar et al[11]为首的两个科研小组在研究CpG-ODN抗HSV-2感染时证实, 感染前24 h CpG-ODN局部或全身给药, 能显著激活DC和NK细胞, 极大的抑制HSV-2在小鼠体内的复制, 并保护鼠免遭病毒致死性攻击. 鉴于目前尚无 CpG-ODN介导的抗HBV研究, 在获得了能活化PBMC的CpG-ODN后, 应用2.2.15细胞, 我们进一步研究了CpG-ODN介导活化的PBMC体外对HBV复制与表达的抑制作用. 结果表明, ODN 2216虽本身不能直接抑制HBV的复制, 但可通过活化PBMC而间接抑制HBsAg, HBeAg的分泌, 其抑制率均明显大于ODN 2243对照组, 其中以对HBsAg的抑制最为明显, 最高可达82.6%; 同时发现(表2), PBMC及ODN 2243组也表现出一定的抑制HBV HBsAg, HBeAg分泌的活性, 但这两组之间并无显著性差异, 并且与ODN 2216组相比, 其抑制HBV抗原表达的能力均远低于后者, 提示这两组抗病毒效应的产生可能是正常人PBMC在自然状态下也具有一定的抗HBV能力.
IFN的抗HBV作用主要是通过激活多种抗病毒蛋白而活化内源性RNA酶, 因此, IFN不仅可抑制HBV DNA的复制, 还可通过降解mRNA来遏制病毒蛋白的翻译[29]. 我们的结果(表3)表明, CpG-ODN本身虽不直接作用HBV DNA和HBV mRNA, 但可通过活化PBMC对HBV DNA和HBV mRNA产生较好的抑制作用; 并进一步发现CpG-ODN对HBV mRNA的抑制作用明显强于HBV DNA水平, 推测IFN可能参与了抑制HBV复制的作用, 但并不排除其他免疫分子的参与. MTT(图1)和酶学(图2)结果亦显示, 与其他组相比, CpG-ODN介导活化的PBMC对2.2.15细胞有明显的杀伤作用, 提示这可能与CpG-ODN激活的免疫细胞有关. 目前的研究认为, 某些天然免疫细胞如NK细胞、DC细胞等可通过直接杀伤被感染的细胞或分泌大量的免疫分子而发挥抗病毒效应. CpG-ODN可能通过活化上述天然免疫细胞而杀伤2.2.15细胞, 进而使其胞内的HBV复制受到抑制. 尽管目前用于治疗慢性乙型肝炎的免疫调节剂众多, 但疗效并不显著且缺乏针对性. 即使目前较多使用的抗HBV药如干扰素和核苷类似物, 虽能在一定程度上抑制HBV复制, 但因复发率高、副作用大以及难以在体内彻底清除病毒等原因而受到限制. 因此继续寻求新的抗HBV药物, 仍是当前相关学者密切关注的课题.CpG-ODN作为一种新的免疫调节剂, 不仅可诱发产生内源性IFN, 同时还可活化DC, NK等免疫细胞直接或间接参与抗HBV作用, 因此, 在HBV高感染的今天, CpG-ODN具有很好的临床应用前景.
编辑: N/A
| 1. | Vollmer J, Weeratna R, Payette P, Jurk M, Schetter C, Laucht M, Wader T, Tluk S, Liu M, Davis HL. Characterization of three CpG oligodeoxynucleotide classes with distinct immunostimulatory activities. Eur J Immunol. 2004;34:251-262. [PubMed] [DOI] |
| 2. | Rothenfusser S, Hornung V, Ayyoub M, Britsch S, Towarowski A, Krug A, Sarris A, Lubenow N, Speiser D, Endres S. CpG-A and CpG-B oligonucleotides differentially enhance human peptide-specific primary and memory CD8+ T-cell responses in vitro. Blood. 2004;103:2162-2169. [PubMed] [DOI] |
| 3. | Ishii KJ, Takeshita F, Gursel I, Gursel M, Conover J, Nussenzweig A, Klinman DM. Potential role of phosphatidylinositol 3 kinase, rather than DNA-dependent protein kinase, in CpG DNA-induced immune activation. J Exp Med. 2002;196:269-274. [PubMed] [DOI] |
| 4. | Verthelyi D, Ishii KJ, Gursel M, Takeshita F, Klinman DM. Human peripheral blood cells differentially recognize and respond to two distinct CPG motifs. J Immunol. 2001;166:2372-2377. [PubMed] [DOI] |
| 5. | Kadowaki N, Antonenko S, Liu YJ. Distinct CpG DNA and polyinosinic-polycytidylic acid double-stranded RNA, respectively, stimulate CD11c- type 2 dendritic cell precursors and CD11c+ dendritic cells to produce type I IFN. J Immunol. 2001;166:2291-2295. [PubMed] [DOI] |
| 6. | Sester DP, Naik S, Beasley SJ, Hume DA, Stacey KJ. Phosphorothioate backbone modification modulates macrophage activation by CpG DNA. J Immunol. 2000;165:4165-4173. [PubMed] [DOI] |
| 7. | Raghavan S, Nystrom J, Fredriksson M, Holmgren J, Harandi AM. Orally administered CpG oligodeoxynucleotide induces production of CXC and CC chemokines in the gastric mucosa and suppresses bacterial colonization in a mouse model of Helicobacter pylori infection. Infect Immun. 2003;71:7014-7022. [DOI] |
| 8. | Gramzinski RA, Doolan DL, Sedegah M, Davis HL, Krieg AM, Hoffman SL. Interleukin-12- and gamma interferon-dependent protection against malaria conferred by CpG oligodeoxynucleotide in mice. Infect Immun. 2001;69:1643-1649. [PubMed] [DOI] |
| 9. | Verthelyi D, Gursel M, Kenney RT, Lifson JD, Liu S, Mican J, Klinman DM. CpG oligodeoxynucleotides protect normal and SIV-infected macaques from Leishmania infection. J Immunol. 2003;170:4717-4723. [PubMed] [DOI] |
| 10. | Harandi AM, Eriksson K, Holmgren J. A protective role of locally administered immunostimulatory CpG oligodeoxynucleotide in a mouse model of genital herpes infection. J Virol. 2003;77:953-962. [PubMed] [DOI] |
| 11. | Ashkar AA, Bauer S, Mitchell WJ, Vieira J, Rosenthal KL. Local delivery of CpG oligodeoxynucleotides induces rapid changes in the genital mucosa and inhibits replication, but not entry, of herpes simplex virus type 2. J Virol. 2003;77:8948-8956. [PubMed] [DOI] |
| 13. | Liu J, Guo Y, Xue CF, Li YH, Huang YX, Ding J, Gong WD, Zhao Y. Effect of vector-expressed siRNA on HBV replication in hepatoblastoma cells. World J Gastroenterol. 2004;10:1898-1901. [PubMed] [DOI] |
| 14. | Song CZ, Wang QW, Song CC, Bai ZL. Viral replication modulated by synthetic peptide derived from hepatitis B virus X protein. World J Gastroenterol. 2004;10:389-392. [PubMed] [DOI] |
| 15. | 王 九平, 白 雪帆, 张 三奇, 李 谨革, 张 颖, 张 岩, 薛 克昌, 顾 宜, 王 平忠, 骆 抗先. 肝靶向十六酸拉咪呋啶固体脂质纳米粒抗乙肝病毒的研究. 世界华人消化杂志. 2003;11:191-194. |
| 16. | Ding J, Liu J, Xue CF, Gong WD, Li YH, Zhao Y. Anti-HBV effect of TAT- HBV targeted ribonuclease. World J Gastroenterol. 2003;9:1525-1528. [PubMed] [DOI] |
| 17. | Liu J, Li YH, Ding J, Gong WD, Xue CF, Zhao Y, Huang YX. Quantifying anti-HBV effect of targeted ribonuclease by real-time fluorescent PCR. World J Gastroenterol. 2004;10:2883-2885. [PubMed] [DOI] |
| 19. | Rothenfusser S, Hornung V, Krug A, Towarowski A, Krieg AM, Endres S, Hartmann G. Distinct CpG oligonucleotide sequences activate human gamma delta T cells via interferon-alpha/-beta. Eur J Immunol. 2001;31:3525-3534. [PubMed] [DOI] |
| 22. | Krieg AM. CpG motifs in bacterial DNA and their immune effects. Annu Rev Immunol. 2002;20:709-760. [PubMed] [DOI] |
| 23. | Krug A, Rothenfusser S, Selinger S, Bock C, Kerkmann M, Battiany J, Sarris A, Giese T, Speiser D, Endres S. CpG-A oligonucleotides induce a monocyte-derived dendritic cell-like phenotype that preferentially activates CD8 T cells. J Immunol. 2003;170:3468-3477. [PubMed] [DOI] |
| 24. | Klinman DM. Immunotherapeutic uses of CpG oligodeoxynucleotides. Nat Rev Immunol. 2004;4:249-258. [PubMed] [DOI] |
| 25. | Blackwell SE, Krieg AM. CpG-A-induced monocyte IFN-gamma-inducible protein-10 production is regulated by plasmacytoid dendritic cell-derived IFN-alpha. J Immunol. 2003;170:4061-4068. [PubMed] [DOI] |
| 26. | Heeg K, Zimmermann S. CpG DNA as a Th1 trigger. Int Arch Allergy Immunol. 2000;121:87-97. [PubMed] [DOI] |
| 27. | Verthelyi D, Klinman DM. Immunoregulatory activity of CpG oligonucleotides in humans and nonhuman primates. Clin Immunol. 2003;109:64-71. [DOI] |
| 28. | Krug A, Rothenfusser S, Hornung V, Jahrsdörfer B, Blackwell S, Ballas ZK, Endres S, Krieg AM, Hartmann G. Identification of CpG oligonucleotide sequences with high induction of IFN-alpha/beta in plasmacytoid dendritic cells. Eur J Immunol. 2001;31:2154-2163. [PubMed] [DOI] |
| 29. | Robek MD, Boyd BS, Wieland SF, Chisari FV. Signal transduction pathways that inhibit hepatitis B virus replication. Proc Natl Acad Sci USA. 2004;101:1743-1747. [PubMed] [DOI] |