修回日期: 2004-08-20
接受日期: 2004-08-30
在线出版日期: 2004-11-15
目的: 研究扶正抑瘤饮及其配伍不同化疗药物后对体外人胃癌细胞的影响. 并探讨中药抑制人胃癌细胞增生的可能的作用机制.
方法: 取两株人胃癌细胞株SGC-7901、MGC-803细胞, 分别加入中药及其分别配伍不同的化疗药物及方案(包括化疗药物Vp-16, ADM, 5-FU, DDP以及化疗方案EAP, EFP), 分别采用MTT法观察各组药物作用胃癌细胞24 h, 48 h, 72 h后对两种胃癌细胞增生的抑制作用. 并通过流式细胞仪测定各组药物作用胃癌细胞72 h后的胃癌细胞凋亡率和坏死率. 同时通过透射电镜观察中药作用72 h后的胃癌细胞的细胞超微结构的变化.
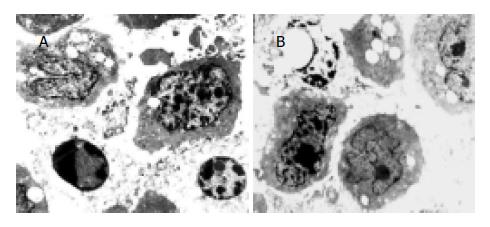
结果: 透射电镜下可以观察到中药引起胃癌细胞发生典型的凋亡细胞形态学的改变. 经t检验, 结果显示中药与4种化疗药物2种化疗方案联用24, 48, 72 h后, 对两株胃癌细胞均有协同抑制作用, 且随着药物作用时间的延长, 其协同抑制作用也增强. 中药与ADM联用对人胃癌细胞株SGC-7901, MGC-803的协同抑制作用均为最弱, 分别为(55.4±4.8 vs 20.1±5.5, t = 2.41, P = 0.02<0.05; 50.7±6.4 vs 14.8±2.7 t = 2.42, P = 0.02<0.05). 其中中药与EFP化疗方案联用对SGC-7901细胞株协同抑制作用较强, 分别为(79.4±2.8, 83.3±4.8, 87.5±4.3, t = 2.85, P = 0.005<0.05). 而中药与DDP(70.2±3.5, 80.1±3.6, 84.3±7.5, t = 2.42, P = 0.02<0.05)和与EFP(82.6±7.8, 87.5±3.1, 89.9±4.8, t = 2.96, P = 0.005<0.05)化疗方案联用对MGC-803细胞株的协同抑制作用较强. 且中药与DDP和EFP化疗方案联用72 h对MGC-803细胞株的抑瘤率相近且高于其他治疗(P<0.05). 中药与不同的化疗药物及方案联用, 对不同分化程度的人胃癌细胞株所产生的协同增效作用不同.
结论: 扶正抑瘤饮通过诱导细胞凋亡抑制肿瘤细胞的增生, 并与化疗药物有协同效果, 但与不同药物联用的协同效率和产生协同效果的机制不同. 且中药与单药联用的抑瘤率不一定低于与化疗方案联用的抑瘤率. 中药与化疗或与化疗方案联用对不同分化程度的胃癌的抑制作用也存在敏感性差异.
引文著录: 刘昳, 王锐, 邱根全, 孙喜才. 扶正抑瘤饮及其配伍不同化疗药物对人胃癌细胞增生的抑制作用. 世界华人消化杂志 2004; 12(11): 2564-2567
Revised: August 20, 2004
Accepted: August 30, 2004
Published online: November 15, 2004
AIM: To study the inhibitory effects of Fuzheng Yiliuyin (FZYLY) combined with various chemotherapeutic drugs on human gastric carcinoma cell lines.
METHODS: Human gastric carcinoma cell lines, namely SGC-7901 and MGC-803, were treated with FZYLY, FZYLY combined with various kinds of chemotherapeutic drugs (including Vp-16, ADM, 5-FU, DDP) and chemotherapeutic scheme (including EAP and EFP) respectively. The inhibitory effects of various drugs on the two cell lines were observed by MTT method at 24h, 48h and 72h. Flow cytometry was used to detect the apoptotic rate of gastric carcinoma cells after 72 h. At the same time, transmission electron microscope was used to observe the ultrastructural changes of gastric carcinoma cells.
RESULTS: Obvious apoptosis was observed in the gastric carcinoma cells72 h after treated with FZYLY. FZYLY combined with Vp-16, ADM, 5-FU, DDP and EAP and EFP schemes have the synergic inhibitory effects on the two kinds of cell lines, and the inhibitory effects increased with the duration of drug action. FZYLY combined with ADM had the worst synergic inhibitory effects on both SGC-7901 and MGC-803 (55.4±4.8 vs 20.1±5.5, t = 2.41, P = 0.02 < 0.05; 50.7±6.4 vs 14.8±2.7, t = 2.42, P = 0.02 < 0.05, compared with FZYLY, respectively. FZYLY combined with EFP chemotherapeutic scheme had better inhibitory effects on SGC-7901, and the inhibitory rates were 79.4±2.8%, 83.3±4.8%, 87.5±4.3% after 24, 48 h and 72 h respectively (t = 2.85, P = 0.005 < 0.05 vs FZYLY). The inhibition rates on MGC-803 cells of FZYLY combined with DDP were not significantly different from those of FZYLY combined with EFP scheme after 72 h, but their effects were both better than other groups. The synergic inhibitory effects on various cell lines were different when FZYLY was combined with various drugs.
CONCLUSION: FZYLY can induce apoptosis of gastric carcinoma cells. FZYLY has the synergic function with chemotherapeutic drugs, but the efficiency of synergic effects and the mechanism are different. FZYLY combined with one single drug and with chemotherapeutic scheme may have the similar effects. Different gastric carcinoma cell lines have different sensitivities to different combinations.
- Citation: Liu Y, Wang R, Qiu GQ, Sun XC. Inhibition of Fuzheng Yiliuyin combined with various chemotherapeutic drugs on human gastric carcinoma cell lines. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2564-2567
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2564.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2564
我们在应用扶正抑瘤饮体内外治疗胃癌取得较好疗效的基础上[1-2], 进一步研究其抗癌机制. 虽然大量的临床和实验研究报道, 中药和化疗药物或化疗方案联用可以起到增效减毒的作用. 但是中药与不同的化疗药物联用是否均有增效作用, 以及中药对不同化疗的增效作用和增效机制间是否存在差异, 均有待研究.
人胃低分化黏液腺癌细胞株MGC-803由西安交通大学第一医院分子生物中心提供; 人胃中分化转移性腺癌细胞株SGC-7901由第四军医大学西京医院消化科提供; 扶正抑瘤饮液由西安交通大学药理研究所生产, 含生药2 g/L, 处方: 黄芪, 白术, 柴胡, 三棱, 莪术, 汉三七, 蒲公英, 白花蛇舌草, 仙鹤草, 石上柏, 炙甘草的浸提液; 氟尿嘧啶(5-FU)由上海海普药厂生产; 足叶乙甙(Vp-16)由连云港制药厂生产; 顺铂(DDP)由河北德州制药厂生产; 阿霉素(ADM)为Pharmacia and Upjohn公司产品. EAP化疗方案包括Vp-16, ADM, 5-FU; EFP化疗方案包括Vp-16, DDP, 5-FU. 细胞膜磷酯酰丝氨酸荧光素探针(Annexin-V-FITC)为Boehringer Mannhein公司产品; PI和MTT为Sigma公司产品.全自动酶联免疫检测仪为Labsystem公司产品; 流式细胞仪为美国Coulter公司产品.
胃癌细胞SGC-7901和MGC-803用含100 mL/L小牛血清的RMPI1640培养液, 在37 ℃, 50 mL/L CO2培养箱中培养, 用2.5 g/L的胰蛋白酶消化传代. 取对数生长期贴壁生长状态良好的人胃癌细胞SGC-7901和MGC-803, 按5×107/L的密度接种于96孔无菌细胞培养板(200 μL/孔), 放入37 ℃ 50 mL/L CO2孵箱24 h后取出. 吸弃上清液, 以各组相应的药物和剂量加入培养孔中(200 μL/孔). 每板分为6组(即培养液对照组、中药与5-FU联合组, 中药与Vp-16联合组, 中药与ADM联合组, 中药与DDP联合组, 中药与EFP联合组, 中药与EAP联合组), 每组设3个复孔. 中药浓度[1]为1 mg/L. 5-FU, ADM, DDP, Vp-16浓度为能抑制30%人胃癌细胞增生的浓度(IC30). 加药后放回37 ℃, 50 mL/L CO2孵箱共同孵育72 h后, 各孔加入4 g/L四甲偶氮唑蓝(MTT)20 μL孵育4 h, 加入二甲基亚砜150 μL, 混匀30 min后在全自动酶联免疫检测仪于570 nm波长测定A570值(实验重复3次, 取其均值)间接反映存活细胞数量. 计算中药对人胃癌细胞的抑制率=(A无药组-A用药组)/A无药组×100%. 将与药物共同孵育72 h后的细胞, 经洗涤收集后加入Annexin-V-FITC和PI混合液染色, 用流式细胞仪检测凋亡细胞. 另取与中药共同孵育72 h后的细胞, 弃去培养液, 用自制细胞刮刮下细胞, 移入加入了4 ℃预冷PBS的尖底离心管中, 离心15 min弃上清, 加入4 ℃预冷的20 g/L戊二醛4 mL, 进行透射电镜检测.
统计学处理 各组实验数据用mean±SD表示, 用SPSS10.0统计软件进行t检验.
中药联用不同的化疗方案均能增强对人胃癌细胞的抑制作用, 但对两株胃癌细胞的敏感性不同, 随着药物作用时间的延长, 其抑瘤率也随之增大. 对于SGC-7901细胞株而言, 中药与EFP联用的抑瘤率较高. 对于MGC-803细胞株而言, 中药与DDP和EFP化疗方案联用抑瘤率相近且高于其他治疗(P<0.05, 表1).
| 分组 | SGA-7901 | MGA-803 | ||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| FZYLY | 12.4±7.9 | 17.4±3.1 | 20.1±5.5 | 8.9±4.5 | 11.8±5.4 | 14.8±2.7 |
| FZYLY+Vp-16 | 51.2±4.2a | 56.9±4.8a | 62.3±3.9a | 36.9±7.2a | 48.9±5.2 | 58.8±4.6a |
| FZYLY+ADM | 46.5±7.2a | 50.1±3.2a | 55.4±4.8a | 34.5±8.1a | 43.6±3.7 | 50.7±6.4a |
| FZYLY+5-FU | 57.8±2.6a | 61.9±6.3a | 69.9±8.4a | 40.7±6.6a | 50.8±4.7a | 55.7±3.2a |
| FZYLY+DDP | 53.6±2.4a | 58.4±1.7a | 67.4±5.7a | 70.2±3.5a | 80.1±3.6a | 84.3±7.5a |
| FZYLY+EAP | 61.2±3.3a | 68.5±3.9a | 71.5±3.4a | 73.8±4.6a | 72.2±4.1a | 74.9±3.4a |
| FZYLY+EFP | 79.4±2.8a | 83.3±4.8a | 87.5±4.3a | 82.6±7.8a | 87.5±3.1a | 89.9±4.8a |
中药联用不同的化疗药物及方案, 对SGA-7901和MGC-803不同分化程度的人胃癌细胞株所产生的影响不同. 他可以通过主要加强直接的细胞毒作用, 也可以通过主要加强诱导细胞的凋亡提高某些化疗药物的抑瘤作用(表2).
| 分组 | SGA-7901 | MGA-803 | ||||
| 活细胞 | 坏死细胞 | 凋亡细胞 | 活细胞 | 坏死细胞 | 凋亡细胞 | |
| FZYLY | 78.7±0.6 | 6.6±4.3 | 14.5±5.4 | 84.4±3.1 | 4.5±0.6 | 11.2±1.8 |
| FZYLY+Vp-16 | 38.5±2.5 | 46.1±6.2 | 15.3±2.1 | 42.1±1.5 | 32.4±7.9 | 25.8±5.2 |
| FZYLY+ADM | 44.6±3.5 | 26.7±2.5 | 19.9±4.7 | 49.4±5.2 | 29.8±3.3 | 20.7±5.1 |
| FZYLY+5-FU | 29.6±4.1 | 44.7±9.9 | 25.6±1.2 | 44.3±8.2 | 30.5±7.4 | 25.3±4.6 |
| FZYLY+DDP | 32.3±11.7 | 63.6±10.6 | 4.1±3.0 | 16.1±7.5 | 60.9±8.1 | 23.0±0.6 |
| FZYLY+EAP | 27.6±5.8 | 55.5±10.5 | 16.8±7.4 | 25.0±2.9 | 65.4±5.8 | 9.6±2.3 |
| FZYLY+EFP | 13.1±2.7 | 66.3±12.0 | 20.7±6.6 | 11.1±3.6 | 67.8±4.1 | 20.9±4.9 |
| 空白对照 | 92.1±6.3 | 6.6±8.4 | 1.3±0.2 | 94.3±0.2 | 4.6±0.8 | 1.2±0.5 |
胃癌是我国最常见的恶性肿瘤[3]晚期治疗很困难[4-6], 因而对胃癌的防治研究仍是目前的研究热点. 近年大量研究表明中药方剂具有抗肿瘤作用[7-8], 并可诱导胃癌细胞凋亡和抑制胃癌细胞体外生长[9-15]. 中药扶正抑瘤饮在肿瘤治疗领域有一定的价值[1-2]. 研究表明化疗药物对不同病理学类型的胃癌的抑制作用存在敏感性差异[16-17]. 我们的研究表明扶正抑瘤饮可通过引起坏死性细胞改变及诱导凋亡抑制体外胃癌细胞的增生, 且主要通过诱导凋亡来抑制胃癌细胞的增生. 但其对不同胃癌细胞生长抑制的效果存在明显的差异. 抗癌药物联合应用有重要的临床意义. 化疗药物的联用可以提高治疗胃癌有效率, 并能降低了毒副作用. DDP[18-20], EAP[21-26], EFP[27]都是临床治疗胃癌常用的化疗药物及方案. 中药可增强化疗药物对多种肿瘤的治疗效果[28-30]. 我们的研究表明, 中药对不同的化疗药物或化疗方案均有增效胃癌作用. 但他们引起的增效作用的效率不同. 虽然对不同细胞株的增生的影响不同, 但均随着作用时间的延长, 抑制肿瘤细胞增生的效果加强. 这部分解释了为什么临床上相同的中药与不同的化疗药物联用, 或者相同的治疗方案, 对有些患者效果好而对有些患者则效果差. 这说明抗肿瘤中药与化疗方案联用也存在药物敏感性的问题. 我们的研究结果还提示, 中药与化疗方案联用并不一定就能获得较与其某些单药联用更高的抑瘤率. 因此在临床上应针对不同的肿瘤类型、不同的患者进行个体化的治疗. 通过体外药敏试验, 选择适当的化疗药物或化疗方案与抗肿瘤中药联用, 并可以通过适当延长治疗时间以求提高疗效, 减少毒副作用, 获得最佳临床治疗效果. 中药联用不同化疗药产生增效作用的机制也不同, 有些是通过直接细胞毒作用, 有些则是通过诱导细胞凋亡来实现. 但其具体作用机制尚有待进一步阐明.
编辑: N/A
| 3. | Wu K, Liu BH, Zhao DY, Zhao Y. Effect of vitamin E succinate on expression of TGF-β1, c-jun and JNK1 in human gastric cancer SGC 7901 cells. Shijie Huaren Xiaohua Zazhi. 2001;7:83-87. [DOI] |
| 4. | Xu DZ, Zhan YQ, Sun XW, Cao SM, Geng QR. Meta-analysis of intraperitoneal chemotherapy for gastric cancer. World J Gastroenterol. 2004;10:2727-2730. [PubMed] [DOI] |
| 5. | Wood LA, Fields AL. Chemotherapy in metastatic gastric cancer: population-based perceptions and practice patterns of medical oncologists. Br J Cancer. 2004;90:1885-1887. [PubMed] [DOI] |
| 6. | Layke JC, Lopez PP. Gastric cancer: diagnosis and treatment options. Am Fam Physician. 2004;69:1133-1140. [PubMed] |
| 9. | Su M, Dai M, Lü X, Li H, Liu J. Effect of traditional Chinese medicine compounds Aining on the expression of apoptosis inducing genes of human gastric cancer cell. Zhong Yao Cai. 2002;25:563-566. [PubMed] |
| 13. | Su M, Dai M, Lü X, Li H, Liu J. [Morphological changes and inhibiting effect on human gastric cancer cell SGC-7901 caused by aining]. Zhong Yao Cai. 2002;25:339-342. [PubMed] |
| 14. | Su M, Dai M, Lü X, Liu J, Li H. [Apoptotic morphological changes and TUNEL of human gastric cancer cell SGC-7901 induced by aining]. Zhong Yao Cai. 2002;25:270-272. [PubMed] |
| 15. | Ji YB, Gao SY, Ji HR, Kong Q, Zhang XJ, Yang BF. Anti-neoplastic efficacy of Haimiding on gastric carcinoma and its mechanisms. World J Gastroenterol. 2004;10:484-490. [PubMed] [DOI] |
| 18. | Zhang WM, Xu GH, Ju AP, Zheng YT, Jiang Q. [Clinical results of advanced gastric cancer patients treated with oxaliplatin-containing regimen]. Ai Zheng. 2003;22:1346-1348. [PubMed] |
| 19. | Suganuma K, Kubota T, Saikawa Y, Abe S, Otani Y, Furukawa T, Kumai K, Hasegawa H, Watanabe M, Kitajima M. Possible chemoresistance-related genes for gastric cancer detected by cDNA microarray. Cancer Sci. 2003;94:355-359. [PubMed] [DOI] |
| 20. | Li Q, Feng FY, Han J, Sui GJ, Zhu YG, Zhang Y, Zhang ZH, Li L, Wang PH, Zhou MZ. [Phase III clinical study of a new anticancer drug atofluding]. Ai Zheng. 2002;21:1350-1353. [PubMed] |
| 21. | Ueda Y, Sonoda Y, Fujiki H, Harada S, Kimura T, Itoh T, Imura K, Naito K, Nomura K, Taniwaki M. Mobilization of peripheral blood stem cells (PBSCs) after etoposide, adriamycin and cisplatin therapy, and a multimodal cell therapy approach with PBSCs in advanced gastric cancer. Oncol Rep. 2004;12:323-332. [PubMed] [DOI] |
| 22. | Reichle A, Bolder U, Bataille F, Messmann H, Wagner H, Zaiss M, Wild P, Hofstädter F, Andreesen R, Jauch KW. A multimodal treatment approach including high-dose chemotherapy in very advanced gastric cancer: evidence for control of metastatic disease. Bone Marrow Transplant. 2003;32:665-671. [PubMed] [DOI] |
| 23. | Menges M, Schmidt C, Lindemann W, Ridwelski K, Pueschel W, Jüngling B, Feifel G, Schilling M, Stallmach A, Zeitz M. Low toxic neoadjuvant cisplatin, 5-fluorouracil and folinic acid in locally advanced gastric cancer yields high R-0 resection rate. J Cancer Res Clin Oncol. 2003;129:423-429. [PubMed] [DOI] |
| 24. | Bar Sela G, Tsalic M, Gaitini D, Steiner M, Haim N. Etoposide, doxorubicin and cisplatin alternating with 5-fluorouracil, doxorubicin and high-dose methotrexate in patients with advanced adenocarcinoma of the stomach or the gastroesophageal junction. J Chemother. 2002;14:623-626. [PubMed] [DOI] |
| 25. | Uchinami M, Horiuchi T, Aotake T, Matsumura M, Yokomachi J, Tanaka K, Tabo T, Tanigawa N. [A gastric cancer patient with marked para-aortic lymph node metastasis surviving more than 10 years after aggressive operation and repeated EAP chemotherapy]. Gan To Kagaku Ryoho. 2002;29:449-453. [PubMed] |
| 26. | Bajetta E, Buzzoni R, Mariani L, Beretta E, Bozzetti F, Bordogna G, Aitini E, Fava S, Schieppati G, Pinotti G. Adjuvant chemotherapy in gastric cancer: 5-year results of a randomised study by the Italian Trials in Medical Oncology (ITMO) Group. Ann Oncol. 2002;13:299-307. [PubMed] [DOI] |
| 27. | Li AL, Li HY, Jin BF, Ye QN, Zhou T, Yu XD, Pan X, Man JH, He K, Yu M. A novel eIF5A complex functions as a regulator of p53 and p53-dependent apoptosis. J Biol Chem. 2004;279:49251-49258. [PubMed] [DOI] |
| 28. | Shen YH, Song MZ, Huang WX. Evaluation of therapeutic effects of traditional Chinese medicine combined with western medicine on breast cancer after resection: Analysis of 71 cases. Zhongxiyi Jiehe Xuebao. 2003;1:30-31. [DOI] |
| 29. | Han MQ, Su JM, Huang HY, Long WH, Qin LP, Qin P, Liu W, Sheng ZY. [Prognostic analysis of advanced non small cell lung cancer treated by sequential chemo-radiation therapy combined with traditional Chinese medicine: a report of 54 cases]. Zhongxiyi Jiehe Xuebao. 2003;1:195-198. [PubMed] |
| 30. | Li LN, Liu WS, Xu K. [Effect of combination of syndrome differentiation depending treatment and chemotherapy on prognostic factors in treating mid-late patients with non-small call lung cancer]. Zhongguo Zhongxiyi Jiehe Zazhi. 2003;23:575-579. [PubMed] |