修回日期: 2004-08-20
接受日期: 2004-09-04
在线出版日期: 2004-11-15
目的: 研究CD44反义寡核苷酸(CD44ASODN)对人胃癌MGC80-3细胞的增生抑制和诱导凋亡的作用和机制.
方法: 设计并合成CD44ASODN, 脂质体介导转入MGC80-3胃癌细胞, 采用流式细胞术(FACS)检测CD44、Fas的表达及细胞凋亡; RT-PCR法检测CD44mRNA的表达; MTT法检测细胞增生.
结果: CD44ASODN(1.6 μmol/L)明显地抑制MGC80-3细胞CD44mRNA和蛋白表达水平. CD44ASODN作用MGC80-3细胞48 h后, 细胞的增生呈现明显的抑制作用, 其抑制率为31.0%, 72, 96 h的抑制率分别为46.3%、49.6%(P<0.01), 其增生抑制作用呈时间依赖效应. 在CD44配体低分子质量透明质酸存在的环境中, CD44ASODN能显著增高细胞表面Fas分子的表达, 表达率从6.7%提高为16.8%(P<0.01), 并显著地增加MGC80-3细胞对FasmAb诱导凋亡的敏感性, 凋亡率从0增加到26.5%(P<0.01).
结论: CD44反义寡核苷酸通过抑制MGC80-3细胞CD44m RNA和蛋白表达, 抑制MGC80-3细胞的增生, 增高细胞表面Fas的表达及MGC80-3细胞对FasmAb诱导凋亡的敏感性, 逆转胃癌细胞的免疫逃逸作用.
引文著录: 荆雪宁, 张玲, 王芸, 毛海婷, 温培娥, 李登华, 崔树龄, 顾洪涛. 瞬时转染CD44反义寡核苷酸抑制人胃癌MGC80-3细胞增生并诱导凋亡. 世界华人消化杂志 2004; 12(11): 2551-2554
Revised: August 20, 2004
Accepted: September 4, 2004
Published online: November 15, 2004
AIM: To study the role and mechanism of antisense oligodeoxyribonucleotides (ASODN) on proliferation and apoptosis of MGC80-3 cells.
METHODS: Flow cytometry was used to detect CD44, Fas expression and apoptosis of MGC80-3 cells. Reverse transcription polymerase chain reaction (RT-PCR) assay was used to examine CD44 mRNA level; MTT assay was used to detect cell proliferation.
RESULTS: CD44 mRNA and CD44 protein expression in MGC80-3 cells was blocked and down-regulated after transfected with CD44ASODN (1.6 μmol/L). CD44ASODN inhibited the growth of MGC80-3 cells with depression ratios of 31.0%, 46.3% (P < 0.01), and 49.6% (P < 0.01) at 48 h, 72 h, and 96 h respectively in a time-dependant manner. With the existence of hyaluronic acid, CD44ASODN improved Fas expression in MGC80-3 cells from 6.7% to 16.8% (P < 0.01). At the same time, it enhanced the susceptibility of MGC80-3 cells to Fas mAb and the apoptotic rate of the cells increased from 0% to 26.5% (P < 0.01).
CONCLUSION: CD44ASODN can down-regulate the expression of CD44 mRNA and protein, inhibit MGC80-3 cell proliferation and promote apoptosis induced by Fas mAb.
- Citation: Jing XN, Zhang L, Wang Y, Mao HT, Wen PE, Li DH, Cui SL, Gu HT. Inhibitory and apoptosis-inducing effects of CD44 antisense oligodeoxyribonucleotides on human gastric cancer cell line MGC80-3. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2551-2554
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2551.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2551
黏附分子CD44以细胞特异性的方式表达于许多细胞表面, 在细胞黏附、信号传导及调节细胞迁移等过程中发挥重要作用. 肿瘤细胞表面的CD44表达显著增高, 或表达CD44异构体的独特模式, 与肿瘤的发生、发展与远处侵袭转移关系密切, 是人类肿瘤转移和预后不良的标志. 最新研究表明, CD44与其细胞外基质配体低分子质量透明质酸结合后, 促进肿瘤细胞的增生, 降低肿瘤细胞表面Fas的表达, 通过Fas/FasL途径降低肿瘤细胞对CTL的敏感性, 进而使肿瘤逃脱Fas介导的CTL杀伤[1]. 我们通过设计合成CD44反义寡核苷酸(ASODN), 封闭和抑制人低分化黏液腺胃癌MGC80-3细胞CD44表达, 阐明CD44ASODN对MGC80-3细胞增生能力、Fas的表达及FasmAb诱导凋亡的影响, 为CD44基因的肿瘤生物治疗, 提供新的理论和实验依据.
MGC80-3细胞株, 由本室保存; RPMI1640、胰蛋白酶, 为GIBCO产品; 鼠抗人CD44(HCAM)、兔抗人Fas多克隆抗体, 为Santa Cruz公司产品; FITC标记的羊抗兔IgG抗体、兔抗鼠IgG抗体购自华美生物公司; PI, HA, MTT为Sigma公司产品; 鼠抗人FasmAb(AM01L)为Oncogene公司产品; 脂质体(OligofectamineTM)为Invitrogen公司产品; TRIZOL Reagent为Invitrogen公司产品; oligo(dT)18, Rnasin为上海生工生物工程技术服务有限公司产品. 逆转录试剂为Promega公司产品; PCR试剂, 为宝生物工程有限公司产品.
1.2.1 反义寡核苷酸合成、脂质体介导和转染MGC80-3细胞[2-3]: CD44反义寡核苷酸序列与CD44 mRNA的5'端非编码区互补. CD44正反义寡核苷酸序列: 反义(ASODN): 5'-GCGCGGGCGAAAGG-AGCT-3', 正义(SODN)5'-TCCGGACACCATGGACAAG-3', 由上海生工生物工程技术服务有限公司合成, 并进行了硫代化修饰. 采用脂质体(OligofectamineTM, Invitrogen公司产品)介导法, 形成CD44ASODN、SODN脂质体复合物(CD44A/SODN-OF). 取对数生长期的MGC80-3细胞5×105/孔接种6孔板, 待细胞密度增至30-50%时, 加入不同浓度CD44A/SODN-OF转染, 实验分组: (1)对照组; (2)ASODN处理组(0.8, 1.2, 1.6×10-3 mmol/L); (3)SODN处理对照组(0.8, 1.2, 1.6×10-3 mmol/L), 37 ℃, 50 mL/L CO2培养4 h后弃转染液, 加入新鲜培养液继续培养24 h, 48 h, 72 h.
1.2.2 流式细胞术检测MGC80-3细胞CD44分子表达: 收集处理72 h的对照组, ASODN组(1.6×10-3 mmol/L), SODN组(1.6×10-3 mmol/L)MGC80-3细胞(>106), 参照文献[4-5]进行检测.
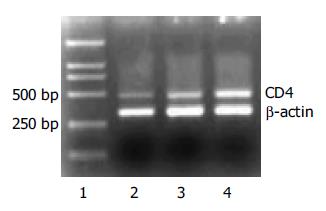
1.2.3 RT-PCR法检测MGC80-3细胞CD44mRNA表达[6]: 收集处理48 h的1.2.2述各组MGC80-3细胞(>106), 按TRIZOL Rengent说明, 提取总RNA, 定量后进行RT-PCR. DNA扩增产物以β-actin基因作内参照, 采用Gel Dos1000凝胶分析仪扫描分析并相对定量.
1.2.4 流式细胞术检测Fas分子的表达[7-8] 和细胞凋亡[9-11]: 实验分组中另设未处理对照(对照1)组, 在上述对照(对照2)组、处理组细胞24 h转染后, 加入CD44配体低分子质量透明质酸(简称HA)终浓度为0.1 g/L, 刺激24 h后收集细胞, 检测Fas分子的表达. 向转染和加入HA刺激24 h后的各组和对照1组中加入鼠抗人FasmAb终浓度为2 mg/L, 继续作用24 h后收集细胞, 检测细胞凋亡.
1.2.5 MTT法检测细胞增生[12-13]: 取对数生长期的MGC80-3细胞5×107/L接种于96孔板, 37 ℃, 50 mL/L CO2孵育过夜, 各组细胞转染和加入HA后, 继续培养24, 48, 72, 96 h. 终止培养前4 h加入MTT(5 g/L), 4 h后置酶标仪下测定.
统计学处理 采用SPSS10.0 for Windows统计软件进行χ2检验、t检验, 确定P<0.05为差异有显著性统计学意义.
0.8, 1.2, 1.6×10-3 mmol /L CD44ASODN作用于MGC80-3细胞72 h后, 细胞表面CD44蛋白的表达较对照组和SODN对照组显著下降(P = 0.0 001<0.01, 表1), 1.6×10-3 mmol/L作用后, 自48 h, 72 h后CD44蛋白表达显著下降(P = 0.0 001<0.01, 表2), 呈现出剂量和时间依赖效应.
在2, 3, 4泳道中清晰可见位于318 bp处的β-actin和482 bp处的CD44片段(图1), 与对照组和SODN对照组相比, ASODN组的CD44基因表达下降, 相对定量值由1.09降至0.14, 表明CD44mRNA基因的表达受到抑制.
在HA的刺激下, MGC80-3细胞表面Fas分子表达下降, 由对照1组的21.7%降至对照2组的6.7%(P = 0.0 001<0.01), CD44ASODN作用后, 与SODN组和对照2组相比, ASODN组Fas分子表达率显著增高, 由6.7%升至16.8%(P = 0.0 001<0.01). 表明用CD44ASODN封闭CD44的表达后, 可显著地提高由HA诱导下降的Fas分子的表达(表3).
对照组未检测到凋亡, 而48hASODN处理组细胞的凋亡率为26.6%, 显著高于SODN组(10.4%)和对照组(0).
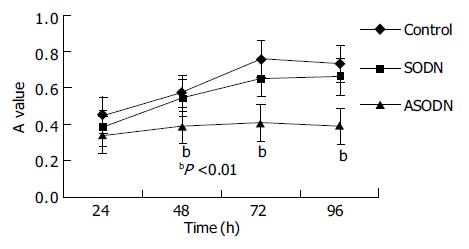
CD44ASODN处理48 h后的MGC80-3细胞, 在HA存在下, 与SODN组和对照组相比, 生长明显受到抑制, 48, 72和96 h的抑制率分别为31.0%、46.3%、49.6%(P = 0.0 001<0.01), 并呈时间依赖效应(图2).
肿瘤细胞表面常发生CD44表达显著增高, 或表达CD44异构体的独特模式, 与肿瘤的发生、发展与远处侵袭转移关系密切, 是人类肿瘤转移和不良预后的标志. 最新研究表明, CD44可以通过多种途径参与肿瘤的免疫逃逸, 其中最重要的就是抑制肿瘤细胞凋亡和促进肿瘤细胞增生. Yasuda et al发现肺癌细胞过高表达的CD44与其细胞外基质配体低分子质量透明质酸结合后, 降低肺癌细胞表面Fas的表达, 通过Fas/FasL途径降低肺癌细胞对CTL的敏感性, 进而使肺癌细胞逃脱CTL细胞通过FasL/Fas介导的凋亡[1]. 我们在实验中用CD44配体低分子质量HA刺激24 h后, 人低分化黏液腺胃癌MGC80-3细胞Fas分子表达率由21.7%降至6.7%, 采用体外Fas/FasL途径诱导凋亡的研究发现, 用FasmAb作用24 h后, MGC80-3细胞不出现凋亡, 同时细胞的增生活性高, 在体外观察到了胃癌细胞的免疫逃逸作用. 为了抑制胃癌细胞增生和诱导凋亡, 我们设计合成CD44ASODN, 转入高表达CD44的人低分化黏液腺胃癌MGC80-3细胞中. 结果表明, CD44ASODN封闭和抑制了MGC80-3细胞CD44 mRNA和蛋白表达, 且抑制作用呈时间和剂量依赖效应. 用CD44ASODN处理MGC80-3细胞后, 加入HA作用, 细胞的Fas表达显著增高, 由下降的6.7%上升到16.8%. 同时, 体外Fas/FasL途径诱导凋亡的研究发现, 加入鼠抗人FasmAb作用24 h后, CD44ASODN处理组细胞出现细胞凋亡, 其凋亡率为26.6%, 显著高于未处理对照组. 可见, 用CD44ASODN抑制CD44基因的表达后, 可以显著地提高由HA诱导下降的Fas分子的表达, 并显著增加FasmAb诱导凋亡的敏感性.
大量研究表明, 在肿瘤组织中, 随着肿瘤的进展, CD44表达强度明显增加[14-16]. 因此, CD44的表达强度可以作为肿瘤预后不良的标志[17-18]. 在良性肿瘤中, CD44的表达呈现同质性, 而在恶性黑素瘤中, CD44主要集中于肿瘤的边缘, 促进肿瘤的增生和扩散[19-20]. CD44分子的高表达促进肿瘤细胞的增生[21], 增生能力的提高又促进CD44分子的表达[22-23]. CD44与其配体HA结合之后, 引发细胞间Ca2+流动, 促进细胞的增生[24-26]. 我们用1.6×10-3 mmol/LCD44ASODN作用于MGC80-3细胞24 h后, 向培养液中加入HA继续作用24, 48, 72, 96 h, 发现CD44ASODN处理组较对照组具有明显的增生抑制作用, 且呈时间依赖性, 与CD44ASODN显著抑制CD44mRNA和蛋白的表达相一致, 因此表明, MGC80-3细胞的增生抑制可能是反义基因封闭CD44基因的表达所致. 肿瘤细胞最基本的特征是无限制增生和凋亡抵抗. 我们发现, 用CD44反义寡核苷酸阻断CD44的表达后, 一方面抑制MGC80-3细胞的增生能力, 另一方面增加MGC80-3细胞表面Fas的表达, 增加MGC80-3细胞对FasmAb诱导凋亡的敏感性, 提示CD44基因有可能成为肿瘤生物治疗的靶点.
编辑: N/A
| 1. | Yasuda M, Tanaka Y, Fujii K, Yasumoto K. CD44 stimulation down-regulates Fas expression and Fas-mediated apoptosis of lung cancer cells. Int Immunol. 2001;13:1309-1319. [PubMed] [DOI] |
| 2. | Weil D, Garçon L, Harper M, Duménil D, Dautry F, Kress M. Targeting the kinesin Eg5 to monitor siRNA transfection in mammalian cells. Biotechniques. 2002;33:1244-1248. [PubMed] |
| 3. | Beale G, Hollins AJ, Benboubetra M, Sohail M, Fox SP, Benter I, Akhtar S. Gene silencing nucleic acids designed by scanning arrays: anti-EGFR activity of siRNA, ribozyme and DNA enzymes targeting a single hybridization-accessible region using the same delivery system. J Drug Target. 2003;11:449-456. [PubMed] [DOI] |
| 4. | Katoh S, Matsumoto N, Kawakita K, Tominaga A, Kincade PW, Matsukura S. A role for CD44 in an antigen-induced murine model of pulmonary eosinophilia. J Clin Invest. 2003;111:1563-1570. [PubMed] [DOI] |
| 5. | Sheehy MR. A flow-cytometric method for quantification of neurolipofuscin and comparison with existing histological and biochemical approaches. Arch Gerontol Geriatr. 2002;34:233-248. [PubMed] [DOI] |
| 7. | Fujita Y, Kitagawa M, Nakamura S, Azuma K, Ishii G, Higashi M, Kishi H, Hiwasa T, Koda K, Nakajima N. CD44 signaling through focal adhesion kinase and its anti-apoptotic effect. FEBS Lett. 2002;528:101-108. [PubMed] [DOI] |
| 9. | Li Y, Raffo AJ, Drew L, Mao Y, Tran A, Petrylak DP, Fine RL. Fas-mediated apoptosis is dependent on wild-type p53 status in human cancer cells expressing a temperature-sensitive p53 mutant alanine-143. Cancer Res. 2003;63:1527-1533. [PubMed] |
| 10. | Meli M, D'Alessandro N, Tolomeo M, Rausa L, Notarbartolo M, Dusonchet L. NF-kappaB inhibition restores sensitivity to Fas-mediated apoptosis in lymphoma cell lines. Ann N Y Acad Sci. 2003;1010:232-236. [PubMed] [DOI] |
| 11. | Eberle J, Fecker LF, Hossini AM, Wieder T, Daniel PT, Orfanos CE, Geilen CC. CD95/Fas signaling in human melanoma cells: conditional expression of CD95L/FasL overcomes the intrinsic apoptosis resistance of malignant melanoma and inhibits growth and progression of human melanoma xenotransplants. Oncogene. 2003;22:9131-9141. [PubMed] [DOI] |
| 12. | Brun P, Panfilo S, Daga Gordini D, Cortivo R, Abatangelo G. The effect of hyaluronan on CD44-mediated survival of normal and hydroxyl radical-damaged chondrocytes. Osteoarthritis Cartilage. 2003;11:208-216. [DOI] |
| 13. | Luan X, Diekwisch TG. CP27 affects viability, proliferation, attachment and gene expression in embryonic fibroblasts. Cell Prolif. 2002;35:207-219. [PubMed] [DOI] |
| 14. | Terpe HJ, Störkel S, Zimmer U, Anquez V, Fischer C, Pantel K, Günthert U. Expression of CD44 isoforms in renal cell tumors. Positive correlation to tumor differentiation. Am J Pathol. 1996;148:453-463. [PubMed] |
| 15. | Zagorianakou N, Stefanou D, Makrydimas G, Zagorianakou P, Briasoulis E, Karavasilis B, Agnantis NJ. CD44s expression, in benign, borderline and malignant tumors of ovarian surface epithelium. Correlation with p53, steroid receptor status, proliferative indices (PCNA, MIB1) and survival. Anticancer Res. 2004;24:1665-1670. [PubMed] |
| 16. | Lewy-Trenda I, Omulecka A, Janczukowicz J, Papierz W. CD44 expression in human meningiomas: an immunohistochemical analysis. Pol J Pathol. 2004;55:33-37. [PubMed] |
| 17. | Kawano T, Nakamura Y, Yanoma S, Kubota A, Furukawa M, Miyagi Y, Tsukuda M. Expression of E-cadherin, and CD44s and CD44v6 and its association with prognosis in head and neck cancer. Auris Nasus Larynx. 2004;31:35-41. [PubMed] [DOI] |
| 19. | Serra M, Rabanal RM, Miquel L, Domenzain C, Bassols A. Differential expression of CD44 in canine melanocytic tumours. J Comp Pathol. 2004;130:171-180. [PubMed] [DOI] |
| 20. | Bockhorn M, Roberge S, Sousa C, Jain RK, Munn LL. Differential gene expression in metastasizing cells shed from kidney tumors. Cancer Res. 2004;64:2469-2473. [DOI] |
| 21. | Zhang JC, Wang ZR, Cheng YJ, Yang DZ, Shi JS, Liang AL, Liu NN, Wang XM. Expression of proliferating cell nuclear antigen and CD44 variant exon 6 in primary tumors and corresponding lymph node metastases of colorectal carcinoma with Dukes' stage C or D. World J Gastroenterol. 2003;9:1482-1486. [PubMed] [DOI] |
| 22. | Rioux-Leclercq N, Epstein JI, Bansard JY, Turlin B, Patard JJ, Manunta A, Chan T, Ramee MP, Lobel B, Moulinoux JP. Clinical significance of cell proliferation, microvessel density, and CD44 adhesion molecule expression in renal cell carcinoma. Hum Pathol. 2001;32:1209-1215. [PubMed] [DOI] |
| 23. | Zolota V, Tsamandas AC, Melachrinou M, Batistatou A, Scopa C. Expression of CD44 protein in renal cell carcinomas: association with p53 expression. Urol Oncol. 2002;7:13-17. [PubMed] [DOI] |
| 24. | Singleton PA, Bourguignon LY. CD44 interaction with ankyrin and IP3 receptor in lipid rafts promotes hyaluronan-mediated Ca2+ signaling leading to nitric oxide production and endothelial cell adhesion and proliferation. Exp Cell Res. 2004;295:102-118. [PubMed] [DOI] |
| 25. | Termeer C, Averbeck M, Hara H, Eibel H, Herrlich P, Sleeman J, Simon JC. Targeting dendritic cells with CD44 monoclonal antibodies selectively inhibits the proliferation of naive CD4+ T-helper cells by induction of FAS-independent T-cell apoptosis. Immunology. 2003;109:32-40. [DOI] |
| 26. | Singleton PA, Bourguignon LY. CD44v10 interaction with Rho-kinase (ROK) activates inositol 1,4,5-triphosphate (IP3) receptor-mediated Ca2+ signaling during hyaluronan (HA)-induced endothelial cell migration. Cell Motil Cytoskeleton. 2002;53:293-316. [PubMed] [DOI] |