修回日期: 2004-08-20
接受日期: 2004-08-30
在线出版日期: 2004-11-15
目的: 观察胃癌细胞系MGC803乏氧不同时间细胞周期、抑癌基因PTEN、线粒体ATP6(mtATP6)和线粒体Cyt-b(mtCyt-b)mRNA及VEGF、EGFR蛋白表达变化.
方法: 将MGC803细胞(1.0×1010 /L)施加乏氧(10 mL/L O2)处理0, 2, 8, 16, 24 h. 应用RT-PCR, Western blot, 流式细胞术对MGC803细胞进行检测.
结果: MGC803细胞乏氧0, 2, 8, 16, 24 h时ATP6 mRNA表达量为78.22%, 69.28%, 84.40%, 39.84%, 42.52%; Cyt-b mRNA为83.40%, 75.87%, 64.57%, 79.05%, 77.44%; PTEN mRNA为23.93%, 26.52%, 35.74%, 40.31%, 49.92%; VEGF蛋白表达量为16.1, 16.5, 18.2, 20.6, 27.5; EGFR蛋白为14.3, 17.2, 18.1, 32.6, 37.7. 结果显示乏氧后ATP6 mRNA表达水平下降, 8 h后又升高, 以后随着时间的延长, ATP6 mRNA再次下降; Cyt-b mRNA乏氧8 h出现一过性下降, 24 h又恢复到乏氧前水平; PTEN mRNA、VEGF和EGFR蛋白表达水平随乏氧时间延长也逐渐增加, 乏氧24 h表达最高; 乏氧使MGC803细胞发生G1期阻滞, 凋亡细胞增多, S期细胞减少, 但24 h后细胞周期分布基本恢复至乏氧前水平, 乏氧时间与MGC803细胞周期的改变无相关性(P>0.05).
结论: 乏氧使MGC803细胞发生一过性G1期阻滞, 增加PTEN mRNA和VEGF、EGFR蛋白表达, 降低mtATP6 mRNA的表达.
引文著录: 李建军, 李宏宇, 辛彦, 陈延治, 李光, 刘意, 张素敏, 吴东瑛. 乏氧对胃癌细胞系MGC803细胞周期、乏氧相关基因和蛋白表达的影响. 世界华人消化杂志 2004; 12(11): 2539-2542
Revised: August 20, 2004
Accepted: August 30, 2004
Published online: November 15, 2004
AIM: To investigate the effect of hypoxia on cell cycle, expression of mitochondrion ATP6 (mtATP6), mitochondrion Cyt-b (mtCyt-b), PTEN mRNA, vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) protein in human gastric cancer cell line MGC803.
METHODS: The MGC803 cells were exposed to anoxic environment for 0, 2, 8, 16, 24 h. The cell cycle was measured by flow cytometry, and the expression of mtATP6, mtCyt-b and PTEN mRNA was detected by reverse transcription polymerase chain reaction (RT-PCR). Expression of VEGF and EGFR protein was determined by Western blot assay.
RESULTS: At 0, 2, 8, 16, and 24 h hypoxia, the rates of ATP6 mRNA expression of MGC803 cells were 78.22%, 69.28%, 84.40%, 39.84% and 42.52% respectively; Cyt-b mRNA expression was 83.40%, 75.87%, 64.57%, 79.05% and 77.44% respectively; PTEN mRNA expression was 23.93%, 26.52%, 35.74%, 40.31% and 49.92% respectively; VEGF protein expression was 16.1, 16.5, 18.2, 20.6, 27.5 and EGFR protein expression was 14.3, 17.2, 18.1, 32.6 and 37.7 respectively. The expression of PTEN mRNA, VEGF and EGFR proteins in vitro increased with the extending of hypoxia time. Expression of mtATP6 mRNA at 24 h was significantly reduced as compared with that under normal oxygen condition, and mtCyt-b mRNA was transiently reduced at 8 h but returned to normal level at 24 h. The MGC803 G1 phase cells and apoptotic cells transiently increased after hypoxia as compared with those under normal oxygen condition. However, distribution of cell cycle at 24 h was similar to that under normal oxygen condition. There was no significant relation between hypoxia time and changes of cell cycles (P > 0.05).
CONCLUSION: Hypoxia transiently prolongs MGC803 G1 phase and increases apoptotic rate of MGC803 cells. It up-regulates the expression of PTEN mRNA, VEGF and EGFR protein, and down-regulates the expression of mtATP6 mRNA.
- Citation: Li JJ, Li HY, Xin Y, Chen YZ, Li G, Liu Y, Zhang SM, Wu DY. Effect of hypoxia on cell cycleand gene and protein expression in gastric cancer cell line MGC803. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2539-2542
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2539.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2539
乏氧是实体性肿瘤物理微环境的基本特征之一, 乏氧不但可以诱导肿瘤细胞对放疗及化疗的耐受性, 同时可促进肿瘤进展, 越来越多的证据表明乏氧是决定恶性肿瘤预后的重要因素[1-2]. 有研究表明, 抑癌基因与细胞骨架蛋白tensin同源在肿瘤的10号染色体有缺失的磷酸脂酶(phosphatase and tensin homologue deleted on chromosome ten, PTEN)抑制肿瘤增生及分裂[3-6], 线粒体呼吸链和细胞色素氧化酶在细胞中感受氧浓度、诱导一些乏氧相关基因表达方面起作用[7]. 我们通过观察胃癌细胞系MGC803乏氧不同时间细胞周期, PTEN、线粒体ATP6(mtATP6)和线粒体(mt Cyt-b)mRNA及血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、表皮生长因子受体(epidermal growth factor receptor, EGFR)蛋白表达的变化, 探讨乏氧对MGC803细胞基因、蛋白及细胞周期表达的影响.
人胃癌细胞系MGC803为中国医科大学附属第一医院肿瘤研究所保存, 用含100 mL/L胎牛血清(中国医学科学院血液研究所, 北京)、0.3 g/L谷氨酰胺、100 kU/L青霉素和0.1 g/L链霉素的RPMI 1640培养液(Gibco公司, 美国)进行单层传代培养, 置37℃, 50 mL/L CO2培养箱内, 取指数生长期细胞进行实验. 将MGC803细胞分成乏氧0, 2, 8, 16, 24 h组. 将含有10 mL/L O2, 50 mL/L CO2, 940 mL/L N2的混合气体通入装有无菌PBS(0.1 μmol/L)缓冲液的瓶中, 密闭瓶盖上并联插入2组培养瓶, 每组在预先设定乏氧时间分别串联密闭的培养瓶, 每个培养瓶塞上插入一个带阀门的针头, 通气时将带注射针头的阀门打开, 尽快将空气排空, 从入气口输入混合气20 min(流量3 L/min), 使气体达到平衡后减少混合气流量至0.1 L/min, 维持装置内低氧状态.
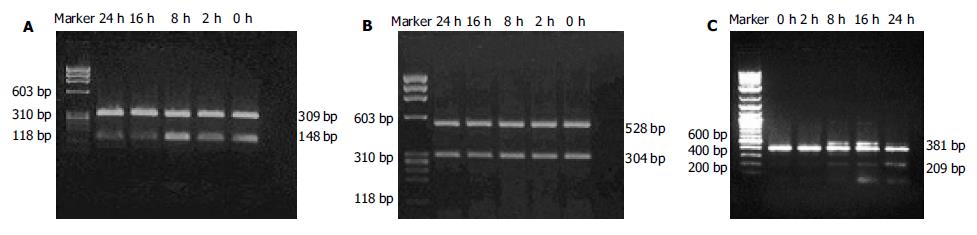
1.2.1 RT-PCR: MGC803细胞经不同时间乏氧后, 用2.5 g/L胰蛋白酶消化并收集培养的细胞, 制成细胞悬液并计算细胞数, 每个样本收集等量细胞(3.0×106), 按试剂盒说明书操作提取总RNA, 总RNA沉淀溶于1 g/L DEPC处理过的无RNA酶蒸馏水中, -80 ℃保存. 根据Primer5软件进行引物设计: mtATP(148 bp), F: 5'-CGCCTAACCGCCTAACATTAC-3', R: 5'-AGGCGACAGCGATTTCTA-3', β-actin(309 bp), F: 5'-AGCGGGAAATCGTGCGTG-3', R: 5'-CAGGGTACATGGTGGTGCC-3', mtCyt-b (304 bp), F:5'-GCGCCTCAAATATTCTTTA-3', R: 5'-GAAGGGCAAGATGAAGT-3', GAPDH(528bp), F: 5'-ACCACCATGGAGAAGGCTGG-3', R: 5'-CTCAGTGTAGCCCAGGATGC-3', PTEN(209bp), F: 5'-CATTATGACACCGCCAAA-3', R: 5'-TTGCCCCGATGTAATAAA-3', β-actin(381 bp), F: 5'-ACACTGTGCCCATCTACGAGG-3', R: 5'-CTTTGCGGATGTCCACGTC-3', 引物由上海生工公司合成. 取总RNA 2μL作为模板, 加入随机引物2 μL(1 μmol/L), 总反应体系为20 μL, 采用AMV逆转录酶18.34 nkat(Takara公司)将总mRNA反转录成cDNA; 取反转录反应液5 μL分别加入上述各引物, 采用日本Takara公司试剂盒将cDNA产物分别进行PCR扩增. PCR反应条件为: 94 ℃ 4 min变性, 循环条件为94 ℃ 30 s, 56 ℃ 40 s, 72 ℃ 40 s, 30次循环, 72 ℃延伸5 min, 反应体系为50 μL. 取PCR产物10 μL经15 g/L琼脂糖凝胶电泳后, 溴化乙啶染色, 应用ChemiImage 5500自动成像分析仪对DNA电泳条带进行分析, 测定各条带的面积和灰度值, 得出积分灰度值, 计算各个样品mtATP/β-actin, mtCyt-b/GAPDH, PTEN/β-actin比值作为 mRNA表达的相对定量.
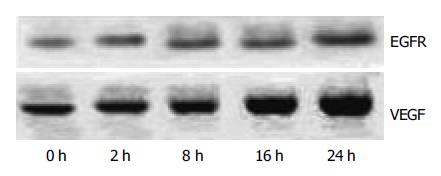
1.2.2 Western blot: 胃癌MGC803细胞经不同时间乏氧后, 用2.5 g/L胰蛋白酶消化贴壁细胞, 制成细胞悬液计算细胞数, 每个样本收集等量细胞(5.0×106), 参照美国Santa Cruz公司提供的方法提取蛋白质. 以120 g/L聚丙稀酰胺凝胶电泳分离蛋白, 然后转印到硝酸纤维素膜上, 取下硝酸纤维膜后加入100 g/L脱脂奶粉封闭, 分别加入一抗工作液鼠抗人VEGF mAb(Santa Cruz公司, 工作浓度1:500)和鼠抗人EGFR mAb(福州迈新生物公司, 即用型), 4 ℃过夜, 加入辣根过氧化物酶标记的二抗(兔抗鼠1:5 000稀释, 北京中山公司), ECL发光试剂(北京中山公司)进行显像, 应用ChemiImage5500自动成像分析仪对蛋白条带进行灰度相对强度测定, 得出积分灰度值, 以积分值代表蛋白的表达量.
1.2.3 流式细胞仪分析: 利用流式细胞仪分析MGC803细胞在不同乏氧时间后细胞周期的变化. 取各组乏氧培养细胞, 2.5 g/L胰酶消化后, 4 ℃ PBS(0.1 μmol/L)吹成单细胞悬液, 800 r/min离心8 min, 4 ℃ PBS洗2次(800 r/min×3 min), -20 ℃预冷700 mL/L乙醇4 ℃固定24 h, 染色前800 r/min 离心5 min, PBS垂悬后800 r/min 再离心5 min, 弃上清, PBS 1 000 μL垂悬, 加RNA酶(10 g/L) 20 μL混匀后37 ℃作用40 min, 800 r/min 离心5 min, PBS垂悬后800 r/min 再离心5 min, 洗去RNA酶, PBS 100 μL垂悬, 加10 mg/L PI染液100 μL, 4 ℃避光30 min, 测定前用400目尼龙膜过滤标本, FACScan(Becton Dickinson, 美国)流式细胞仪于488 nm激发光测定细胞周期分布.
统计学处理 以SPSS10.0统计软件包进行Spearman二重变量非参数相关分析.
PTEN mRNA的表达水平随乏氧时间延长而增加, 至乏氧24 h达最高点; 乏氧开始后mtATP6 mRNA表达水平下降, 乏氧8 h后mtATP6 mRNA表达水平又升高, 以后随着时间的延长, mtATP6 mRNA再次下降, 乏氧24 h后mtATP6 mRNA较乏氧前的表达水平下降一半; mtCyt-b mRNA乏氧8 h出现一过性下降, 24 h后又恢复到乏氧前水平(表1, 图1A-1C).
| 乏氧时间/h(%) | |||||
| 0 | 2 | 8 | 16 | 24 | |
| mtATP6/β-actin | 78.22 | 69.28 | 84.40 | 39.84 | 42.52 |
| mtCyt-b/GAPDH | 83.40 | 75.87 | 64.57 | 79.05 | 77.44 |
| PTEN/β-actin | 23.93 | 26.52 | 35.74 | 40.31 | 49.92 |
经0, 2, 8, 16, 24 h乏氧培养MGC803细胞VEGF蛋白相对含量分别为16.1, 16.5, 18.2, 20.6, 27.5; EGFR蛋白相对含量分别为14.3, 17.2, 18.1, 32.6, 37.7. 结果显示VEGF蛋白的水平随乏氧时间延长而增加, 至乏氧培养的24 h达到最高. 乏氧在诱导VEGF蛋白表达的同时也增加了EGFR蛋白的表达(图2).
乏氧培养的MGC803细胞发生细胞周期G1期阻滞, 随着时间延长, G1期阻滞逐渐增加, 16 h达到高峰, 但24 h后, G1期恢复到乏氧前水平; 与G1期相反, S期细胞逐渐减少至16 h达最低, 24 h后基本恢复至乏氧前水平, G2/M期细胞在乏氧后也表现为增加, 但总体变化不明显. 乏氧时间与MGC803细胞周期的改变无相关性(P>0.05, 表2).
| 乏氧时间 | G1期 | G2/M期 | S期 | 凋亡细胞 |
| 0 h | 59.12±0.98 | 12.35±0.58 | 26.52±1.56 | 2.01±0.10 |
| 2 h | 62.58±1.91 | 13.64±0.93 | 21.42±1.09 | 2.36±0.08 |
| 8 h | 65.67±1.02 | 15.45±2.97 | 11.86±1.38 | 7.02±0.55 |
| 16 h | 70.12±2.45 | 15.79±0.90 | 10.23±1.20 | 2.38±0.57 |
| 24 h | 60.93±1.64 | 14.07±1.40 | 21.86±0.51 | 3.14±0.14 |
乏氧对细胞有广泛的影响, 可导致ATP水平迅速下降; G1期细胞周期检测点被激活; DNA复制被抑制, 蛋白质合成减慢, 分解增加, 但氧相关蛋白合成相对增加. 另外, 包括调节增生, 血管形成和死亡的信号传导途径被激活. 肿瘤细胞适应这些变化后, 在乏氧情况下存活甚至生长, 而肿瘤细胞的乏氧状态与预后不良和放射抵抗相关[8]. MGC803细胞乏氧后PTEN mRNA、VEGF和EGFR蛋白表达增加, ATP6 mRNA表达下降, Cyt-b mRNA变化不明显. 我们认为线粒体呼吸链上mtCyt-b mRNA的表达水平的一过性下降是细胞对乏氧的适应性调节, mtCyt-b不是乏氧诱导的相关基因. 乏氧可激活丝裂源激活的蛋白激酶(mitogen-activated- protein-kinases, MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)等传导通路, 通过乏氧诱导因子1α (hypoxia- inducible factor1α, HIF-1α)的增加, 上调VEGF的表达[9-10], 同时也会反馈性的引起PTEN mRNA表达水平的增高, 抑制PI3K通路过度活化[11]. 如果肿瘤细胞PTEN基因缺失或突变, 不能拮抗由乏氧引起的PI3K通路的激活, 使VEGF的表达持续升高[12]. 乏氧早期导致了mtATP6 mRNA表达的下降, 但同时激活诱导mtATP6 mRNA表达的相关基因, 造成随后mtATP6 mRNA表达升高, 以后随着乏氧时间的延长, mtATP6 mRNA表达降至正常水平以下. 组成mtATP合成酶质子膜通道部分的3个亚单位多肽(ATP6, ATP8和ATP9)由染色体基因组编码, 其中mtATP6对维持线粒体基因组的稳定性起到重要作用[13], 长时间的乏氧会降低ATP6 mRNA的表达, 影响染色体基因组的稳定性. 另外, Chandel et al[14]进一步研究表明染色体基因组在上调乏氧相关基因表达的过程中起到重要作用, 由HIF-1α调控的乏氧诱导的一系列基因的表达需要线粒体的参与. 祝亚平et al[15]将卵巢癌细胞系SKOV-3ipl乏氧培养后G1期细胞阻滞, 与本结果基本一致. 在G1期细胞增多的同时, G2/M期及凋亡细胞也逐渐增多而S期细胞减少, 这种变化仅发生于乏氧后2-16 h内, 24 h后各细胞周期比例又恢复到有氧培养水平. 我们推测在乏氧2-16 h内发生的细胞周期改变(主要为G1期阻滞)只是细胞在乏氧条件下产生的适应性改变.
乏氧可以引起肿瘤细胞死亡/凋亡. 在检测细胞周期前, 我们通过倒置显微镜观察到随着乏氧时间的延长, 漂浮细胞逐渐增多, 16-24 h达高峰, 这可能与乏氧诱导死亡及凋亡的信号传导途径被激活有关. 我们用于检测细胞周期的细胞取材于乏氧后仍能贴壁的细胞, 漂浮细胞已在收集前去除. 结果显示随着乏氧时间的增加, 凋亡细胞也逐渐增多, 乏氧8 h时最高, 以后慢慢回落. 近年来的研究发现乏氧在诱导一部分肿瘤产生凋亡的同时, 可以使另一部分肿瘤细胞对乏氧产生耐受, 抗凋亡[16], 具体的生物学机制尚不清楚. 有学者认为G1期细胞对乏氧极度耐受, 细胞周期的改变, 特别是G1期阻滞, 曾被认为是肿瘤细胞逃避乏氧凋亡的重要机制, Kinoshita et al[16]认为乏氧可诱导抗凋亡基因bcl-2的表达, 从而获得凋亡抵抗. 我们并未发现乏氧后G1期细胞的改变与凋亡之间具有相关性. 乏氧诱导相关基因和蛋白的表达以不同方式参与了肿瘤细胞对乏氧的适应过程, 增强肿瘤细胞在乏氧环境下的生存能力[17]. 我们的研究发现乏氧可增加PTEN mRNA的表达, 增加乏氧诱导细胞凋亡的能力[18], 抑制肿瘤细胞的生长和增生, 我们考虑乏氧诱导VEGF, EGFR蛋白的高表达, 很可能就是引起乏氧细胞对放射抵抗的原因之一. 乏氧是肿瘤发生恶性转化、促进肿瘤细胞的生长、浸润和转移等恶性生物学行为发生的始动因素[19-22].
编辑: N/A
| 1. | Vaupel P, Kelleher DK, Höckel M. Oxygen status of malignant tumors: pathogenesis of hypoxia and significance for tumor therapy. Semin Oncol. 2001;28:29-35. [PubMed] [DOI] |
| 2. | Vaupel P, Höckel M. [Hypoxia in cervical cancer: pathogenesis, characterization, and biological/clinical consequences]. Zentralbl Gynakol. 2001;123:192-197. [PubMed] [DOI] |
| 3. | Yang L, Kuang LG, Zheng HC, Li JY, Wu DY, Zhang SM, Xin Y. PTEN encoding product: a marker for tumorigenesis and progression of gastric carcinoma. World J Gastroenterol. 2003;9:35-39. [PubMed] [DOI] |
| 4. | Kandel ES, Skeen J, Majewski N, Di Cristofano A, Pandolfi PP, Feliciano CS, Gartel A, Hay N. Activation of Akt/protein kinase B overcomes a G(2)/m cell cycle checkpoint induced by DNA damage. Mol Cell Biol. 2002;22:7831-7841. [PubMed] [DOI] |
| 5. | Wan XY, Shi YF, Li JQ. [Inhibitory effect of tumor suppressor PTEN on cell growth of endometrial carcinoma]. Zhonghua Zhongliu Zazhi. 2004;26:275-278. [PubMed] |
| 6. | Panigrahi AR, Pinder SE, Chan SY, Paish EC, Robertson JF, Ellis IO. The role of PTEN and its signalling pathways, including AKT, in breast cancer; an assessment of relationships with other prognostic factors and with outcome. J Pathol. 2004;204:93-100. [PubMed] [DOI] |
| 7. | Dagsgaard C, Taylor LE, O'Brien KM, Poyton RO. Effects of anoxia and the mitochondrion on expression of aerobic nuclear COX genes in yeast: evidence for a signaling pathway from the mitochondrial genome to the nucleus. J Biol Chem. 2001;276:7593-7601. [PubMed] [DOI] |
| 8. | Harris AL. Hypoxia--a key regulatory factor in tumour growth. Nat Rev Cancer. 2002;2:38-47. [PubMed] [DOI] |
| 9. | Jiang YA, Fan LF, Jiang CQ, Zhang YY, Luo HS, Tang ZJ, Xia D, Wang M. Expression and significance of PTEN, hypoxia-inducible factor-1 alpha in colorectal adenoma and adenocarcinoma. World J Gastroenterol. 2003;9:491-494. [PubMed] [DOI] |
| 10. | Zhong H, Chiles K, Feldser D, Laughner E, Hanrahan C, Georgescu MM, Simons JW, Semenza GL. Modulation of hypoxia-inducible factor 1alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics. Cancer Res. 2000;60:1541-1545. [PubMed] |
| 11. | Brader S, Eccles SA. Phosphoinositide 3-kinase signalling pathways in tumor progression, invasion and angiogenesis. Tumori. 2004;90:2-8. [PubMed] |
| 12. | Zhou YJ, Xiong YX, Wu XT, Shi D, Fan W, Zhou T, Li YC, Huang X. Inactivation of PTEN is associated with increased angiogenesis and VEGF overexpression in gastric cancer. World J Gastroenterol. 2004;10:3225-3229. [PubMed] [DOI] |
| 13. | Contamine V, Picard M. Maintenance and integrity of the mitochondrial genome: a plethora of nuclear genes in the budding yeast. Microbiol Mol Biol Rev. 2000;64:281-315. [PubMed] [DOI] |
| 14. | Chandel NS, Schumacker PT. Cellular oxygen sensing by mitochondria: old questions, new insight. J Appl Physiol (1985). 2000;88:1880-1889. [PubMed] |
| 16. | Kinoshita M, Johnson DL, Shatney CH, Lee YL, Mochizuki H. Cancer cells surviving hypoxia obtain hypoxia resistance and matain anti-apoptotic potential under reoxygenation. Int J Cancer. 2001;91:322-326. [DOI] |
| 17. | Stoeltzing O, McCarty MF, Wey JS, Fan F, Liu W, Belcheva A, Bucana CD, Semenza GL, Ellis LM. Role of hypoxia-inducible factor 1alpha in gastric cancer cell growth, angiogenesis, and vessel maturation. J Natl Cancer Inst. 2004;96:946-956. [PubMed] [DOI] |
| 18. | Osaki M, Oshimura M, Ito H. PI3K-Akt pathway: its functions and alterations in human cancer. Apoptosis. 2004;9:667-676. [PubMed] [DOI] |
| 19. | Dachs GU, Tozer GM. Hypoxia modulated gene expression: angiogenesis, metastasis and therapeutic exploitation. Eur J Cancer. 2000;36:1649-1660. [DOI] |
| 20. | Jögi A, Øra I, Nilsson H, Lindeheim A, Makino Y, Poellinger L, Axelson H, Påhlman S. Hypoxia alters gene expression in human neuroblastoma cells toward an immature and neural crest-like phenotype. Proc Natl Acad Sci USA. 2002;99:7021-7026. [PubMed] [DOI] |
| 22. | Wykoff CC, Beasley NJ, Watson PH, Turner KJ, Pastorek J, Sibtain A, Wilson GD, Turley H, Talks KL, Maxwell PH. Hypoxia-inducible expression of tumor-associated carbonic anhydrases. Cancer Res. 2000;60:7075-7083. [PubMed] |