修回日期: 2004-08-09
接受日期: 2004-08-25
在线出版日期: 2004-10-15
目的: 探讨大肠癌淋巴结微转移免疫组化检出率及淋巴结微转移与临床预后的关系.
方法: 应用抗细胞角蛋白(CK)和癌胚抗原(CEA)mAb, 对82例大肠癌(Dukes'B期)根治术后经病理常规检查为转移阴性的667枚淋巴结进行免疫组化(SP法)检测, 结合随访资料进行临床预后分析.
结果: 转移阴性的82例667枚淋巴结中, 18例(21.9%, 18/82)42枚(6.3%, 42/667)淋巴结中发现微小转移的癌细胞, 其中13例10年内因局部复发和远处转移死亡. 64例免疫组化检测阴性的患者仅24例复发死亡. 免疫组化诊断微转移阳性和阴性组10年生存率分别是27.8%(5/18)和62.5%(40/64). 差异非常显著(P <0.05).
结论: 应用肿瘤特异性抗体检测常规病理检查阴性的淋巴结有助于发现微小转移的癌细胞, 对估计临床预后, 指导治疗有重要意义.
引文著录: 于雁, 毛银玲, 尚丽华. 大肠癌淋巴结微转移免疫组化检测与预后关系. 世界华人消化杂志 2004; 12(10): 2504-2506
Revised: August 9, 2004
Accepted: August 25, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2504-2506
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2504.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2504
淋巴结微转移是指常规检查难以发现的微小转移灶. 淋巴结微转移在常规HE染片中极难发现.免疫组化技术的出现和发展, 为发现淋巴结微转移提供了一项先进可靠的方法[1-2]. 大肠癌是我国常见的恶性肿瘤, 无淋巴结转移的大肠癌5年生存率一般在70-80%, 而有转移者仅为30%. 因此, 确定大肠癌有无转移对判断患者预后及指导治疗至关重要. 我们采用肿瘤mAb免疫组织化学技术对82例结肠癌患者的667枚常规病理诊断阴性的淋巴结进行检测, 目的在于探讨大肠癌患者术后复发及其预后的关系, 为大肠癌临床治疗提供依据.
1991/1993年哈尔滨医科大学附属肿瘤医院腹外科行大肠癌根治术的患者病理存档石蜡包埋组织块.病例选择条件:均行大肠癌根治术(清扫各组淋巴结), 并有确切的病理诊断. 均为病理诊断阴性的淋巴结. 均为诊断Dukes'B期大肠癌的患者. 均为原发性大肠癌并首次接受外科治疗者.均为随访中患者. 每个病例均具有完整的临床病史资料, 病理诊断和随访资料. 参照《中国常见恶性肿瘤诊治规范大肠癌分册》的标准, 进行病理诊断观察组织分类, 组织学分级和浸润等指标. 随访时间在2-11年, 男64例, 女18例. 年龄30-74 (平均54.5岁). 随访结果分为带瘤和死亡.
应用SP法进行免疫组化染色. 石蜡切片, 常规脱蜡至水. 30 mL/L过氧化氢孵育5-10 min, 以消除内源性过氧化物酶的活性.蒸馏水冲洗, PBS浸泡5 min.滴加试剂1(蓝色液体)室温孵育10-15 min, 倾去. 滴加适当比例稀释的一抗, 37 ℃孵育1-2 h或4℃过夜. PBS冲洗, 3 min×3次. 滴加试剂2(黄色液体), 室温或37 ℃孵育10-15 min. PBS冲洗, 3 min×3次. 滴加试剂C(橙色液体), 室温或37 ℃孵育10-15 min. PBS冲洗, 3 min×3次. 显色剂显色(DAB或AEC). 自来水充分冲洗, 复染, 封片. 以细胞膜或细胞质内出现棕色颗粒为阳性细胞. 强阳性(+++)胞质呈深棕色; 阳性(++), 胞质呈棕色; 弱阳性(+), 胞质呈浅黄色; 阴性(-)胞质不着色. 对免疫组化检测阳性及阴性组复发率用SPSS10.0软件统计.
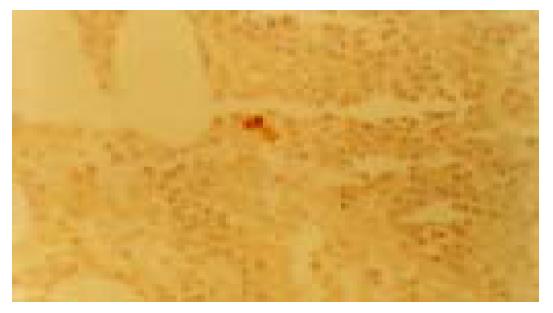
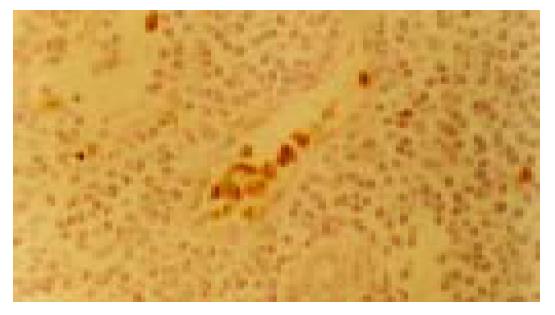
在82例667枚淋巴结中CEA, CKmAb标记后18例42枚淋巴结内发现微小转移灶, 其中16例38枚淋巴结内可见CEA阳性的癌细胞, 17例36枚淋巴结内有CK阳性的细胞, 18例中6例24枚淋巴结内CEA, CK同时为阳性. CEA, CK阳性细胞成小灶状, 三五成群散在分布(图1), 部分以单个细胞形式存在(图2). 患者总阳性率为21.9%(18/82), 淋巴结总阳性率为6.29%(42/667).18例微转移者12例原发灶为中分化腺癌, 6例为低分化腺癌.
患者平均追踪时间为6.5年表明18例淋巴结微转移者13例10年内因局部复发和远处转移而死亡. 5例尚生存. 淋巴结标记阴性者64例中40例存活, 24例死亡. 10年生存率分别是27.8%(5/18)和62.5%(40/64), 差异显著(P <0.05).
大肠癌有无淋巴结转移是确定临床分期及术后辅助治疗方法的重要依据, 也是影响患者预后的主要因素[3-6]. 常规方法不能查及淋巴结的大部分组织, 故有可能忽略淋巴结微转移的存在. 由于这些微转移有发展成致命的显性转移的可能, 因此微转移的检测日益为人们所重视, 并已成为目前研究的热点[7-8]. 正确认识和判断有无转移以及转移的途径和范围, 对临床诊断、治疗及预后的判断具有十分重要的应用[9-11]. 过去人们对转移的检测主要依靠常规组织学方法以及超声、CT、MRI等物理学检查手段[12], 这些方法敏感性太低, 不能检测体内存在的微转移. 今年来免疫组化和分子生物学技术的发展, 使得微转移的检测成为可能[13-14]. 我们用免疫组化方法检测淋巴结中CK20和CEA抗原的表达, 可以准确评价大肠癌患者淋巴结中微转移的情况. CK20含424个氨基酸, Mr 48 553, 等电点为5.66, 属酸性CK, 其编码DNA总长18 kb, 含8个外显子, 7个内含子. 其mRNA长1.75 Kb, 其在正常组织中不表达, 大肠癌高表达, 且在肿瘤侵袭、转移、扩散到其他组织器官时始终保持稳定. 在非上皮组织中检测到CK20提示存在肿瘤细胞[15-21]. CEA是一种结构复杂的可溶性糖蛋白, Mr 200 000. CEA出现于胚胎时期胃肠黏膜上皮细胞内, 随着胚胎发育成熟, 抗原水平逐渐下降, 乃至消失.当消化道上皮癌变时, 又可合成并分泌这些抗原[22-23].
本组82例常规诊断阴性的667枚淋巴结分别用CEA和CK两种单克隆抗体标记, 结果18例(21.9%, 18/82)42枚(6.3%, 42/667)淋巴结内有阳性细胞. 常规病理检查阴性患者中, 33%出现淋巴结微转移, 本组为6.3%(42/667). 在全部82例中, 共有18例21.9%(18/82)检测出微转移, 与文献报道相仿. 此外, 大肠癌Dukes'B期应为无淋巴结转移的患者, 本组82例中18例淋巴结确认为有淋巴结微转移, 其临床分期应升级为Dukes'C 期, 临床应按Dukes'C期患者进行综合治疗. 10年追踪随访资料结果显示淋巴结免疫组化阳性者和阴性者复发率有明显差异, 表明微小转移与预后密切相关.
虽然目前对微转移癌细胞在体内的转归尚不明确, 但确实有研究发现微转移的出现明显影响大肠癌患者的预后[24-29]. 相信随着微转移癌细胞生物学特征性研究的深入, 微转移的检测会在肿瘤的诊断和治疗中发挥重要作用.
| 1. | Matsumoto M, Natsugoe S, Ishigami S, Uenosono Y, Takao S, Aikou T. Rapid immunohistochemical detection of lymph node micrometastasis during operation for upper gastrointestinal carcinoma. Br J Surg. 2003;90:563-566. [PubMed] |
| 2. | Moore KH, Thaler HT, Tan LK, Borgen PI, Cody HS 3rd. Immunohistochemically detected tumor cells in the sentinel lymph nodes of patients with breast carcinoma: biologic metastasis or procedural artifact? Cancer. 2004;100:929-934. [PubMed] |
| 3. | Demirbaş S, Ince M, Baloğlu H, Celenk T. Should sentinel lymph node mapping be performed for colorectal cancer? Turk J Gastroenterol. 2004;15:39-44. [PubMed] |
| 4. | Fukagawa T, Sasako M, Mann GB, Sano T, Katai H, Maruyama K, Nakanishi Y, Shimoda T. Immunohistochemically detected micrometastases of the lymph nodes in patients with gastric carcinoma. Cancer. 2001;92:753-760. [PubMed] |
| 7. | Yasuda K, Adachi Y, Shiraishi N, Yamaguchi K, Hirabayashi Y, Kitano S. Pattern of lymph node micrometastasis and prognosis of patients with colorectal cancer. Ann Surg Oncol. 2001;8:300-304. [PubMed] |
| 8. | Nagakura S, Shirai Y, Yokoyama N, Hatakeyama K. Clinical significance of lymph node micrometastasis in gallbladder carcinoma. Surgery. 2001;129:704-713. [PubMed] |
| 9. | Ishigami S, Natsugoe S, Tokuda K, Nakajo A, Higashi H, Watanabe T, Aridome K, Hokita S, Aikou T. Clinical impact of micrometastasis of the lymph node in gastric cancer. Am Surg. 2003;69:573-577. [PubMed] |
| 10. | Kronberg U, López-Kostner F, Soto G, Zúñiga A, Wistuba I, Miranda V, Pinto E, Viviani P, Marshall G. Detection of lymphatic micrometastases in patients with stages I and II colorectal cancer: impact on five-year survival. Dis Colon Rectum. 2004;47:1151-1157. [PubMed] |
| 11. | Nakamura T, Ide H, Eguchi R, Hayashi K, Ota M, Takasaki K. Clinical implications of lymph node micrometastasis in patients with histologically node-negative (pN0) esophageal carcinoma. J Surg Oncol. 2002;79:224-229. [PubMed] |
| 13. | Noura S, Yamamoto H, Miyake Y, Kim Bn, Takayama O, Seshimo I, Ikenaga M, Ikeda M, Sekimoto M, Matsuura N, Monden M. Immunohistochemical assessment of localization and frequency of micrometastases in lymph nodes of colorectal cancer. Clin Cancer Res. 2002;8:759-767. [PubMed] |
| 14. | Sasaki M, Watanabe H, Jass JR, Ajioka Y, Kobayashi M, Matsuda K, Hatakeyama K. Occult lymph node metastases detected by cytokeratin immunohistochemistry predict recurrence in "node-negative" colorectal cancer. J Gastroenterol. 1997;32:758-764. [PubMed] |
| 15. | Miyake Y, Yamamoto H, Fujiwara Y, Ohue M, Sugita Y, Tomita N, Sekimoto M, Matsuura N, Shiozaki H, Monden M. Extensive micrometastases to lymph nodes as a marker for rapid recurrence of colorectal cancer: a study of lymphatic mapping. Clin Cancer Res. 2001;7:1350-1357. [PubMed] |
| 16. | Aoki S, Takagi Y, Hayakawa M, Yamaguchi K, Futamura M, Kunieda K, Saji S. Detection of peritoneal micrometastases by reverse transcriptase-polymerase chain reaction targeting carcinoembryonic antigen and cytokeratin 20 in colon cancer patients. J Exp Clin Cancer Res. 2002;21:555-562. [PubMed] |
| 17. | Chen G, McIver CM, Texler M, Lloyd JM, Rieger N, Hewett PJ, Sen Wan D, Hardingham JE. Detection of occult metastasis in lymph nodes from colorectal cancer patients: a multiple-marker reverse transcriptase-polymerase chain reaction study. Dis Colon Rectum. 2004;47:679-686. [PubMed] |
| 18. | Oberg AN, Lindmark GE, Israelsson AC, Hammarström SG, Hammarström ML. Detection of occult tumour cells in lymph nodes of colorectal cancer patients using real-time quantitative RT-PCR for CEA and CK20 mRNAS. Int J Cancer. 2004;111:101-110. [PubMed] |
| 19. | Liu Z, Ye X, Bi W, Wang M, Li Y, Chen T. Detection of occult metastases in lymph nodes from patients with colorectal carcinoma by reverse transcriptase-polymerase chain reaction. Chin Med J (Engl). 2002;115:529-531. [PubMed] |
| 21. | 孙 青, 丁 彦青, 张 福明, 李 国新, 张 素娟. 逆转录聚合酶链反应检测结直肠癌淋巴结微转移. 临床与实验病理学杂志. 2003;19:643-645. |
| 22. | Roma A, Alvarez C, Paes de Lima A, Denninghoff V, Elsner B. [Detection of micrometastases of colorectal carcinoma in lymph nodes]. Medicina (B Aires). 2003;63:399-402. [PubMed] |
| 23. | Mori M, Mimori K, Inoue H, Barnard GF, Tsuji K, Nanbara S, Ueo H, Akiyoshi T. Detection of cancer micrometastases in lymph nodes by reverse transcriptase-polymerase chain reaction. Cancer Res. 1995;55:3417-3420. [PubMed] |
| 24. | Kienle P, Koch M. Are "micrometastases" of the peritoneum equivalent to distant metastases? Dig Surg. 2002;19:453-458. [PubMed] |
| 25. | Yasuda K, Adachi Y, Shiraishi N, Inomata M, Takeuchi H, Kitano S. Prognostic effect of lymph node micrometastasis in patients with histologically node-negative gastric cancer. Ann Surg Oncol. 2002;9:771-774. [PubMed] |
| 26. | Komukai S, Nishimaki T, Watanabe H, Ajioka Y, Suzuki T, Hatakeyama K. Significance of immunohistochemically demonstrated micrometastases to lymph nodes in esophageal cancer with histologically negative nodes. Surgery. 2000;127:40-46. [PubMed] |
| 27. | Yokoyama N, Shirai Y, Hatakeyama K. Immunohistochemical detection of lymph node micrometastases from gallbladder carcinoma using monoclonal anticytokeratin antibody. Cancer. 1999;85:1465-1469. [PubMed] |
| 28. | Shimoyama M, Yamazaki T, Suda T, Hatakeyama K. Prognostic significance of lateral lymph node micrometastases in lower rectal cancer: an immunohistochemical study with CAM5.2. Dis Colon Rectum. 2003;46:333-339. [PubMed] |
| 29. | Noura S, Yamamoto H, Ohnishi T, Masuda N, Matsumoto T, Takayama O, Fukunaga H, Miyake Y, Ikenaga M, Ikeda M. Comparative detection of lymph node micrometastases of stage II colorectal cancer by reverse transcriptase polymerase chain reaction and immunohistochemistry. J Clin Oncol. 2002;20:4232-4241. [PubMed] |