修回日期: 2004-08-21
接受日期: 2004-08-25
在线出版日期: 2004-10-15
目的: 探讨谷氨酰胺(glutamine, Gln)对肝脏缺血再灌注损伤(HIRI)时肝组织热休克蛋白70(HSP70)表达的影响.
方法: ♂Wistar大鼠48只随机分为谷氨酰胺组(G组)及对照组(C组), 谷氨酰胺预处理后建立HIRI模型(以Pringle法阻断入肝血流30 min), Western blotting法检测再灌注后肝组织HSP70表达, 并检测血清ALT, LDH水平以及肝组织病理学改变.
结果: 两组肝组织于再灌注后1 h均仅有微量HSP70表达, 再灌注后24 h HSP70表达明显增强并持续至48 h, 但各时点G组HSP70表达水平明显低于C组; G组血清ALT, LDH水平再灌注后1, 24 h均显著低于C组(1 h: aP <0.05, bP <0.01; 24 h: bP <0.01), 且两组肝酶水平再灌注后24 h均较再灌注后1 h有显著恢复.肝组织损害的病理学改变G组亦明显轻于C组.
结论: Gln对HIRI具有保护作用并能下调HIRI时肝组织中HSP70表达.
引文著录: 徐锋, 戴朝六, 张旭, 贾昌俊, 崔凯, 许永庆, 黄勇, 王明辉. 大鼠肝脏缺血再灌注损伤中谷氨酰胺对HSP70表达的影响. 世界华人消化杂志 2004; 12(10): 2481-2483
Revised: August 21, 2004
Accepted: August 25, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2481-2483
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2481.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2481
肝脏缺血再灌注损伤(HIRI)是肝移植和肝脏外科所面临的一大难题. 入肝血流完全阻断是肝脏外科术中常用的控制出血的方法, 但其可引起门静脉系统(尤其是肠道)淤血, 肝脏恢复血供后淤滞门静脉血再灌注势必造成肝脏再灌注损伤. 谷氨酰胺(Gln)作为条件必需氨基酸, 对多种器官和组织细胞具有独特而重要的代谢功能, 并可维持肠道结构和屏障功能, 减轻内毒素等对肠道的损伤以及增强HSP70的表达[1-3]. 热休克蛋白70(HSP70)是HSP家族的主要成分, 是机体受到应激后产生的蛋白质, 其大量表达可提高细胞的应激能力, 抵御各种有害因素的损伤[1,4-9]. 目前对Gln在HIRI中的作用以及对肝组织HSP70表达影响的研究尚未见报道. 我们应用大鼠HIRI模型, 探讨术前应用Gln对HIRI的作用以及对肝组织HSP70表达的影响.
健康♂Wistar大鼠, 体质量200-300 g, 由中国医科大学附属第二医院动物实验中心提供. 丙氨酰-谷氨酰胺二肽 (力肽), 购自德国费森尤斯中国华瑞制药有限公司. HSP70抗体及碱磷酶标记马抗小鼠 IgG(H+L)均购自北京中山生物技术有限公司.大鼠静脉输液模型的建立: 参照中国人民解放军第三军医大学静脉营养模型[10]. 大鼠术前禁食12 h, 100 g/L乌拉坦按0.1 mL/kg ip麻醉. 模型建立后将大鼠置于代谢笼中, 允许自由活动, 常规进食. 插管后2 h始用微量泵持续输注生理盐水(速度为2 mL/h), 观察3 d. 48只大鼠随机分为两组, 即Gln组(G组)和对照组(C组), 各组24只. G组给予Gln溶液, C组给予生理盐水, 输液速度为2 mL/h, 共3 d, 输液期间常规进食. 第7 d麻醉成功后, 将大鼠置于电热毯上以保持体温在36.5±0.5 ℃. 局部备皮, 消毒, 取正中切口入腹, 离断肝周韧带, 以消除肝脏侧支循环. 用无创伤微血管夹完全阻断门静脉、肝动脉及胆总管(Pringle法), 肝脏持续缺血30 min后松开血管夹, 松动肝门恢复肝血供, 关腹.于再灌注后1, 24及48 h抽3 mL腹主动脉血, 随即用预冷镊子快速夹取一块肝组织, 用锡箔纸包裹置于液氮中保存, 再转至-80 ℃冰箱中保存, 待测HSP70表达;于再灌注后1, 24 h取1 cm×1 cm×0.5 cm大小肝组织, 置于40 g/L甲醛溶液中固定, 备作病理学检查. 血液静置20 min后, 离心10 min (2 500 r/min), 用微量移液器将上清液移至预冷弹头中, 置于-30 ℃冰箱中冷冻保存, 待测生化指标. 处死大鼠.
用全自动生化分析仪测定动脉血清谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)水平. 肝组织块切片后常规HE染色并行光镜观察. Western Blotting法测定肝组织HSP70表达[11].
统计学处理 计量资料用统计软件SPSS11.5进行t检验, 结果用mean±SD表示, P<0.05被认为有统计学意义.
肝脏缺血再灌注后, 两组间血清肝酶水平明显不同. 再灌注1 h, G组血清ALT, LDH水平均显著低于C组(P <0.05; P <0.01); 再灌注24 h, 两组血清ALT, LDH水平均较本组再灌注1 h显著下降, 且G组显著低于C组(P <0.01, 表1).
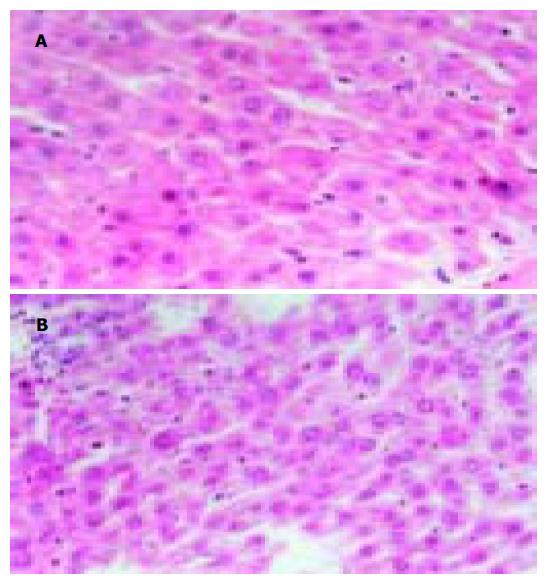
肝脏缺血再灌注后1 h, G组肝细胞仅有轻度肿胀, 少量脂肪变性; 而C组肝细胞则明显肿胀, 胞质内脂肪及空泡样变性较重, 肝窦腔隙明显变窄或消失, 窦内可见大量红细胞, 局部有炎症细胞浸润, 肝包膜下可见出血(图1). 再灌注后24 h, G组肝细胞肿胀变性略有加重, 但肝脏结构尚规整, 局部有点状坏死, 可见核分裂相; 而C组肝脏结构紊乱, 可见片状肝细胞坏死.
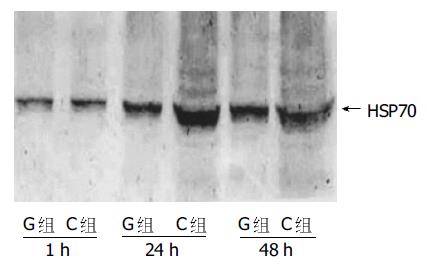
再灌注1 h, 两组肝组织内HSP70均只有轻微表达. 再灌注24 h, C组HSP70表达明显增强, 持续至再灌注48 h仍维持于高水平; G组再灌注24 h肝脏HSP70表达亦有轻度增强并维持至再灌注48 h, 但水平明显低于C组(图2).
肝脏缺血再灌注损伤的防护是肝移植和肝脏外科的难点和热点. 目前常用的防护方法有缺血预处理、低温低氧预处理、药物预处理等, 其中药物预处理是较为热门的防护HIRI的方法, 但至今仍无一种药物能有效地防护HIRI. 谷氨酰胺(Gln)作为条件必需氨基酸, 在肠道、心肌及骨骼肌的缺血再灌注损伤过程中具有保护作用[1,12-20]. 在内毒素休克等应激时补充外源性Gln有利于HSP70表达增强[1,21-22]. 肝脏缺血再灌注后HSP70表达水平、持续时间与应激方法和肝脏病理状态有关, 并在一定范围内HSP70随肝脏损伤程度的加重而表达增强, 随损伤的修复而逐渐消退. HSP70被认为是肝缺血再灌注时肝脏损伤严重程度的敏感指标之一[23-24]. 但目前就Gln在HIRI中的作用以及对肝组织HSP70的表达的影响仍不得而知, 因此通过建立HIRI模型对此进行初步探讨. 我们发现, 肝脏缺血再灌注后不同时点G组血清ALT, LDH水平均显著低于C组, 而且肝组织病理学改变G组亦较C组明显减轻; 两组肝组织再灌注后1 h HSP70均只有轻微表达, 再灌注后24 h HSP70表达均增强并持续至再灌注48 h 仍维持于高水平, 但G组HSP70表达水平明显低于C组.
再灌注后G组血清酶水平和肝组织病理学损害程度均显著低于C组, 说明术前给予Gln能够减轻HIRI. 再灌注后1 h两组肝组织HSP70均只有轻微表达, 原因在于健康肝脏单纯长时间缺血并不能激活HSP70基因, HSP70mRNA只有在肝脏发生缺血再灌注区才有表达, 而在非缺血区则无表达[24-25]. 并且HSP70多于再灌注后6 h左右才有表达增强, 于再灌注24- 48 h达高峰[23,26-27], 这与本实验结果一致. 但本研究G组HSP70表达水平反而明显低于C组, 与肠道等脏器内毒素休克时应用Gln可增强HSP70表达的结果不一致[1,21-22]. 其原因可能为: Gln作为肠道细胞的主要代谢燃料, 术前给予可维持入肝血流完全阻断门静脉系统淤血时小肠黏膜细胞、淋巴细胞及巨噬细胞的代谢和功能, 促进肠黏膜细胞分裂增生, 加快上皮增生与修复, 保护肠黏膜屏障; 并且Gln可增强肠黏膜细胞HSP70表达, 提高其应激能力, 减轻肠道淤血的损伤, 减轻肠道细菌及内毒素易位, 进而抑制了淤滞的门静脉血再灌注对肝脏枯否氏细胞的激活, 抑制了TNF-α, IL-1等细胞因子的释放和氧自由基、活性氧族的产生, 从而减轻了对肝脏的损伤[14,15,18,28-30], 因此与C组相比相对减少了肝脏HSP70基因的激活, 使肝组织HSP70表达水平下降.亦说明HSP70表达水平可以在一定程度上反映缺血再灌注时肝脏的损伤程度.
总之, 术前给予Gln对HIRI具有保护作用, 并能下调肝组织HSP70的表达, 但其调控机制仍有待进一步研究.
| 1. | Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine induces heat shock protein and protects against endotoxin shock in the rat. J Appl Physiol (1985). 2001;90:2403-2410. [PubMed] |
| 2. | Wischmeyer PE. Glutamine and heat shock protein expression. Nutrition. 2002;18:225-228. [PubMed] [DOI] |
| 4. | Oda H, Miyake H, Iwata T, Kusumoto K, Rokutan K, Tashiro S. Geranylgeranylacetone suppresses inflammatory responses and improves survival after massive hepatectomy in rats. J Gastrointest Surg. 2002;6:464-472; discussion 473. [PubMed] [DOI] |
| 5. | Sumioka I, Matsura T, Kai M, Yamada K. Potential roles of hepatic heat shock protein 25 and 70i in protection of mice against acetaminophen-induced liver injury. Life Sci. 2004;74:2551-2561. [PubMed] [DOI] |
| 6. | Chen LJ, Su XW, Qiu PX, Huang YJ, Yan GM. Thermal preconditioning protected cerebellar granule neurons of rats by modulating HSP70 expression. Acta Pharmacol Sin. 2004;25:458-461. [PubMed] |
| 7. | Saito M, Tominaga L, Nanba E, Kinoshita Y, Housi D, Miyagawa I, Satoh K. Expression of HSP 70 and its mRNAS during ischemia-reperfusion in the rat bladder. Life Sci. 2004;75:1879-1886. [PubMed] [DOI] |
| 8. | White DJ, Carlson D, Ordway GA, Horton JW. Protective role of heat stress in burn trauma. Crit Care Med. 2004;32:1338-1345. [PubMed] [DOI] |
| 11. | Ip SP, Che CT, Kong YC, Ko KM. Effects of schisandrin B pretreatment on tumor necrosis factor-alpha induced apoptosis and Hsp70 expression in mouse liver. Cell Stress Chaperones. 2001;6:44-48. [PubMed] [DOI] |
| 12. | Ahmad S, White CW, Chang LY, Schneider BK, Allen CB. Glutamine protects mitochondrial structure and function in oxygen toxicity. Am J Physiol Lung Cell Mol Physiol. 2001;280:L779-L791. [PubMed] |
| 13. | de Aguilar-Nascimento JE, Gurgel Marques C, Carvalho Mariano A, Bicudo Salomão A, de Souza Neves J. Benefits of intraluminal injection of glutamine for intestinal mucosa during ischemia-reperfusion. Eur Surg Res. 2003;35:352-356. [PubMed] [DOI] |
| 14. | Wu GH, Wang H, Zhang YW, Wu ZH, Wu ZG. Glutamine supplemented parenteral nutrition prevents intestinal ischemia- reperfusion injury in rats. World J Gastroenterol. 2004;10:2592-2594. [PubMed] [DOI] |
| 15. | Kozar RA, Schultz SG, Bick RJ, Poindexter BJ, DeSoignie R, Moore FA. Enteral glutamine but not alanine maintains small bowel barrier function after ischemia/reperfusion injury in rats. Shock. 2004;21:433-437. [PubMed] [DOI] |
| 16. | Wischmeyer PE, Jayakar D, Williams U, Singleton KD, Riehm J, Bacha EA, Jeevanandam V, Christians U, Serkova N. Single dose of glutamine enhances myocardial tissue metabolism, glutathione content, and improves myocardial function after ischemia-reperfusion injury. JPEN J Parenter Enteral Nutr. 2003;27:396-403. [PubMed] [DOI] |
| 17. | Wischmeyer PE, Vanden Hoek TL, Li C, Shao Z, Ren H, Riehm J, Becker LB. Glutamine preserves cardiomyocyte viability and enhances recovery of contractile function after ischemia-reperfusion injury. JPEN J Parenter Enteral Nutr. 2003;27:116-122. [PubMed] [DOI] |
| 18. | Tazuke Y, Wasa M, Shimizu Y, Wang HS, Okada A. Alanyl-glutamine-supplemented parenteral nutrition prevents intestinal ischemia-reperfusion injury in rats. JPEN J Parenter Enteral Nutr. 2003;27:110-115. [PubMed] [DOI] |
| 19. | Ikeda S, Zarzaur BL, Johnson CD, Fukatsu K, Kudsk KA. Total parenteral nutrition supplementation with glutamine improves survival after gut ischemia/reperfusion. JPEN J Parenter Enteral Nutr. 2002;26:169-173. [PubMed] [DOI] |
| 20. | Prem JT, Eppinger M, Lemmon G, Miller S, Nolan D, Peoples J. The role of glutamine in skeletal muscle ischemia/reperfusion injury in the rat hind limb model. Am J Surg. 1999;178:147-150. [PubMed] [DOI] |
| 21. | Hayashi Y, Sawa Y, Fukuyama N, Nakazawa H, Matsuda H. Preoperative glutamine administration induces heat-shock protein 70 expression and attenuates cardiopulmonary bypass-induced inflammatory response by regulating nitric oxide synthase activity. Circulation. 2002;106:2601-2607. [PubMed] [DOI] |
| 22. | Scharte M, Baba HA, Van Aken H, Schulzki C, Meyer J, Goeters C, Bone HG. Alanyl-glutamine dipeptide does not affect hemodynamics despite a greater increase in myocardial heat shock protein 72 immunoreactivity in endotoxemic sheep. J Nutr. 2001;131:1433-1437. [PubMed] |
| 23. | Dai CL, Xia ZL, Kume M, Yamamoto Y, Yamagami K, Ozaki N, Yamaoka Y. Heat shock protein 72 normothermic ischemia, and the impact of congested portal blood reperfusion on rat liver. World J Gastroenterol. 2001;7:415-418. [PubMed] [DOI] |
| 24. | Sakai T, Takaya S, Fukuda A, Harada O, Kobayashi M. Evaluation of warm ischemia-reperfusion injury using heat shock protein in the rat liver. Transpl Int. 2003;16:88-99. [PubMed] [DOI] |
| 25. | Gingalewski C, Theodorakis NG, Yang J, Beck SC, De Maio A. Distinct expression of heat shock and acute phase genes during regional hepatic ischemia-reperfusion. Am J Physiol. 1996;271:R634-R640. [PubMed] |
| 29. | Ding LA, Li JS. Effects of glutamine on intestinal permeability and bacterial translocation in TPN-rats with endotoxemia. World J Gastroenterol. 2003;9:1327-1332. [PubMed] [DOI] |
| 30. | Yasuhara M. [L-glutamine-induced heme oxygenase-1 protects small intestine from warm ischemia and reperfusion injury in the rat]. Hokkaido Igaku Zasshi. 2001;76:21-34. [PubMed] |