修回日期: 2004-06-02
接受日期: 2004-06-10
在线出版日期: 2004-10-15
目的: 利用RNA干扰(RNA interfering, RNAi)技术, 以DNMT1(DNA methyltransferase 1)为靶基因, 设计构建重组体,研究其对胃癌细胞AGS中DNMT1表达的抑制作用.
方法: 设计有小发夹结构的两条DNA序列, 经退火成互补双链, 再克隆至载体pTZU6+1中构建重组体, 经鉴定正确后, 转染胃癌细胞AGS, 最后使用RT-PCR法定性分析DNMT1的mRNA水平和Western blot法分析DNMT1的蛋白表达水平.
结果: 成功地构建了靶向DNMT1 基因RNAi的重组体, 将其有效转染到胃癌细胞AGS中去后, 出现了DNMT1的蛋白和mRNA水平的明显下降,转染后48 h的相对抑制率为73%左右.
结论: DNMT1靶向RNA干扰重组体转染到胃癌细胞中可抑制DNMT1的表达.
引文著录: 陈道荣, 王丕龙, 黄爱龙. RNAi重组体抑制胃癌细胞AGS中DNMT1基因的表达. 世界华人消化杂志 2004; 12(10): 2467-2469
Revised: June 2, 2004
Accepted: June 10, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2467-2469
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2467
胃癌是我国最常见的消化道肿瘤, 其死亡率居各种恶性肿瘤之首[1-3]. 随着细胞生物学与分子生物学的发展, 越来越多的研究表明部分基因启动子区域的超甲基化状态严重影响了该基因的表达, 尤其是一些抑癌基因的失活在肿瘤的发生中起着极其关键的作用, 这已得到了国内外学者的公认[4]. 而特异性DNA甲基转移酶就负责往DNA启动子区域的特定胞嘧啶残基上添加甲基, 其中DNMT1在成人细胞基因组DNA甲基化的维护中有着极其关键性的作用.我们构建了DNMT1靶向RNA干扰重组体, 并将其转染到胃癌细胞AGS中观察对DNA甲基转移酶基因的表达抑制作用如下.
克隆用大肠杆菌Jm109和载体pTZU6+1由重庆医科大学附属第二医院病毒性肝炎研究所保存.胃癌细胞AGS购自于中国科学院上海细胞生物学研究所细胞库.限制性内切酶Sal I, Hind Ⅲ, EcoRⅠ, XbaⅠ, T4 DNA 连接酶和DMSO均为 Promega公司产品; 核酸分子质量标准、酚/氯仿购自上海生工公司; 柱离心式质粒抽提试剂盒和柱离心式胶回收试剂盒均购自上海华舜公司.胎牛血清购自于美国Hyclone公司. 转染试剂Lipofectamine2000购于Invitrogen公司. RNA提取试剂盒为Qiagen公司产品; RT-PCR二步法试剂盒为TaKaRa公司产品. 兔抗人DNMT1及羊抗人beta-actin多克隆抗体购于美国Santa Cruz公司; 辣根过氧化物酶标记的羊抗兔IgG及兔抗羊IgG(二抗)购于北京中山生物技术有限公司. 根据Genbank中报道的DNMT1的核苷酸序列(No NM001379), 参考小干扰RNA(short interfering RNA, siRNA)的设计策略, 设计短发夹RNA(short hairpin RNA, shRNA)序列如下(正义链带有Xho I的酶切位点, 反义链带有XbaⅠ的酶切位点):正义链:5'-TCGAGCAGGCGGCTCAAAGATTTGTTCGCAAATCTTT GAGCCGCCTGCTTTTT-3'反义链:5'-CTAGAAAAA GCAGGCGGCTCAAAGATTTGCGAACAAATCTTTGAGCCGCCTGC-3'根据Genbank中报道的DNMT1的核苷酸序列(No NM001379), 参考RT-PCR引物设计原则设计引物如下:P1:5'-TGCAGAAGGATGGAACGGAG-3'; P2:5'-GCTTTTCCTTGTAATCCTGG-3'.另外同时设计β-actin基因的引物序列如下: P1:5'-TGGCACCACACCTTCTACAA-3'; P2:5'-GCAGCTCGTAGCTCTTCTCC-3'.
采用化学合成方法合成单链寡核苷酸. 取等量100 mmol/L的DNA合成片段, 在退火缓冲液中于95℃保温2min后, 缓慢降至室温得到退火双链DNA[5-7]. 将乙醇沉淀过夜纯化的双链DNA片段与Sal I和 Xba I双酶切的转录载体pTZU6+1进行连接, 转化大肠杆菌JM109, Amp抗性筛选, 阳性克隆分别以Sal I, Xba I单酶切和Hind Ⅲ +EcoR I双酶切, 10 g/L琼脂糖凝胶电泳鉴定, 将筛选的阳性克隆质粒送上海申友生物技术有限公司进行序列分析, 以证实目的DNA片段克隆入pTZU6+1载体, 将测序正确的shRNA表达载体命名为DNMT1-pTZU6+1. 本试验共分为5组: 第1组为空白对照组, 不加任何的干预措施; 第2组为脂质体对照组, 仅予以脂质体; 第3组为重组质粒对照组仅予以重组质粒; 第4组为空载体对照组, 予以脂质体加空载体;第5组为试验组予以重组质粒和脂质体的混合物. AGS细胞常规培养于含100 mL/L灭活的胎牛血清, 100 ku/L青霉素, 100 ku/L链霉素的DMEM培养液中, 培养条件为37 ℃, 饱和湿度50 mL/L CO2; 每1-2 d用2.5 g/L胰酶消化传代. 将对数生长期的胃癌细胞AGS消化离心后, 加入适量的只含胎牛血清, 而无抗生素的DMEM培养基计数, 按2×108/L接种于24孔板中. 种板后24 h左右, 细胞长至培养板的95-100%时进行转染. 具体的转染步骤参见Invitrogen公司的转染操作手册. 将转染前、转染后24, 48, 72 h的各组细胞用胰酶消化下来, PBS洗3次. Western blot杂交按《分子克隆》实验操作指南进行, 一抗为兔抗人DNMT1, 羊抗人β-actin多克隆抗体; 二抗为辣根过氧化物酶标记的羊抗兔IgG, 兔抗羊IgG. 最后用DAB检测系统检测. 另将转染前、转染后24, 48, 72 h的各组细胞用胰酶消化下来, PBS洗3次, 按试剂盒说明分别提取各组细胞的总RNA.RT-PCR反应体系中加入两对引物, 第1对是内源对照β-actin基因的引物, 第2对是被沉寂的DNMT1基因的引物, 具体操作见说明书.反应条件是94 ℃ 4 min; 94 ℃ 30 s; 60 ℃ 30 s; 72 ℃ 50 s; 72 ℃10 min, 共30个循环.根据凝胶电泳中β-actin基因片段条带的强弱判断模板的量, 进而判断靶基因的mRNA被shRNA沉寂的程度.
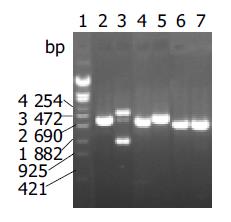
重组质粒DNMT1-pTZU6+1的SalⅠ酶切位点丢失, 但可以被XbaⅠ酶切开.而空载体可被SalⅠ和XbaⅠ双酶切形成约3.1 kb的DNA片段. 用Hind Ⅲ 和EcoR I双酶切后重组质粒和空载体均产生2个条带, 但重组质粒的小片段比空载体的大一些, 实验结果与预期相符(图1). 进一步用DNA测序方法证实重组载体序列完全正确.
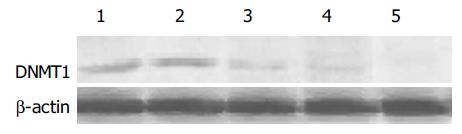
与对照组相比, 重组载体被转染到胃癌细胞AGS中去后引起细胞中的DNMT1蛋白表达量减少. 并且随时间的推移, 这种现象更加明显(图2).
针对DNMT1基因构建的RNA干扰重组体对胃癌细胞AGS中DNMT1基因的转录有明显的抑制作用.这种抑制作用随时间的延长有逐步增强的趋势.
10年前科学家们就发现DNA甲基化和肿瘤的发生之间有着密不可分的关系. DNA甲基化可以在转录水平调控基因表达(主要是在转录起始阶段), 通过基因启动子及其附近区域内CpG岛胞嘧啶的甲基化关闭某种组织或细胞不必需的基因, 而去甲基化作用则可指导组织特异性或阶段特异性基因的活化, 使基因表达具有时空特点. 正常组织细胞中, 广泛表达的基因启动子区域CpG岛常处于非甲基化状态; 肿瘤细胞中, 这些CpG岛常变为甲基化状态, 其相关基因的表达亦被关闭[4]. 这些基因包括: 肿瘤抑制基因、细胞周期凋亡调节基因、抑制肿瘤转移和浸润基因、DNA修复基因、激素受体基因和抑制血管形成基因等.所以说启动子区域CpG岛超甲基化使肿瘤抑制基因沉寂在肿瘤的发生中起着举足轻重的作用. 抑制基因表达的方法比较多, 现在最热门的是RNA干扰法(RNA interfering , RNAi). 他是Fire et al[8]在1998年研究Caenorhabditis elegans基因组计划时, 发现并命名的新技术:通过导入双链RNA(double stain RNA, dsRNA)而产生对宿主特异性RNA转录的抑制, 从而抑制特异目的基因的表达.随后此技术在全球得以广泛的开展和应用, 特别是Elbashir et al[9]在《Nature》上发表文章证实在哺乳动物细胞中可以应用RNAi技术高效阻断某个特定基因的表达, 揭开了RNAi应用于哺乳动物细胞研究的新篇章.
科学家们已提出了RNAi的可能作用机制: dsRNA或能转录产生shRNA的载体进入细胞被Dicer RNase III和其他的dsRNA结合因子剪切为21-23nt的siRNA, siRNA双链和一些蛋白和酶如MUT-7、RED-1、PAZ蛋白、DNA/RNA螺旋酶结合形成RISC复合物(RNAi Inducing Silencing Complex), siRNA引导此复合物去寻找、识别与之互补的mRNA, siRNA的反向RNA链通过RNAi复合物的螺旋结构域与目的mRNA结合, 剪切目的mRNA, 从而阻止目的基因的表达, 而RISC复合物又可参加下一个RNAi的作用循环[10]. 我们根据DNMT1基因的特点, 参照shRNA设计原则, 构建靶向DNMT1基因的RNAi重组载体DNMT1-pTZU6+1. 将其转入胃癌AGS细胞中后发现:该重组载体可明显抑制细胞中DNMT1的mRNA转录和蛋白表达. 该结果不仅再次证实了RNA干扰对特定基因表达的抑制作用, 而且还成功构建了靶向DNMT1基因的RNAi重组载体DNMT1-pTZU6+1, 从而为研究DNMT1基因和胃癌致病发病之间的关系以及为探索胃癌乃至多种肿瘤的治疗途径打下了基础.
Tong-Chuan He, 刘杞教授, 唐霓副教授, 闫歌博士, 张秉强博士, 蒲丹博士, 陶鹏博士, 卢年芳硕士等.
| 1. | 吴 汉平, 吴 开春, 李 玲, 幺 立萍, 兰 梅, 王 新, 樊 代明. 人环氧合酶-2(hCOX-2)编码基因的克隆及其反义核酸转染胃癌细胞的初步研究. 世界华人消化杂志. 2000;8:1211-1217. [DOI] |
| 4. | Esteller M. Relevance of DNA methylation in the management of cancer. Lancet Oncol. 2003;4:351-358. [PubMed] [DOI] |
| 5. | 闫 歌, 黄 爱龙, 唐 霓, 张 秉强, 蒲 丹, 向 明确, 兰 英华, 吴 刚. 短发夹状RNA抑制survivin基因在肝癌细胞中的表达. 中华肝脏病杂志. 2003;11:712-715. |
| 7. | 唐 霓, 黄 爱龙, 张 秉强, 闫 歌, 向 明确, 蒲 丹, 郭 晖. 1.3倍乙型肝炎病毒全基因真核表达载体的构建及在HepG2细胞中的表达. 中华肝脏病杂志. 2003;11:464-466. |
| 8. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 9. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 10. | Sui G, Soohoo C, Affar el B, Gay F, Shi Y, Forrester WC, Shi Y. A DNA vector-based RNAi technology to suppress gene expression in mammalian cells. Proc Natl Acad Sci USA. 2002;99:5515-5520. [PubMed] [DOI] |