修回日期: 2004-09-09
接受日期: 2004-09-19
在线出版日期: 2004-10-15
胰腺癌是消化系统常见恶性肿瘤, 恶性程度高, 侵袭性强, 预后差, 死亡率接近于发病率. 尽管近50年, 各种传统的治疗手段如手术, 放疗, 化疗或这些方法的联合应用取得较大进展, 但并未明显改善胰腺癌患者的预后. 近30年研究证实血管生成是许多肿瘤包括胰腺癌生长转移过程中的关键步骤, 抗血管生成治疗, 尤其是抗血管生成基因治疗作为胰腺癌治疗新视野, 为改善胰腺癌预后带来了新的希望, 成为研究的热点. 本文就该方面的研究进展做一综述.
引文著录: 何小平, 李兆申, 屠振兴. 胰腺癌抗肿瘤血管生成治疗. 世界华人消化杂志 2004; 12(10): 2442-2445
Revised: September 9, 2004
Accepted: September 19, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2442-2445
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2442.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2442
胰腺癌发病率和死亡率位居全部恶性肿瘤的前10 位, 侵袭性强, 且缺乏有效的早期诊断方法, 确诊时往往已经发生转移, 诊断后中位生存期不到6 mo. 近50年, 各种传统的治疗手段如手术, 放疗, 化疗或这些方法的联合对胰腺癌患者的预后几乎无影响, 胰腺癌死亡率依然接近于发病率, 因此迫切需要寻找新的治疗途径. 1971年Folkman首次提出肿瘤的生长浸润依赖于肿瘤内新生血管的形成, 后被大量的研究所证实, 揭开了肿瘤研究的新领域, 为治疗肿瘤提供了新的靶点. 抗肿瘤血管生成治疗目的是切断肿瘤生长转移所依赖的"命脉", 已发展为重要的抗癌策略, 成为胰腺癌治疗领域研究热点[1-4].
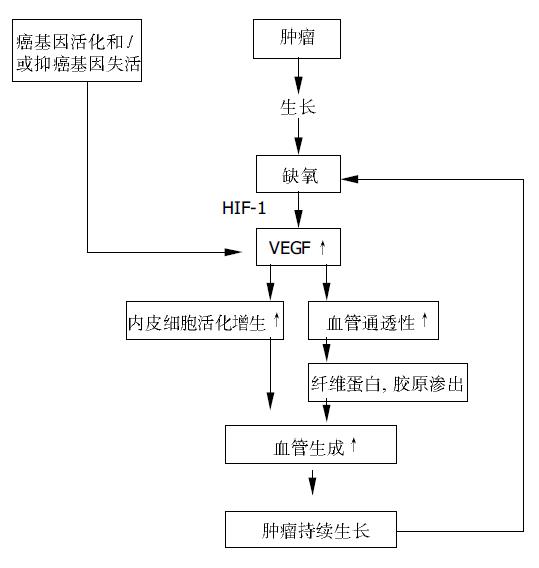
肿瘤生长依赖于新生血管的形成. 肿瘤生长存在两个阶段, 血管前期和血管期. 肿瘤聚集体生成后首先进入无血管生长期, 此期肿瘤通过弥散作用获得足够的营养和氧并运走代谢产物. 当肿瘤体积增至1-2 mm3 以上时, 如果没有新生血管长入, 肿瘤组织将保持休眠状态或发生退化[5-6]. 一旦血管长入肿瘤, 新生血管不仅为肿瘤提供必需的氧和营养物质, 还提供大量的促生长因子, 肿瘤将快速生长并达到难以控制的体积. 因此, 新血管生成被誉为肿瘤生长的"开关".
新血管生成还是肿瘤转移的关键步骤. 肿瘤内微血管密度与肿瘤的恶性表型密切相关, 新生血管为肿瘤细胞提供了转移通道.肿瘤新生血管不成熟, 结构缺乏完整性, 缺乏细胞间连接, 管壁薄弱, 仅排列一层内皮细胞, 缺乏平滑肌细胞, 基底膜不完整, 因此穿透性较高. 此外, 肿瘤血管化使间质内压力增高, 加快了淋巴回流. 血管丰富的肿瘤有更高的转移率, 肿瘤内微血管密度(MVD)已成为预测肿瘤转移, 复发和判断预后的重要指标[7]. 胰腺癌MVD与肿瘤恶性程度直接相关, MVD高者预后差[8-9].
肿瘤细胞以及一些宿主衍生的非肿瘤细胞如纤维母细胞, 巨噬细胞和浸润的粒细胞能分泌促血管生成因子和抑制因子, 当两种因子的作用失平衡, 前者超过后者时, 便触发了新生血管的形成. 导致这种失衡的原因是缺氧和/或基因改变[10-16]. 肿瘤生长到一定阶段, 当氧的需求超过供给或肿瘤内不成熟血管因间质内压力上升而塌陷时, 局部微环境处于缺氧状态. 缺氧直接刺激肿瘤细胞和宿主细胞合成分泌多种促血管生成因子, 主要是VEGF(血管内皮细胞生长因子), 促进局部新生血管形成. 缺氧还通过缺氧诱导因子1(hypoxia-induced factor-1, HIF-1)上调VEGF及其受体的表达. 另外, 癌基因如ras, raf, HER2/erbB2, src等的活化或抑癌基因如VHL, p53, p16INK4a等的失活亦可导致VEGF表达增高, 促进新血管生成. 晚近, Yamanaka et al报道人12号染色体有一能抑制血管生成的抑癌基因, 其缺失与胰腺导管癌的发生有关[17]. 在胰腺癌细胞系导入缺失的生长抑素受体-2亚型基因, 则能通过下调Bcl-2而上调Bax基因表达, 抑制血管生成, 抑制肿瘤细胞生长[18].
促血管生成因子主要是一些经典的肽类生长因子, 如: 血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、血管生成素(Ang)、基质金属蛋白酶(MMP)、血小板衍生生长因子(PDGF)、转化生长因子(TGF)、 TNF-α, IL-8等, 其中最重要的是VEGF, bFGF和Ang. (1)VEGF亦称血管通透性因子(vascular permeability factor, VPF)是一种有肝素亲和性的同源二聚体多肽, 由于mRNA的不同拼接方式形成5 种异构体, 即VEGF- A, VEGF- B, VEGF- C , VEGF- D, VEGF- E和胎盘生长因子(placenta growth factor). VEGF 有3种酪氨酸激酶受体, VEGFR-1(Flt-1), VEGFR- 2 (Flk-1/ KDR) , VEGFR- 3(Flt-4), 均只存在内皮细胞上. 不同受体功能不同, 促进新血管生成的主要是VEGFR-2, VEGFR-1负相调节VEGF的功能, 而VEGFR-3主要调控淋巴管的发生[19]. VEGF与VEGFR-2结合, 诱导其磷酸化, 通过一系列级联反应, 引起血管内皮细胞增生, 诱导血管生成, 同时使血管通透性增高, 导致血浆中大分子物外渗, 为肿瘤细胞快速增长提供营养. 多种其他促血管生成因子, 如: bFGF, PDGF, TNFa等能通过直接或间接影响VEGF和/或其受体信号传导起作用. 患者血清和尿液VEGF水平是判断部分肿瘤预后的可靠指标[20]. 研究表明, VEGF表达增高与胰腺癌MVD密切相关, 是判断患者预后差的指标[21]. (2)bFGF是最早被明确的促血管新生因子, 由155个氨基酸组成, Mr 18 000 bFGF主要存在于细胞外基质, 在金属蛋白酶(MMP)作用下释放出来, 通过刺激其酪氨酸激酶受体起作用. bFGF具有多种功能, 能诱导内皮细胞在内的多种细胞的增生分化, 还影响内皮细胞的迁移, 促进管腔形成, 刺激内皮细胞分泌胶原酶, 降解基底膜, 以利于新生血管生长[10]. 越来越多的证据表明VEGF与bFGF在体内外血管生成显示出协同作用. 研究表明肿瘤患者血清和尿液bFGF浓度的增高和肿瘤血管生成有关, 脑肿瘤患者脑脊液bFGF水平是判断预后的有效指标. (3)Ang是新发现的一族生长因子, 有4个成员, Ang1-4, 特异性作用于内皮细胞, 具有很强的促血管生成活性. Ang家族并非在血管生成的早期阶段起作用, 而是在后期的血管重建和稳定中发挥关键作用[7]. 激活Tie-2/Ang-1信号通路能诱导毛细血管出芽形成分支, 募集血管周细胞和平滑肌细胞, 维持血管稳定性, 同时活化内皮细胞磷脂酰肌醇激酶(PI3), 使凋亡抑制剂survivin生成增多, 对抗内皮细胞凋亡[19]. 有趣的是, Ang-1促进血管生成, 而Ang-2拮抗此作用[19]. Ang-2通过诱导内皮细胞凋亡促使新生血管发生退化. Ang-1, Ang-2和VEGF的水平共同决定了血管发展方向是增生(高水平VEGF, Ang-1和Ang-2作用平衡), 成熟(高水平VEGF, Ang-1, 低水平Ang-2), 还是退化(低水平VEGF和Ang-1, 高水平Ang-2). 阻断Tie2信号通路, 能有效抑制肿瘤小鼠血管生成.
2.3.1 血管抑素(angiostatin): 1994年O'Reilly et al首次从Lewis肺癌小鼠的血清和尿液中分离得到了血管抑素, 系纤溶酶原降解产物, Mr 38 000, 由350个氨基酸残基组成, 特异性作用于内皮细胞, 抑制血管生成. 研究表明, Kringle 区是血管抑素的抗血管生成作用的关键结构. 所谓Kringle区为三个二硫键组成的环状区域, 纤溶酶原有5个串联的Kringle 区, 除Kringle 4 外, Kringle 1, 2 , 3 , 5 的产物都分别有程度不同的抑制血管生成活性[20]. 血管抑素具有前4 个Kringle 区[22]. 血管抑素的作用机制可能包括[7,20,23]: (1)抑制内皮细胞表面ATP 合成酶的活性; (2)抑制VEGF和bFGF活化内皮细胞细胞外信号调节酶(ERK-1, ERK-2), 抑制内皮细胞迁移; (3)抑制内皮细胞的增生; (4)抑制纤溶酶活性, 阻止内皮细胞迁移; (5)诱导内皮细胞凋亡; (6)抑制血管生成素的产生. 血管抑素已成功治疗多种肿瘤动物模型, 如: 纤维肉瘤, 黑色素瘤, 前列腺癌, 卵巢癌等[24].
2.3.2 内皮抑素(endostatin): 继血管抑素后, 很快又发现了抗血管生成活性更强的内皮抑素. 内皮抑素系胶原XⅧ C末端酶切产物, Mr 20 000, 含184个氨基酸, 对肝素有极高的亲和力, 存在于血管壁和基底膜. 内皮抑素特异性作用于内皮细胞, 抑制内皮细胞增生和迁移, 诱导其凋亡, 显著抑制肿瘤的生长与转移[24]. 该药在美国已进入II期临床试验阶段, 但其具体作用机制尚不清楚, 可能包括[23,25]: (1)抑制Bcl-2和Bcl-χ2的表达, 诱导内皮细胞凋亡; (2)抑制VEGF和bFGF活化内皮细胞ERK-1, ERK-2, 抑制内皮细胞迁移; (3)抑制内皮细胞增生.
除血管抑素和内皮抑素, 肿瘤还能分泌多种抑制因子, 如组织金属蛋白酶抑制剂(TIMP), 血小板因子- 4(PF-4), 白介素-12(IL-12), 血小板反应蛋白-1(Thrombospondin-1, TSP-1)等.
VEGF及其信号传导通路在许多实体瘤包括胰腺癌的新血管生成中都起关键性作用. VEGF及其受体在胰腺癌患者体内过度表达, VEGF通过旁分泌和自分泌途径促进胰腺癌细胞生长. 人和动物模型的研究证实VEGF高表达与胰腺癌病理分期, 术后复发, 淋巴结和远处转移, 以及短生存期密切相关[26]. 因此, VEGF及其信号传导通路成为胰腺癌抗血管生成治疗研究主要靶点. VEGF抑制剂包括抗VEGF抗体, 可溶性VEGF受体, 抗VEGF受体抗体, 核酶, 小分子VEGF受体抑制剂等. 体外实验和动物模型已证实这些药物能有效抑制胰腺癌的生长和转移[27-31]: VEGF中和性抗体抑制了异体移植小鼠PANC-1肿瘤生长; 核酶介导的VEGF裂解抑制了胰腺癌细胞系肝脏转移; 白喉毒素- VEGF融合蛋白抑制裸鼠胰腺癌生长等. 另外, 联合应用健择能增强对肿瘤的抑制作用, 减少转移, 延长生存期[32]. 这些临床前资料为抗VEGF治疗人胰腺癌提供了有力依据.
目前, 已有多种抗VEGF药物进入临床试验阶段, 如以VEGF受体为靶点的药物CEP-7055, SU6668, PTK787, ZD4190等[1,33-34]. 其中, 研究较多的是bevacizumab (商品名Avastin), 系重组人抗VEGF单克隆IgG1抗体, 2004-02获得美国食品和药品管理局(FDA)的批准上市, 用于一线治疗晚期结直肠癌, 这是世界上第一个批准上市的VEGF抑制剂. 该药治疗胰腺癌的初步临床资料亦令人鼓舞. 一项多中心II期临床试验表明, 健择联合Bevacizumab 治疗进展期胰腺癌较单用健择有效率高, 病程进展慢, 患者生存期延长, 6 mo 生存率为70%, 1年生存率为53%, 且耐受性较好, 但这一结果尚需进一步的研究证实. 该药联合应用内皮细胞生长因子抑制剂, 联合应用放疗及其他细胞毒药物的研究也正在进行, 以进一步明确其治疗局部进展期和伴转移胰腺癌作用. 理想抗血管生成治疗的关键是将足量治疗药物传送到肿瘤内, 药物作用时间足够长以抑制肿瘤血管生成而不干扰正常生理过程, 这也一直是该领域研究难题. 基因治疗与抗肿瘤血管生成治疗相结合, 使抗血管生成治疗更具靶向性, 在很大程度上能满足上述要求. 抗血管生成基因治疗在肿瘤局部表达高浓度抗血管生成蛋白, 血循环中药物浓度较低, 因而干扰正常生理性血管生成的风险小. 只要基因在表达就会对局部产生持续的抗血管生成作用, 避免经常注射外源性药物. 动物实验表明重组腺病毒介导的反义VEGF能抑制裸鼠胰腺癌皮下种植瘤的生长, Il-8反义治疗在胰腺癌裸鼠模型中同样能抑制肿瘤血管的生成[35]. 但目前基因治疗主要停留在实验室水平, 仍面临许多难题, 如重组基因的安全性, 高效特异靶向载体的构建及基因转染率低等, 离临床实际应用尚有较大距离.
总之, 血管生成是胰腺癌生长转移过程中的关键步骤, 抗血管生成治疗, 尤其是抗血管生成基因治疗作为胰腺癌治疗新视野, 为改善胰腺癌预后带来了希望, 具有广阔的应用前景, 但仍面临着许多问题和挑战, 需要进一步深入研究和探讨.
| 1. | Ranieri G, Gasparini G. Angiogenesis and angiogenesis inhibitors: a new potential anticancer therapeutic strategy. Curr Drug Targets Immune Endocr Metabol Disord. 2001;1:241-253. [PubMed] [DOI] |
| 2. | Dudek AZ, Pawlak WZ, Kirstein MN. Molecular targets in the inhibition of angiogenesis. Expert Opin Ther Targets. 2003;7:527-541. [PubMed] [DOI] |
| 3. | Pino SM, Xiong HQ, McConkey D, Abbruzzese JL. Novel therapies for pancreatic adenocarcinoma. Curr Gastroenterol Rep. 2004;6:119-125. [PubMed] [DOI] |
| 4. | Onizuka S, Kawakami S, Taniguchi K, Fujioka H, Miyashita K. Pancreatic carcinogenesis: apoptosis and angiogenesis. Pancreas. 2004;28:317-319. [PubMed] [DOI] |
| 5. | Kong HL, Crystal RG. Gene therapy strategies for tumor antiangiogenesis. J Natl Cancer Inst. 1998;90:273-286. [PubMed] [DOI] |
| 6. | Nesbit M. Abrogation of tumor vasculature using gene therapy. Cancer Metastasis Rev. 2000;19:45-49. [PubMed] [DOI] |
| 7. | Webb CP, Vande Woude GF. Genes that regulate metastasis and angiogenesis. J Neurooncol. 2000;50:71-87. [PubMed] [DOI] |
| 8. | Zhongqiu W, Guangming L, Jieshou L, Xinhua Z, Ziqian C, Kui M. The comparative study of tumor angiogenesis and CT enhancement in pancreatic carcinoma. Eur J Radiol. 2004;49:274-280. [PubMed] [DOI] |
| 9. | Wang ZQ, Li JS, Lu GM, Zhang XH, Chen ZQ, Meng K. Correlation of CT enhancement, tumor angiogenesis and pathologic grading of pancreatic carcinoma. World J Gastroenterol. 2003;9:2100-2104. [PubMed] [DOI] |
| 10. | Cavallaro U, Christofori G. Molecular mechanisms of tumor angiogenesis and tumor progression. J Neurooncol. 2000;50:63-70. [PubMed] [DOI] |
| 11. | Conti CJ. Vascular endothelial growth factor: regulation in the mouse skin carcinogenesis model and use in antiangiogenesis cancer therapy. Oncologist. 2002;7 Suppl 3:4-11. [PubMed] [DOI] |
| 12. | Bandoh N, Hayashi T, Takahara M, Kishibe K, Ogino T, Katayama A, Imada M, Nonaka S, Harabuchi Y. VEGF and bFGF expression and microvessel density of maxillary sinus squamous cell carcinoma in relation to p53 status, spontaneous apoptosis and prognosis. Cancer Lett. 2004;208:215-225. [PubMed] [DOI] |
| 13. | Kitada T, Seki S, Sakaguchi H, Sawada T, Hirakawa K, Wakasa K. Clinicopathological significance of hypoxia-inducible factor-1alpha expression in human pancreatic carcinoma. Histopathology. 2003;43:550-555. [PubMed] [DOI] |
| 14. | Lee KT, Lee YW, Lee JK, Choi SH, Rhee JC, Paik SS, Kong G. Overexpression of Id-1 is significantly associated with tumour angiogenesis in human pancreas cancers. Br J Cancer. 2004;90:1198-1203. [PubMed] [DOI] |
| 15. | Kasper HU, Wolf H, Drebber U, Wolf HK, Kern MA. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in pancreatic adenocarcinoma: correlation with microvessel density. World J Gastroenterol. 2004;10:1918-1922. [PubMed] [DOI] |
| 16. | Qin RY, Fang RL, Gupta MK, Liu ZR, Wang DY, Chang Q, Chen YB. Alteration of somatostatin receptor subtype 2 gene expression in pancreatic tumor angiogenesis. World J Gastroenterol. 2004;10:132-135. [PubMed] |
| 17. | Yamanaka S, Sunamura M, Furukawa T, Sun L, Lefter LP, Abe T, Yatsuoka T, Fujimura H, Shibuya E, Kotobuki N. Chromosome 12, frequently deleted in human pancreatic cancer, may encode a tumor-suppressor gene that suppresses angiogenesis. Lab Invest. 2004;84:1339-1351. [PubMed] [DOI] |
| 18. | Kumar M, Liu ZR, Thapa L, Wang DY, Tian R, Qin RY. Mechanisms of inhibition of growth of human pancreatic carcinoma implanted in nude mice by somatostatin receptor subtype 2. Pancreas. 2004;29:141-151. [PubMed] [DOI] |
| 19. | Kieran MW, Billett A. Antiangiogenesis therapy. Current and future agents. Hematol Oncol Clin North Am. 2001;15:835-851, viii. [PubMed] [DOI] |
| 20. | Soff GA. Angiostatin and angiostatin-related proteins. Cancer Metastasis Rev. 2000;19:97-107. [PubMed] [DOI] |
| 21. | Kuwahara K, Sasaki T, Kuwada Y, Murakami M, Yamasaki S, Chayama K. Expressions of angiogenic factors in pancreatic ductal carcinoma: a correlative study with clinicopathologic parameters and patient survival. Pancreas. 2003;26:344-349. [PubMed] [DOI] |
| 22. | Cao Y, Cao R, Veitonmäki N. Kringle structures and antiangiogenesis. Curr Med Chem Anticancer Agents. 2002;2:667-681. [PubMed] [DOI] |
| 23. | Sim BK, MacDonald NJ, Gubish ER. Angiostatin and endostatin: endogenous inhibitors of tumor growth. Cancer Metastasis Rev. 2000;19:181-190. [PubMed] [DOI] |
| 24. | Kirsch M, Schackert G, Black PM. Angiogenesis, metastasis, and endogenous inhibition. J Neurooncol. 2000;50:173-180. [PubMed] [DOI] |
| 25. | Ren B, Höti N, Rabasseda X, Wang YZ, Wu M. The antiangiogenic and therapeutic implications of endostatin. Methods Find Exp Clin Pharmacol. 2003;25:215-224. [PubMed] [DOI] |
| 26. | Niedergethmann M, Hildenbrand R, Wostbrock B, Hartel M, Sturm JW, Richter A, Post S. High expression of vascular endothelial growth factor predicts early recurrence and poor prognosis after curative resection for ductal adenocarcinoma of the pancreas. Pancreas. 2002;25:122-129. [PubMed] [DOI] |
| 27. | Tsuzuki Y, Mouta Carreira C, Bockhorn M, Xu L, Jain RK, Fukumura D. Pancreas microenvironment promotes VEGF expression and tumor growth: novel window models for pancreatic tumor angiogenesis and microcirculation. Lab Invest. 2001;81:1439-1451. [PubMed] [DOI] |
| 28. | Bockhorn M, Tsuzuki Y, Xu L, Frilling A, Broelsch CE, Fukumura D. Differential vascular and transcriptional responses to anti-vascular endothelial growth factor antibody in orthotopic human pancreatic cancer xenografts. Clin Cancer Res. 2003;9:4221-4226. [PubMed] |
| 29. | Hotz HG, Gill PS, Masood R, Hotz B, Buhr HJ, Foitzik T, Hines OJ, Reber HA. Specific targeting of tumor vasculature by diphtheria toxin-vascular endothelial growth factor fusion protein reduces angiogenesis and growth of pancreatic cancer. J Gastrointest Surg. 2002;6:159-166; discussion 166. [PubMed] [DOI] |
| 30. | Tokunaga T, Abe Y, Tsuchida T, Hatanaka H, Oshika Y, Tomisawa M, Yoshimura M, Ohnishi Y, Kijima H, Yamazaki H. Ribozyme mediated cleavage of cell-associated isoform of vascular endothelial growth factor inhibits liver metastasis of a pancreatic cancer cell line. Int J Oncol. 2002;21:1027-1032. [PubMed] [DOI] |
| 31. | Hotz HG, Hines OJ, Hotz B, Foitzik T, Buhr HJ, Reber HA. Evaluation of vascular endothelial growth factor blockade and matrix metalloproteinase inhibition as a combination therapy for experimental human pancreatic cancer. J Gastrointest Surg. 2003;7:220-227; discussion 227-228. [PubMed] [DOI] |
| 32. | Bruns CJ, Shrader M, Harbison MT, Portera C, Solorzano CC, Jauch KW, Hicklin DJ, Radinsky R, Ellis LM. Effect of the vascular endothelial growth factor receptor-2 antibody DC101 plus gemcitabine on growth, metastasis and angiogenesis of human pancreatic cancer growing orthotopically in nude mice. Int J Cancer. 2002;102:101-108. [PubMed] [DOI] |
| 33. | Diaz-Rubio E. New chemotherapeutic advances in pancreatic, colorectal, and gastric cancers. Oncologist. 2004;9:282-294. [PubMed] [DOI] |
| 34. | Ruggeri B, Singh J, Gingrich D, Angeles T, Albom M, Yang S, Chang H, Robinson C, Hunter K, Dobrzanski P. CEP-7055: a novel, orally active pan inhibitor of vascular endothelial growth factor receptor tyrosine kinases with potent antiangiogenic activity and antitumor efficacy in preclinical models. Cancer Res. 2003;63:5978-5991. [PubMed] |
| 35. | Shi Q, Abbruzzese JL, Huang S, Fidler IJ, Xiong Q, Xie K. Constitutive and inducible interleukin 8 expression by hypoxia and acidosis renders human pancreatic cancer cells more tumorigenic and metastatic. Clin Cancer Res. 1999;5:3711-3721. [PubMed] |