修回日期: 2004-09-29
接受日期: 2004-10-08
在线出版日期: 2004-10-15
N/A
引文著录: 聂青和, 程勇前. 慢性丙型肝炎抗病毒失败者再治疗探讨. 世界华人消化杂志 2004; 12(10): 2382-2385
Revised: September 29, 2004
Accepted: October 8, 2004
Published online: October 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2382-2385
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2382
丙型肝炎病毒(HCV)的基础和临床各方面研究已经有了很大进展, 但是在诊断、治疗、疫苗研制等方面还不尽如人意, 彻底控制丙型肝炎的危害还有很远的路程要走. 慢性丙型肝炎目前常用的治疗方法是普通a干扰素, 300 wu, 3次/wk, 疗程1年. 但是用这种方法治疗的持续病毒学应答率(SVR, 治疗结束后24 wk血清HCV RNA阴性)只有12-16%[1]. 随着对利巴韦林抗病毒作用机制研究的深入, 以及长效干扰素的出现并批准用于临床, 单用普通干扰素治疗失败者的再次抗病毒治疗引起了许多学者的关注.
联合利巴韦林, 或用长效干扰素进行抗病毒治疗可以提高丙型肝炎患者的SVR, 但仍有一部分患者治疗无效. 因此, 许多学者针对如何选择合适的患者进行再次抗病毒治疗进行了大量研究, 认为首次治疗后的病毒学反应, 治疗前血清中病毒含量, 抗病毒治疗早期的病毒学反应, HCV RNA基因型等因素对再次抗病毒治疗的SVR有一定影响.
首次抗病毒治疗后的病毒学反应形式可分为: 复发(relapse), 即治疗过程中HCV RNA转阴, 但停止治疗后HCV RNA再次转为阳性.无应答(nonresponde)即在治疗过程中HCV RNA始终未转阴. 第三种类型为在治疗过程中HCV RNA先转阴, 但未停止治疗时HCV RNA再次出现. 在治疗无应答者中有两种不同类型的病毒学反应形式: 一部分在治疗中HCV RNA水平降低很少或没有降低(少于2个数量级); 另一部分血清HCV RNA水平降低至少2个数量级, 但在整个治疗过程中始终可检测到HCV RNA(部分应答)[2].
多家研究中采用不同方法[3], 如: 加大干扰素剂量、延长疗程、干扰素诱导治疗、干扰素联合利巴韦林等方法对首次治疗后复发者以及无应答者进行再次抗病毒治疗, 结果均显示首次治疗后复发者最终所获得的SVR较无应答者为高(表1). 对复发者采用干扰素联合利巴韦林再次抗病毒治疗的SVR在15-80%之间, 对无应答者采用干扰素联合利巴韦林再次抗病毒治疗的SVR在0-15%之间. 因此认为, 对首次治疗后复发者进行再次抗病毒治疗的SVR较无应答者高.
| 资料来源 | 病例数 | 用药 | 治疗方案 | 病例特点 | SVR |
| Kao JH(2001) | 复发者19名 | IFNa+ RIB | (IFN500wu, 3/wk, + RIB 1200 mg/d, 24w) | 复发者 | 67% |
| 无应答者17名 | (IFN500wu, 3/wk, +RIB 1200 mg/d, 24 wk) + IFN300wu, 3/wk, 24 wk | 80% | |||
| (IFN500wu, 3/wk, + RIB 1200 mg/d, 24 wk) | 无应答 | 45% | |||
| (IFN500wu, 3/wk, +RIB 1200 mg/d, 24 wk) + IFN300wu, 3/wk, 24 wk | 63% | ||||
| Enriquez J | 复发者51名 | IFNa-2b+ RIB | IFN 300 wu, 3/wk, + RIB 1000-1200 mg/d, 24 wk | 复发者 | 25% |
| (2000) | 无应答者69名 | IFN 300 wu, 3/wk, + RIB 1000-1200 mg/d, 48 wk | 66.6% | ||
| IFNa-2b+ RIB | IFN 300wu, 3/wk, + RIB 1000-1200 mg/d, 24 wk | 无应答 | 14.3% | ||
| IFN 300wu, 3/wk, + RIB 1000-1200 mg/d, 48 wk | 8.8% | ||||
| Cavalletto L | 25 | IFNaI | FN 600 wu, 3/wk, 8 wk IFN 300 wu, 3/wk, 24 wk | 复发者 | 4 (16%) |
| (2000) | 25 | IFNa-2b+ RIB | IFN 600wu, 3/wk, 8 wk | ||
| IFN 300 wu, 3/wk, + RIB 1 000-1 200 mg/d, 24 wk | 11 (44%) | ||||
| 25 | IFNa | IFN 600 wu, 3/wk, 8 wk | |||
| IFN 300 wu, 3/wk, 24 wk | 无应答 | 0 | |||
| 25 | IFNa-2b+ RIB | IFN 600wu, 3/wk, 8 wk | |||
| IFN 300 wu, 3/wk, + RIB 1000-1200 mg/d, 24 wk | 1 (4%) |
Iyoda et al通过对影响再次抗病毒治疗SVR的有关因素进行多变量分析后认为, SVR取决于再次治疗前HCV病毒载量, 病毒载量较低者(0.8±0.7 MEq/mL), 比病毒载量较高者(9.1±6.5 MEq/mL)更有可能获得SVR. Arase et al对277例首次治疗后血清HCV RNA阴性, ALT正常, 但停止治疗3 mo后, HCV RNA再次阳性, ALT反跳(>100 U)的复发者进行回顾性研究发现, HCV RNA阳性, ALT>100 U, 在ALT再次升高的最高峰时, 及ALT恢复过程中, HCV RNA水平较治疗前有明显下降, 如果在复发后ALT的恢复过程中再次给予干扰素抗病毒治疗, HCV RNA清除率为47.1%(8/17), 明显高于未再次治疗者1.5%(4/260). Watanabe et al在治疗1名基因型为1b的慢性丙型肝炎患者过程中观察到, 在第一次抗病毒治疗前病毒载量为1.2×106copies/mL, 干扰素敏感决定区为中间型, 前两次抗病毒治疗均失败, 在第三次抗病毒治疗前, 病毒载量降为1.5×104 copies/mL, 干扰素敏感决定区变为突变型, 第三次抗病毒治疗获得了SVR. 提示在病毒载量降低和干扰素敏感决定区变为突变型时进行抗病毒治疗可以获得SVR.
以上研究结果说明, 再次抗病毒治疗之前血清中病毒载量处于低水平的患者, 再次治疗后更有可能获SVR[4].
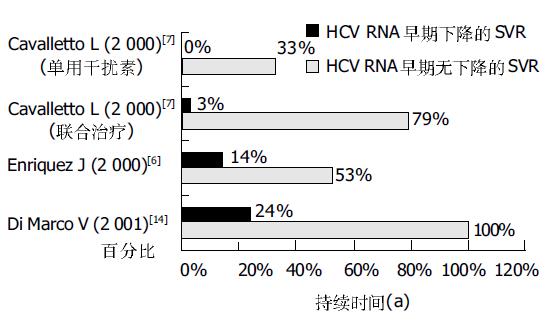
研究显示, 在治疗初期12 wk内HCV RNA水平下降2个数量级, 或HCV RNA降至105copies/mL以下, 或HCV RNA转阴, 并且ALT恢复正常者预示治疗结束后可能获得SVR[5]. 在初治者中仅有2%的无早期病毒学应答的患者最终可以获得SVR, 在所有SVR者中无早期病毒学应答的患者所占比例不足1%. 再次抗病毒治疗者中, 7%的治疗初期HCV RNA水平未下降2个数量级的患者, 最终可以获得SVR, 而41%的治疗初期HCV RNA水平下降2个数量级的患者, 最终可以获得SVR. Cavalletto et al[6]在第二次抗病毒治疗时对用IFN 600 wu, 3次/wk, 诱导治疗2 mo后有ALT, HCV RNA完全应答者, 继续用干扰素IFNa-2b 300 wu, 3次/wk, 联合利巴韦林治疗6 mo, SVR为79%(11/14), 继续单用干扰素IFNa-2b 300 wu, 3次/wk, 治疗6 mo, SVR为33%(4/12). 而诱导治疗后无ALT, HCV RNA完全应答者, 继续用干扰素IFNa-2b联合利巴韦林治疗6 mo, SVR仅为3%(1/36), 继续单用干扰素治疗SVR为0. Berg et al[7]研究认为, 在治疗第4 wk血清HCV RNA水平大于450 000 IU/mL和治疗12 wk大于30 000 IU/mL, 预示将对治疗无应答.
由此可见, 对抗病毒治疗早期有明显病毒学反应者, 治疗后获SVR的可能性大[8](图1), 而对于在治疗早期HCV RNA水平无明显下降者, 最终获SVR的可能性很小, 应停止继续治疗.
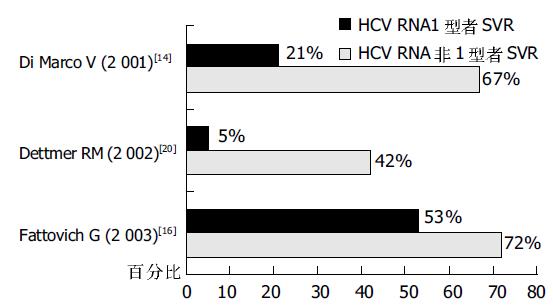
如(图2)所示, 目前许多研究认为, HCV基因型影响抗病毒治疗的疗效, 在采用不同的治疗方法再次抗病毒治疗中, SVR仍以基因型为2、3型, 或非1型者为高, 基因型为1(4)型者SVR较低[9].
多家研究显示, 采用相同方法再次抗病毒治疗很少能获得满意的疗效, 除非首次治疗失败是由于过早停药或用量不够. 在有关这方面研究的meta分析中发现, 在无应答者中, 用相同方案再次抗病毒治疗获得持续应答达不到5%. 也有一些研究显示, 这种治疗持续应答率为0. 尽管在治疗复发者中大约有一半人可观察到治疗结束时应答, 在复发者中持续应答率也仅有10%左右[10]. 因此用于再次抗病毒治疗的方案比首次治疗时所用方案是否更为有效是再次治疗是否有效的重要因素.
Shiffman et al[11]用如下公式预测再次治疗SVR: 再次治疗SVR=(再次治疗结束时应答率-首次治疗结束时应答率)-再次治疗方法的复发率. 例如: 单用干扰素治疗的治疗结束时应答率为24-29%, 干扰素联合利巴韦林抗病毒治疗的治疗结束时应答率为50-61%, 则单用干扰素治疗无应答者, 用普通干扰素联合利巴韦林再次抗病毒治疗的治疗结束时应答率为21-37%; 长效干扰素联合利巴韦林抗病毒治疗的治疗结束时应答率为65-68%. 那么, 单用干扰素治疗无应答者, 用长效干扰素联合利巴韦林再次抗病毒治疗的治疗结束时应答率为36-54%; 用普通干扰素联合利巴韦林抗病毒治疗无应答者, 用长效干扰素联合利巴韦林再次抗病毒治疗的治疗结束时应答率为4-18%; SVR则为治疗结束时应答率减去该治疗方法的复发率. 假如长效干扰素联合利巴韦林抗病毒治疗的复发率为20%, 则用长效干扰素联合利巴韦林, 治疗用普通干扰素联合利巴韦林抗病毒治疗无应答者的SVR为3-14%. 有关这方面研究的meta分析也证实了这些推测结果.
新的治疗方案可以采用较高剂量的干扰素, 或不同类型干扰素、长效干扰素, 或延长治疗时间, 或联合用药, 如利巴韦林、金刚烷胺, 以及联合用药的剂量、用药时间. 美国FDA已于1998年批准INF-a(300 wu, 3次/wk)联合利巴韦林(1 000-1 200 mg)用于慢性丙型肝炎治疗, 疗程24-48 wk, SVR 36-47%, 比单用干扰素高2-3倍[1-2]. 2001年FDA批准长效干扰素a-2b联合利巴韦林用于慢性丙肝的抗病毒治疗, SVR为54-56%, 比普通干扰素联合利巴韦林抗病毒治疗的SVR高7-12%[12].
Puppo et al[13]研究发现, 可溶性b2-m结合型和游离型HLA I重链的血清水平在HCV感染患者较正常对照明显增高, 在治疗第3 mo对治疗应答者其水平较无应答者增高明显, 在治疗的6 mo, 对治疗应答者其水平下降, 而无应答者仍增高, 在正常对照治疗前后无明显改变. 因此, 其作为一个免疫活性的标志, 与HCV RNA水平有关, 可以作为对IFN与利巴韦林联合再次抗病毒治疗反应的一个预测因素. 饮酒也会影响SVR, 戒酒可能会提高应答率, 建议HCV患者应该戒酒, 尤其是在干扰素治疗过程中.
此外, 患者治疗中的依从性和耐受性也是影响治疗效果的一个重要原因, 治疗失败的一个重要原因是患者没能按治疗方案进行正规治疗. 再次治疗时仍存在依从性和耐受性问题, 依从性好才有可能获得成功. 如果首次治疗中, 即使患者正确处理副反应, 仍不能耐受, 或首次治疗中曾出现目前无法治疗的合并症, 那么对再次治疗的副反应仍有可能不能耐受, 这些患者也不宜再次治疗[14]. 以下提示再次抗病毒治疗疗效较差: 曾用过IFN与利巴韦林联合治疗不能获得SVR; 1型患者; 血清HCV RNA>1.5×106IU/mL, 肝硬化等. 加之, 一些常见的易引起治疗无应答的因素包括: 正在使用其他静脉内用药, 饮酒, 没有正规服药, 或者由于贫血而导致减量.以上因素改善后, 可以再次进行抗病毒治疗[15].采用长效干扰素或联合利巴韦林等较单用普通干扰素更为有效的治疗方法进行再次抗病毒治疗, 更可获得持续病毒学应答. 可以看出, 对慢性丙型肝炎患者的治疗手段还有待进一步提高.
| 1. | Hino K, Okita K. Interferon therapy as chemoprevention of hepatocarcinogenesis in patients with chronic hepatitis C. J Antimicrob Chemother. 2004;53:19-22. [PubMed] [DOI] |
| 2. | Enríquez J, Gallego A, Torras X, Pérez-Olmeda T, Diago M, Soriano V, Luján MS, García-Samaniego J. Retreatment for 24 vs 48 weeks with interferon-alpha2b plus ribavirin of chronic hepatitis C patients who relapsed or did not respond to interferon alone. J Viral Hepat. 2000;7:403-408. [PubMed] [DOI] |
| 3. | Hepburn MJ, Hepburn LM, Cantu NS, Lapeer MG, Lawitz EJ. Differences in treatment outcome for hepatitis C among ethnic groups. Am J Med. 2004;117:163-168. [PubMed] [DOI] |
| 4. | Shiffman ML. Retreatment of patients with chronic hepatitis C. Hepatology. 2002;36:S128-S134. [PubMed] |
| 5. | Shiffman ML. Chronic hepatitis C. Semin Liver Dis. 2004;24 Suppl 2:1-2. [PubMed] |
| 6. | Cavalletto L, Chemello L, Donada C, Casarin P, Belussi F, Bernardinello E, Marino F, Pontisso P, Gatta A, Alberti A. The pattern of response to interferon alpha (alpha-IFN) predicts sustained response to a 6-month alpha-IFN and ribavirin retreatment for chronic hepatitis C. TVVH Study Group. J Hepatol. 2000;33:128-134. [PubMed] [DOI] |
| 7. | Berg T, Pascu M, Möller B. Prediction of spontaneous viral clearance in acute hepatitis C by viral load measurements. Hepatology. 2003;37:1495-1496; author reply 1496. [PubMed] [DOI] |
| 8. | Arase Y, Ikeda K, Tsubota A, Suzuki Y, Saitoh S, Kobayashi M, Suzuki F, Akuta N, Someya T, Hosaka T. Efficacy of interferon retreatment after relapse for chronic hepatitis C patients with biochemical response after first interferon therapy. J Gastroenterol. 2004;39:455-460. [PubMed] [DOI] |
| 9. | Fattovich G, Zagni I, Fornaciari G, Minola E, Fabris P, Boccia S, Giusti M, Abbati G, Felder M, Rovere P. Efficacy of prolonged 5 million units of interferon in combination with ribavirin for relapser patients with chronic hepatitis C. J Viral Hepat. 2003;10:111-117. [PubMed] [DOI] |
| 10. | Dettmer RM, Reinus JF, Clain DJ, Aytaman A, Levendoglu H, Bloom AA, Isaacson MP, Spinnell M, Meyer D, Sarabanchong V. Interferon-alpha-2b and ribavirin for retreatment of chronic hepatitis C. Hepatogastroenterology. 2002;49:758-763. [PubMed] |
| 11. | Shiffman ML, Hofmann CM, Gabbay J, Luketic VA, Sterling RK, Sanyal AJ, Contos MJ, Ryan MJ, Yoshida C, Rustgi V. Treatment of chronic hepatitis C in patients who failed interferon monotherapy: effects of higher doses of interferon and ribavirin combination therapy. The Virginia Cooperative Hepatitis Treatment Group. Am J Gastroenterol. 2000;95:2928-2935. [PubMed] [DOI] |
| 12. | Strader DB, Wright T, Thomas DL, Seeff LB; American Association for the Study of Liver Diseases. Diagnosis, management, and treatment of hepatitis C. Hepatology. 2004;39:1147-1171. [PubMed] [DOI] |
| 13. | Puppo F, Torre F, Contini P, Ghio M, Brenci S, Brizzolara R, Sinelli N, Campo N, Indiveri F, Picciotto A. Soluble beta2-mu-associated and beta2-mu-free HLA class I heavy chain serum levels in interferon-alpha nonresponder chronic hepatitis C patients. Markers of immune activation, and response to antiviral retreatment. J Clin Immunol. 2000;20:486-490. [PubMed] [DOI] |
| 14. | Peters MG, Terrault NA. Alcohol use and hepatitis C. Hepatology. 2002;36:S220-S225. [PubMed] |
| 15. | Shiffman ML, Di Bisceglie AM, Lindsay KL, Morishima C, Wright EC, Everson GT, Lok AS, Morgan TR, Bonkovsky HL, Lee WM. Peginterferon alfa-2a and ribavirin in patients with chronic hepatitis C who have failed prior treatment. Gastroenterology. 2004;126:1015-1023; discussion 947. [PubMed] [DOI] |