修回日期: 2004-08-09
接受日期: 2004-08-25
在线出版日期: 2004-10-15
目的: 研究不同基因亚型幽门螺杆菌对大蒜素的敏感性.
方法: 从新鲜胃黏膜中分离、培养出H. pylori共51株. 经聚合酶链反应(PCR)鉴定H. pylori菌株的cagA, vacA(s1, m1b, m2)基因亚型. 用琼脂稀释法测定51例H. pylori分离株对大蒜素的最低抑菌浓度(MIC), 并计算MIC50值.
结果: 大蒜素对51株H. pylori菌株表现出良好的抑菌效果, 总抑菌率达92.2%(47/51), 其MIC50值为7.97 mg/L, MIC值范围在1.25-40 mg/L. vacAm1b+基因亚型H. pylori菌株较vacAm1b-基因亚型H. pylori菌株对大蒜素敏感(相对中位数潜力0.55, 95%可信区间0.30-0.89); vacAm2+基因亚型H. pylori菌株较vacAm2-基因亚型H. pylori菌株对大蒜素敏感(相对中位数潜力0.67, 95%可信区间0.44-0.98). cagA+vacAs1+m1b+ 、cagA+vacAs1+m2+基因亚型组合H. pylori菌株较cagA+vacAs1-m1b- H. pylori菌株对大蒜素敏感(相对中位数潜力0.38/0.37, 95%可信区间0.10-0.78/0.11-0.81).
结论: 大蒜素对H. pylori菌株有良好的抑菌效果, 其MIC50值为7.97 mg/L, MIC值范围在1.25-40 mg/L. 并且其抗菌作用随着大蒜素浓度的增高而加强. 不同基因亚型及组合的H. pylori菌株对大蒜素的敏感性不同.
引文著录: 王莹, 孙丽萍, 袁媛. 不同基因亚型幽门螺杆菌对大蒜素的敏感性. 世界华人消化杂志 2004; 12(10): 2325-2328
Revised: August 9, 2004
Accepted: August 25, 2004
Published online: October 15, 2004
AIM: To study the susceptibility of Helicobacter pylori strains with diversified genotypes to allitridi.
METHODS: Fifty-one strains of H. pylori were isolated and cultured from the fresh gastric mucosal specimens. CagA and vacA (s1, m1b, m2) genotypes of H. pylori were determined by PCR method. Minimal inhibitory concentrations (MICs) of allitridi on 51 H. pylori strains were determined by agar dilution methods. MIC50 was also calculated.
RESULTS: Fifty-one strains of H. pylori were satisfactorily susceptible to allitridi. The gross bacteriostatic rate of allitridi on 51 H. pylori strains was 92.2% (47/51), and MIC50 was 7.97 mg/L. MIC was in a range of 1.25 mg/L to 40 mg/L. H. pylori with vacAm1b+ genotype was more susceptible to allitridi than that with vacAm1b- genotype (relative median potential = 0.55, 95% credible range from 0.30 to 0.89). H. pylori with vacAm2+ genotype was more susceptible to allitridi than that with vacAm2- genotype (relative median potential= 0.67, 95% credible range from 0.44 to 0.98). H. pylori with cagA+ vacAs1+ m1b+, cagA+ vacAs1+ m2+ genotypes were more susceptible to allitridi than those with cagA+vacAs1-m1b- genotypes (relative median potential = 0.38/0.37, 95% Credible Range from 0.10 to 0.78/from 0.11 to 0.81).
CONCLUSION: H. pylori is satisfactorily susceptible to allitridi. The bacteriostatic effect increases with the concentration of allitridi. The MIC50 is 7.97 mg/L and MIC range between 1.25 mg/L and 40 mg/L. Diversified genotypes or genotype combinations of H. pylori show different susceptibilities to allitridi.
- Citation: Wang Y, Sun LP, Yuan Y. Susceptibility of Helicobacter pylori with diversified genotypes to allitridi. Shijie Huaren Xiaohua Zazhi 2004; 12(10): 2325-2328
- URL: https://www.wjgnet.com/1009-3079/full/v12/i10/2325.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i10.2325
幽门螺杆菌(H. pylori)感染与慢性活动性胃炎、消化性溃疡、胃黏膜相关性淋巴组织淋巴瘤(MALT)以及胃癌等的发生有密切的病因学联系[1-7]. H. pylori致病相关基因包括细胞毒素相关基因(cagA)和空泡毒素基因(vacA)等, vacA基因又可根据其中间区(m区)和信号区(s区)分为不同的基因亚型. 不同基因亚型的H. pylori毒力不同, 致病性不同. 根除H. pylori能使胃黏膜炎症消退、溃疡愈合、MALT缓解, 预防及治疗H. pylori感染是胃病防治领域的重要研究课题.
大蒜素是从天然大蒜中提取的有效成分, 研究表明大蒜素可以抑制H. pylori生长、繁殖, 且无毒副作用. 但是其抑制H. pylori的浓度范围没有统一的规范, 不同基因亚型的H. pylori菌株对大蒜素的敏感性是否存在差异, 值得进一步探索. 我们通过对51例H. pylori分离株进行大蒜素体外药敏试验及cagA, vacA基因分型, 探讨不同基因亚型H. pylori菌株对大蒜素敏感性的差异, 以期为大蒜素在临床H. pylori根除治疗中的合理应用提供有价值的参考.
H. pylori菌株51株取自辽宁庄河及沈阳中国医科大学附属第一医院内窥镜中心胃镜活检新鲜胃黏膜组织, 男36例, 女15例; 年龄34-74(平均49.3岁). 大蒜素注射液(Allitridi, 上海禾丰制药厂, 批号 020901). 脱纤维冻融羊血(沈阳市大东区前进生物试剂厂). BH和MH琼脂(Becton Dickinson 公司, 货号 241830和225250). Tag DNA聚合酶、dNTPS及DNA分子标准(大连宝生物公司), 引物为上海生工生物工程技术有限公司合成.
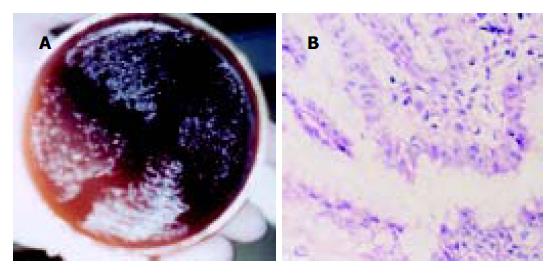
1.2.1 H. pylori培养及鉴定: 将胃黏膜活检标本接种于含70 mL/L羊血的脑心浸液培养基, 三气培养箱内微需氧条件(50 mL/L O2, 100 mL/L CO2, 850 mL/L N2)培养3-7 d后观察, 培养基上出现散在的针尖样、半透明菌落, 刮取阳性菌落, 将其接种到新鲜血平皿上, 继续培养, 直至菌落长满平皿, 收集待用. H. pylori阳性菌株的鉴定方法包括培养基上生长典型菌落(图1A); 革兰染色阴性; H. pylori通用型引物ureB检测出现阳性条带; 将培养病例胃黏膜活检标本石蜡切片HE染色, 光学显微镜下观察, 在胃黏膜表面黏液层及小凹上皮内见呈"S"型弯曲状、杆状细菌者为H. pylori阳性(图1B).
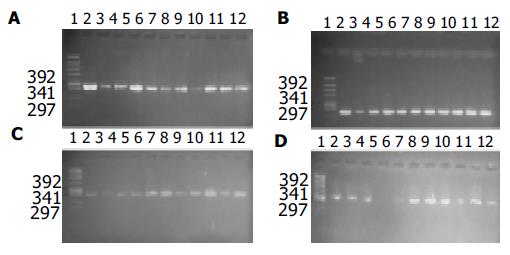
1.2.2 H. pylori基因亚型鉴定: 提取H. pylori菌株DNA, 按已知H. pylori基因亚型特异性引物(表1)进行PCR扩增, 产物经20 g/L琼脂糖凝胶电泳, 确定H. pylori菌株的cagA, vacA(s1, m1b, m2)基因亚型(图2).
| 扩增基因 | 引物 | 引物序列(5'-3') | PCR产物长度(bp) | 参考文献 |
| cagA | CAGAF | GGCAATGGTGGTCCTGGAGCTAGGC | 324 | Pan ZJ[8] |
| CAGAR | GGAAATCTTTAATCTCAGTTCGG | |||
| vacAs1 | VA1-F | ATGGAAATACAACAAACACAC | 259 | Atherton JC[9] |
| VA1-R | CTGCTTGAATGCGCCAAAC | |||
| vacAm1b | VAm-F3 | GGCCCCAATGCAGTCATGGAT | 291 | Atherton JC[10] |
| VAm-R3 | GCTGTTAGTGCCTAAAGAAGCAT | |||
| vacAm2 | VA4-F | GGAGCCCCAGGAAACATTG | 352 | Atherton JC[9] |
| VA4-R | CATAACTAGCGCCTTGCAC |
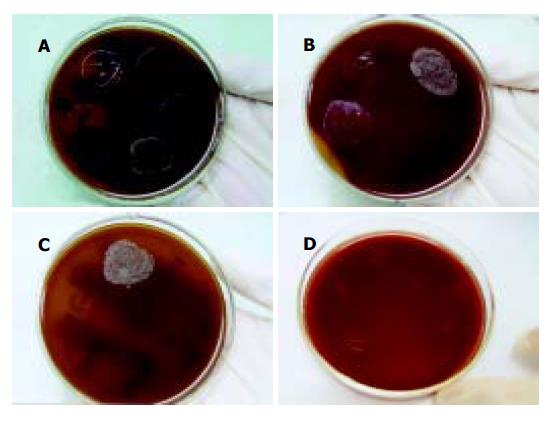
1.2.3 H. pylori菌株对大蒜素最低抑菌浓度(MIC)测定: 按照美国国家临床实验室标准化委员会(NCCLS)制定的琼脂稀释法[8-11]进行药敏试验. 用MH培养基将大蒜素注射液倍比稀释为40-0.3125 mg/L 8个浓度. 将受试菌在H. pylori培养基血平板上转种3次以保证其纯度及活力, 生理盐水制成菌悬液, 浓度相当于2.0号麦氏标准比浊管(1×1010-1×1011 CFU/L菌), 直接点接种于含大蒜素的琼脂稀释法平板(每个点1-3 mL). 另做不含大蒜素的培养基接种菌悬液作阳性对照. 培养条件同前. 结果判定: H. pylori被完全抑制可见生长的最低大蒜素浓度值为其MIC值. 阳性对照培养基上应出现接近融合生长.
统计学处理 应用SPSS 11.5软件包进行概率单位(Probit)分析, 计算大蒜素对H. pylori的MIC50及组间相对中位数潜力, 如果相对中位数潜力的95%可信区间包含1, 即认为两组结果对大蒜素的敏感性无显著差异; 如果相对中位数潜力的95%可信区间不包含1, 即认为两组结果对大蒜素的敏感性有显著差异, 如果1/2组相对中位数潜力值<1, 则表示1组的MIC50<2组的MIC50, 即1组较2组对大蒜素敏感.
在51例H. pylori菌株中, cagA+及cagA-分别占90.2%和9.8%; vacAs1+及vacAs1-分别占62.8%和37.2%; vacAm1b+及vacAm1b-分别占64.7%和35.3%; vacAm2+及vacAm2-分别占74.5%和25.5%.
经概率单位(Probit)分析, 大蒜素对51例H. pylori菌株表现出良好的抑菌效果, 总抑菌率达92.2%(47/51), 其MIC50值为7.97 mg/L, MIC值范围在1.25-40 mg/L. 并且其抗菌作用随着大蒜素浓度的增高而加强(图3).
经概率单位(Probit)分析, cagA+/cagA-, vacAs1+/vacAs1-基因亚型的两组H. pylori菌株对大蒜素的敏感性无显著差异; vacAm1b+/vacAm1b-, vacAm2+/vacAm2-基因亚型的两组H. pylori菌株对大蒜素的敏感性有显著差异, vacAm1b+基因亚型的H. pylori菌株较vacAm1b-菌株对大蒜素敏感, vacAm2+菌株较vacAm2-菌株对大蒜素敏感(表2).
经概率单位(Probit)分析, cagA+vacAs1+m1b+/cagA+vacAs1+m2+基因亚型组合的两组H. pylori菌株对大蒜素的敏感性无显著差异; cagA+vacAs1+m1b+/ cagA+vacAs1-m1b-, cagA+vacAs1+m2+ / cagA+vacAs1-m1b-基因亚型组合的两组H. pylori菌株对大蒜素的敏感性有显著差异, cagA+vacAs1+m1b+, cagA+vacAs1+m2+基因亚型组合的H. pylori菌株较cagA-vacAs1-m1b- H. pylori菌株对大蒜素敏感(表2).
目前普遍认为幽门螺杆菌(H. pylori)感染与多种胃肠道疾病的发生密切相关[12-16]. H. pylori致病相关基因包括细胞毒素相关基因(cagA)和空泡毒素基因(vacA)等. vacA基因又包括中间区(m区)和信号区(s), 据此可将H. pylori分为cagA+/-, vacAm1a+/-, vacAm1b+/-, vacAm1c+/-, vacAm2+/-, vacAs1a+/-, vacAs1b+/-及vacAs2+/-等多种基因亚型, 这些基因亚型又可以产生多种基因亚型的组合, 不同基因亚型与体外毒素活性水平及感染的临床结局密切相关[17-23]. 根除H. pylori可治疗H. pylori相关性疾病[24-28]. 目前使用的标准治疗方案存在着耐药率高、副作用大、患者依从性差、费用高等诸多问题. 如何进行抗H. pylori药物的筛选, 寻找高效、低毒、廉价的抗H. pylori疗法, 特别是挖掘祖国医学宝库、开发新型抗H. pylori药物的研究等引人注目.
近年来发现大蒜素有抑制H. pylori的作用. 但是其抑制H. pylori的浓度范围没有统一的规范. 并且不同基因亚型的H. pylori菌株对大蒜素的敏感性是否存在差异则尚未见报道. 为研究H. pylori对大蒜素的敏感性, 给患者提供较为理想的H. pylori根除药物, 必须进行抗生素敏感性试验. 抗生素敏感性试验常使用最低抑菌浓度(MIC)这一指标, 较低的MIC表示此种抗生素更容易抑制此种微生物.目前H. pylori的抗生素敏感性试验方法很多, 琼脂稀释法在这些试验技术中是要求最高的, 也是惟一被美国国家临床实验室标准化委员会(NCCLS)和美国食品及药品管理局(FAD)批准的试验方法本研究采用. 我们采用琼脂稀释法对51株H. pylori分离株进行大蒜素体外药敏试验. 结果发现大蒜素对51株H. pylori菌株表现出良好的抑菌效果, 总抑菌率达92.2% (47/51), 其MIC50值为7.97 mg/L, MIC值范围在1.25-40 mg/L, 并且其抗菌作用随着大蒜素浓度的增高而加强. 目前国际上尚无对大蒜素抗H. pylori的体外抑菌浓度范围的标准界定, 本尝试有可能为进一步的体内药敏试验用药剂量提供参考.
另外我们还利用目前广泛用于H. pylori菌株基因型研究, 具有一定通用性和特异性的引物, 分别扩增cagA, vacAs, vacAm基因高度保守区域. 然后研究不同cagA/vacA基因亚型H. pylori菌株对大蒜素的敏感性是否存在差异. 结果发现, cagA+/cagA-, vacAs1+/vacAs1-基因亚型的H. pylori菌株对大蒜素的敏感性无显著差异; vacAm1b+/vacAm1b-及vacAm2+/vacAm2- H. pylori菌株对大蒜素的敏感性组间差异有统计学意义: vacAm1b+基因亚型的H. pylori菌株较vacAm1b-基因亚型的H. pylori菌株对大蒜素敏感; vacAm2+基因亚型的H. pylori菌株较vacAm2-基因亚型的H. pylori菌株对大蒜素敏感; 不同cagA/vacA基因亚型组合的H. pylori菌株对大蒜素敏感性不同: cagA+vacAs1+m1b+/ cagA+vacAs1+m2+基因亚型组合的两组H. pylori菌株对大蒜素的敏感性无显著差异; cagA+vacAs1+m1b+/cagA+vacAs1-m1b-, cagA+vacAs1+m2+ / cagA+vacAs1-m1b-基因亚型组合的两组H. pylori菌株对大蒜素的敏感性有显著差异; cagA+/vacAs1+m1b+, cagA+vacAs1+m2+基因亚型组合的H. pylori菌株较cagA+/vacAs1-m1b- H. pylori菌株对大蒜素敏感. 此结果是否适用于其他抗H. pylori药物还需在进一步的试验中得到验证. Doorn et al报道, 兰索拉唑、胶体铋、四环素、大蒜素联合用药治疗不同cagA/vacA基因亚型H. pylori菌株感染患者, 发现不同基因型的H. pylori菌株对抗生素治疗具有不同的反应, s1/m1和s1/m2型产毒素菌株(大多为cagA+)较s2/m2型非产毒素菌株(大多为cagA-)对治疗更为敏感. 可能因为毒力不同的H. pylori菌株能引起胃内不同的生理变化, 毒力强的菌株引起的炎症较重, 而抗生素在炎症黏膜可达到更高的浓度, 使之较易被根除. 本试验中vacAm1b+基因亚型的H. pylori菌株较vacAm1b-基因亚型的H. pylori菌株对大蒜素敏感; vacAm2+基因亚型的H. pylori菌株较vacAm2-基因亚型的H. pylori菌株对大蒜素敏感; cagA+vacAs1+m1b+, cagA+vacAs1+m2+ H. pylori菌株较cagA+vacAs1-m1b- H. pylori菌株对大蒜素敏感, 可能因为这些亚型及组合的菌株毒力较强, 增生迅速, 因而对干扰细菌细胞的分裂、生长和代谢的大蒜素活性更为敏感. 如果此型毒力强的H. pylori菌株在宿主胃黏膜内定殖而未及时根治清除, 则有可能产生较严重的胃黏膜损伤, 进一步引起较严重的胃疾病, 甚至导致胃癌的发生.我们建议采取"因型施治"的原则, 充分发挥大蒜的药用价值, 有望为H. pylori感染治疗开辟一条新的途径.
| 1. | Blaser MJ, Berg DE. Helicobacter pylori genetic diversity and risk of human disease. J Clin Invest. 2001;107:767-773. [PubMed] [DOI] |
| 3. | Shirai Y, Wakatsuki Y, Kusumoto T, Nakata M, Yoshida M, Usui T, Iizuka T, Kita T. Induction and maintenance of immune effector cells in the gastric tissue of mice orally immunized to Helicobacter pylori requires salivary glands. Gastroenterology. 2000;118:749-759. [PubMed] [DOI] |
| 5. | Locatelli A, Catapani WR, Gomes CR Jr, Silva CB, Waisberg J. Detection of anti-Helicobacter pylori antibodies in serum and duodenal fluid in peptic gastroduodenal disease. World J Gastroenterol. 2004;10:2997-3000. [PubMed] [DOI] |
| 6. | 周 志韶, 马 澄城, 廖 赞豪, 赵 毅, 郑 永雄, 潘 文雄, 黄 盛宜. 广东潮阳地区海尔曼螺杆菌感染与食管疾病的相关性研究. 世界华人消化杂志. 2004;12:1593-1595. [DOI] |
| 8. | van der Ende A, Pan ZJ, Bart A, van der Hulst RW, Feller M, Xiao SD, Tytgat GN, Dankert J. cagA-positive Helicobacter pylori populations in China and The Netherlands are distinct. Infect Immun. 1998;66:1822-1826. [PubMed] |
| 9. | Atherton JC, Cao P, Peek RM Jr, Tummuru MK, Blaser MJ, Cover TL. Mosaicism in vacuolating cytotoxin alleles of Helicobacter pylori. Association of specific vacA types with cytotoxin production and peptic ulceration. J Biol Chem. 1995;270:17771-17777. [PubMed] [DOI] |
| 10. | Atherton JC, Sharp PM, Cover TL, Gonzalez-Valencia G, Peek RM Jr, Thompson SA, Hawkey CJ, Blaser MJ. Vacuolating cytotoxin (vacA) alleles of Helicobacter pylori comprise two geographically widespread types, m1 and m2, and have evolved through limited recombination. Curr Microbiol. 1999;39:211-218. [PubMed] [DOI] |
| 15. | 郭 继忠, 占 强, 朱 晓红, 夏 敏, 尤 一萍, 杜 虎, 张 国强, 严 洁. 血清抗幽门螺杆菌热休克蛋白60抗体与慢性萎缩性胃炎的关系. 中华消化杂志. 2004;24:246-247. |
| 18. | 陶 然, 方 平楚, 刘 海燕, 姜 云水, 陈 晶. 浙江地区幽门螺杆菌cagA基因3′区多态性研究. 中华微生物学和免疫学杂志. 2004;24:576. |
| 19. | Yang GF, Deng CS, Xiong YY, Gong LL, Wang BC, Luo J. Expression of nuclear factor-kappa B and target genes in gastric precancerous lesions and adenocarcinoma: association with Helicobactor pylori cagA (+) infection. World J Gastroenterol. 2004;10:491-496. [PubMed] [DOI] |
| 20. | Liu XL, Li SQ, Liu CJ, Tao HX, Zhang ZS. Antigen epitope of Helicobacter pylori vacuolating cytotoxin A. World J Gastroenterol. 2004;10:2340-2343. [PubMed] [DOI] |