修回日期: 2003-05-25
接受日期: 2003-06-02
在线出版日期: 2004-01-15
目的: 了解胃癌组织中DC的功能状态, 探讨DC及其所分泌的亚细胞成分exosomes用于防治胃癌的可能性, 旨在为胃癌的治疗探索一条新的途径.
方法: 利用致敏DC及其所分泌的亚细胞成分exosomes对荷胃癌小鼠进行治疗, 观察其免疫治疗效果.
结果: 荷胃癌小鼠经胃癌细胞RNA致敏的DC及其所分泌的亚细胞成分exosomes治疗后, 小鼠腹水产生率、肿瘤转移率、动物的存活率、瘤体平均质量等指标均明显优于对照组(P<0.01), 局部组织中IL-12、IFN 和IL-18的基因表达水平都明显升高(P<0.01), 肿瘤局部CD4+、CD8+细胞数量增加(P<0.05), TIL细胞毒活性明显增强.
结论: 胃癌RNA致敏的DC及其所分泌的亚细胞成分exoso-mes, 能促进胃癌抗原的提呈, 并启动和增强局部的抗瘤免疫功能, 改善临床症状和宿主的生存质量, 对荷胃癌小鼠具有一定的免疫治疗效果.
引文著录: 罗治彬, 徐采朴, 王东, 王阁, 肖世全, 朱高友, 房殿春. 致敏树突细胞及其亚细胞成分对荷胃癌小鼠的免疫治疗作用研究. 世界华人消化杂志 2004; 12(1): 9-12
Revised: May 25, 2003
Accepted: June 2, 2003
Published online: January 15, 2004
AIM: To unravel the functional status of dendritic cells (DCs) in the tissue of gastric cancer (GC) and precancerous lesions, and to explore the possibility of treating and preventing gastric carcinoma with activated DCs and their exosomes.
METHODS: The tumor-bearing mice were treated with DCs sensitized by mRNA of gastric cancer cells and their exosomes, and efficacy of the immunotherapy was observed.
RESULTS: The indices such as the production rate of ascites of mice (75%), the metastasis rate of tumor (25%), the survival rate of animals (75%) and the average mass of tumor (2.04±0.33 g) showed that the condition of the mice treated with DCs was better than that in the control group (P < 0.01). The level of gene expression of IL-12, IFN and IL-18 in local tumor tissue was significantly risen (P < 0.01), the local CD4+ and CD8+ cells were increased (P < 0.05) and the cytotoxicity of TIL was remarkably enhanced. After immunotherapy of the tumor-bearing mice by using exosomes from DCs transfected with mRNA isolated from murine tumor cells, the indices were as good as those of sensitized DCs. However, DCs transfected with mRNA isolated from mouse tumor cells could effectively inhibit the growth of tumor and ameliorate the symptoms, showing a certain therapeutic efficiency for mice carrying tumor.
CONCLUSION: DCs-derived exosomes sensitized by RNA of gastric carcinoma cells can not only intensify the local immunologic function of GC but also make a better survival quality of the tumor-bearing host. Being a new type of therapeutic vaccine, exosomes is an important investigative value and a prospect of development.
- Citation: Luo ZB, Xu CP, Wang D, Wang G, Xiao SQ, Zhu GY, Fang DC. Immunotherapy of dendritic cells and its exosomes transfected with mRNA of gastric cancer cells in tumor-carried mice. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 9-12
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/9.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.9
树突状细胞(dendritic cells, DC)是体内最有效的抗原提呈细胞(antigen-presenting cells, APC), 是T细胞依赖性免疫应答的重要辅助细胞. 癌前状态胃黏膜中DC数量显著增多, 功能增强; 而胃癌患者胃黏膜中肿瘤浸润DC(tumor infiltrating dendritic cells, TIDC)数量随分化程度的降低而减少, TIDC提呈胃癌抗原引起宿主免疫抵抗的能力较弱, 胃黏膜中DC细胞功能的抑制是导致胃黏膜免疫功能低下和癌前状态发生癌变的重要原因之一[1-5]. DC除了细胞间直接接触和通过分泌细胞因子参与机体免疫调节的作用方式之外, 还可通过分泌或外排具有Ag提呈能力的亚细胞成分exosomes来诱导T细胞免疫反应[6]. Exosomes能表达MHC分子和CD86, 能在体外刺激Ag特异性CD8+ T细胞增生; 肿瘤来源的exosomes带有相关的肿瘤抗原信息, 能够像DC一样向T细胞提呈肿瘤抗原[7]. 我们利用致敏DC及其所分泌的亚细胞成分exosomes对荷瘤小鼠的肿瘤进行治疗.
-80 ℃低温冰箱Nuaire公司; 低温高速离心机Biofuge 22R, Heraeus; 低温超速离心机Chimac CR-21E; 60Co射线放射源, 本院放射科; PCR循环仪, 2400型, Perkin-Eler; 凝胶成像仪, Gel Doc 2000, Bio-Rad; 图像分析仪, Tiger920型; MFC(mouse forestomach carcinoma): 小鼠的前胃癌细胞系, 从中国科学院上海细胞所引进; IFN、L-18 primer: 上海生工生物工程公司合成; Cytotoxicity Detection Kit(LDH)及Lipotectimin DOTAP: Boehringer Mannheim; Purified rat anti-mouse CD8 α(Ly-2) mAb: cat#01041D, Phamingen; Access RT-PCR System: cat# A1250, Promega; Exosome提取缓冲液(pH7.4). 615小鼠, SPF级, 6-8周龄, 购自第三军医大学实验动物中心(川实动管使第015号, 川实动管质第058号).
1.2.1 MFC RNA冲击DC对小鼠的免疫治疗作用: MFC RNA冲击DC对小鼠的免疫治疗作用研究分3组: RNA-DC1, PBS1, 灭活MFC, 各8只615小鼠; Exosomes对胃癌的治疗作用研究分3组: RNA-DC2, DC, PBS2, 各8只615小鼠. RNA提取选用生长期MFC细胞, 加入TripureTM分离试剂按其说明书进行分离操作, 用紫外分光光度计定量后备用. 从小鼠骨髓的CD34+细胞中扩增、分离出大量纯化DC, 在15 mL的聚丙烯试管中洗涤DC 2次、重悬, 细胞浓度调为5.0×109/L, 移入另一支15 mL聚苯乙烯试管中; 将25 g MFC RNA (250 L)与50 g DOTAP (250 L, 培养基配制)混匀, 20 ℃孵育10 min; 将上述混合物加入5.0×109/L DC中37 ℃培养40 min (间断晃动). 洗涤后重悬于无菌磷酸盐缓冲液(PBS)中(2.0×108/L), 30 Gy灭活备用. 各组615小鼠腋窝皮下注射2×108/L MFC 500 L/鼠; 第7 d分别给各组615小鼠腹腔注射已制好的30 Gy灭活MFC RNA致敏DC(RNA-DC1组)、PBS(PBS1组)、30Gy灭活的2×108 /L MFC(灭活MFC组)各500 L/鼠; 3 d后复种1次, 以后每天观察小鼠肿瘤的生长情况及其存活率; 第21 d处死小鼠, 取肿瘤组织分离TIL(tumor infiltrating lymphocyte)以检测其细胞毒活性; 取肿瘤组织分别进行CD4+、CD8+细胞的免疫组化染色、用RT-PCR和原位杂交染色检测细胞因子IL-12、IL-18、IFN.
1.2.2 Exosomes对胃癌的治疗作用: 参照文献[4,8-10]改良提取exosomes. DC、MFC RNA致敏DC细胞500 g 离心10 min, 2次; 细胞上清37 ℃ 培养24 h; 20 000 g 离心20 min; 上清150 000 g离心 90 min; 沉淀(即exosomes)重悬于缓冲液中; 紫外分光光度计定量. 各组615小鼠腋窝皮下注射1×108 /L MFC 500 L/鼠; 第7 d分别给各组615小鼠皮下注射来自MFC RNA冲击DC(RNA-DC2组)和DC (DC组)的exosomes各10 g, 对照组为PBS(PBS2组), 隔4 d重复1次; 每天观察小鼠肿瘤的生长、情况及其存活率; 第21 d处死小鼠, 取肿瘤组织分离TIL以检测其细胞毒活性; 取肿瘤组织分别进行CD4+、CD8+细胞的免疫组化染色、用RT-PCR和原位杂交染色检测细胞因子IL-12、IL-18、IFN.
1.2.3 细胞毒活性检测: 无菌条件下将新鲜肿瘤组织剪碎、匀浆、过滤、离心, 不连续密度梯度离心, 收集界面细胞用RPMI 1640培养液调浓度为1×109 /L, 加入rIL-2 100 g/L在5% CO2 37 ℃培养, 每天观察1次, 每3 d换液1次(当密度大于2×109/L时补充rIL-2并调整细胞浓度); 用前500 g离心3 min, 生理盐水洗涤1次, 计数后备用. 效-靶细胞混合物(effector-target cell mix, E-T)及效应细胞(effector cell, EC)各12孔, 另设背景对照、自发(Low)对照、最大释放(High) 对照, 分别设3个复孔; 按说明书进行操作, ELISA机测读A490 nm值. 细胞介导的细胞毒活性计算公式如下: 细胞毒活性(%) = [(效-靶细胞混合物-背景对照)-自发对照]÷(最大释放对照-自发对照) ×100%.
1.2.4 RT-PCR, SP和原位杂交 根据GenBank中检索的小鼠IL-18、IFN 的完整cDNA序列, 利用PRIMER软件设计PCR成对引物. IL-18: 上游引物5'-ACTGTACAACCGCAGTAA TA C-3', 下游引物5'-AGTGAACATTAC AG ATTTATCCC-3'(扩增产物片段长度434 bp、退火温度56 ℃); IFN: 上游引物5'-AAC GCTACACACTGCATCTTGG-3', 下游引物5'-GACTTCAA AGAGTCTGAGG -3'(扩增产物片段长度237 bp、退火温度56 ℃). 在PCR管中加入: 5×buffer 5.0 L、dNTP 2.0 L、ddH2O (DEPC) 11 L、specific Primer 1.5 L、GAPDH Primer 1.5 L、MgC12 1.0 L、Totel RN A 2.0 L、AMV 0.5 L、Tf1 DNA 0.5 L (Totel 25 L), 48 ℃ 45 min; 94 ℃ 2 min; 94 ℃ 40 s, 退火 40 s, 68 ℃ 120 s, 35 个循环, 68 ℃ 10 min; 20 g/L琼脂糖电泳后凝胶照像记录. 免疫组化染色(SP法)和原位杂交检测IL-12 P40 mRNA按文献[1]介绍方法进行.
统计学处理 采用第三军医大学数学教研室编制的数理统计程序包SPRm作单因素方差分析、二维列联表统计, 结果以mean±SD表示, P<0.05为相差显著.
RNA-DC1组、RNA-DC2组小鼠经治疗后肿瘤生长相对减慢, 未见大范围的转移, 腹水量少, 动物精神状况稍有好转. 而PBS1组、PBS2组小鼠肿瘤生长仍然快, 精神食欲差, 嗜睡, 明显衰竭; 全身皮下可见大小不等的多个转移灶和新旧不一的出血斑, 腹水明显、呈蛙腹状, 小鼠死亡率高. 灭活MFC组和DC组情况介于二者之间(表1).
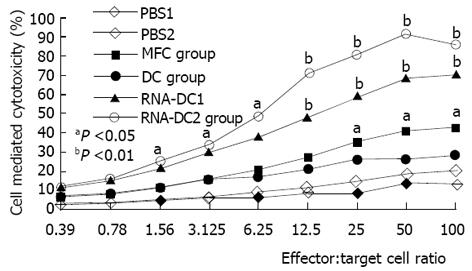
RNA-DC1、RNA-DC2组的细胞毒活性明显高于相同效靶比的相应PBS组 (P<0.05, 或P<0.01, 图1). CD4+、CD8+细胞散在分布, 阳性产物主要呈现在细胞膜上. RNA-DC1组CD4+、CD8+细胞数量分别为0.71±0.25/m2和0.67±0.22/m2, RNA-DC2组CD4+、CD8+细胞数量分别为1.15±0.33/m2和0.98±0.16/m2, 均明显高于相应的PBS组(P<0.05); MFC组、DC组CD4+、CD8+细胞数与PBS组无显著差异(P>0.05).
RNA-DC1组、RNA-DC2组IL-12 p40 mRNA阳性产物的面积比率显著高于相应PBS组(P<0.01); 而其阳性产物的平均吸光度与PBS组均无差异(P>0.05). 用四星图形分析软件半定量, 以各自GADPH条带设定本底值, 测定目的片段的PCR产物的积分吸光度. 结果显示: RNA-DC1组、RNA-DC2组IL-18 mRNA、IFNmRNA阳性产物的平均吸光度显著高于PBS组 (P<0.05); 而DC组、MFC组与PBS组相比则无差异(P>0.05).
DC网络是体内能提呈抗原给未致敏或静息T细胞的特异系统, 除了DC细胞间直接接触和通过分泌细胞因子参与机体免疫调节的作用方式[11-17]之外, 还可通过分泌或外排具有Ag提呈能力的exosomes[7-9]来诱导T细胞免疫反应. 病毒、细菌和肿瘤抗原致敏DC诱导特异CTL, 可作为新型疫苗研制的基石. Boczkowski et al[18]发现RNA抗原比肿瘤洗脱肽抗原能更高效地致敏DC, 用含OVA抗原的肿瘤细胞来源的RNA致敏的DC能更有效地激活OVA特异性CTL的产生, 并且完全能够保护宿主不再受表达OVA的肿瘤细胞的攻击. 研究表明: 若同时用CD4+ mAb和CD8+ mAb去除CD4+和CD8+ T细胞, 可完全抑制DC接种后所诱导的免疫作用; 因此, DC接种后诱导免疫应答的发生同时需要CD4+和CD8+T细胞的存在. 我们发现: RNA-DC接种后, 肿瘤局部CD4+、CD8+细胞的数量均有一定程度的增加, 局部肿瘤组织中TIL细胞的细胞毒活性也明显增强, 说明DC诱导的免疫应答与CD4+、CD8+ T细胞密切有关. 我们还发现: 给RNA-DC2组荷瘤小鼠注射exosomes后, 肿瘤局部CD4+、CD8+细胞的数量明显增加, TIL细胞的细胞毒活性也有了明显提高, 并且其细胞毒活性随着效靶细胞比值的增加而增加; 同时, 细胞因子IL-12、IL-18和IFN的基因表达较对照组明显增多. 这都表明, RNA致敏DC分泌的exosomes能和RNA致敏DC一样, 能通过有效提呈胃癌抗原, 诱导局部组织Thl型细胞因子表达增加, 进一步促进了CTL的成熟和抗体的合成和分泌, 加上局部TIL和NK细胞的细胞毒作用, 这都成了其杀灭肿瘤细胞、控制肿瘤生长和转移的分子免疫基础. 我们的结果与文献[11,19-22]报道是一致的.
但是, 我们尚末发现一例小鼠的肿瘤有明显缩小或完全消退, 只是发现exosomes治疗后肿瘤生长明显减慢、治疗组小鼠的精神食欲等状况相对较好、没有明显的转移灶和大量腹水生成, 这与文献[23]报告的注射exosomes一次(5 g)即可治愈的结果尚有不小的差距. 我们认为, 这可能与致敏DC时所用RNA的含量、转导效率、以及exosomes的纯度等多种因素的影响有关; 也可能与他们治疗用的瘤体直径太小有关(0.1 cm). 从这个角度看, exosomes治疗实体瘤尤其是中晚期肿瘤仍然有一段很长的路要走, 他对治疗较早期的肿瘤效果较好, 可以很好地控制肿瘤的生长, 甚至可以完全治愈. 致敏exosomes的确起到了比DC更好的作用, 有更强的抗瘤效果. 这种有抗原提呈功能的亚细胞成分, 一旦获得即可长时间保存、省却了长期培养肿瘤抗原致敏DC的困难, 而且实际使用中的可操作性和可控性更强. 因此我们有理由认为, 肿瘤抗原致敏DC分泌的亚细胞成分exosomes作为一种新型的抗肿瘤药物, 对肿瘤的预防和治疗都有很好的研究价值, 具有广阔的开发前景.
编辑: N/A
| 2. | Luo ZB, Xu CP, Luo YH, Zhang PB. 11th Asian pacific congress of gastroenterology and 8th asian pacific congress of digestive endoscopy. Hong Kong, China, March 10-14, 2000. Abstracts. J Gastroenterol Hepatol. 2000;15:B1-132. [PubMed] |
| 4. | Takahashi A, Kono K, Itakura J, Amemiya H, Feng Tang R, Iizuka H, Fujii H, Matsumoto Y. Correlation of vascular endothelial growth factor-C expression with tumor-infiltrating dendritic cells in gastric cancer. Oncology. 2002;62:121-127. [PubMed] [DOI] |
| 5. | Galetto A, Contarini M, Sapino A, Cassoni P, Consalvo E, Forno S, Pezzi C, Barnaba V, Mussa A, Matera L. Ex vivo host response to gastrointestinal cancer cells presented by autologous dendritic cells. J Surg Res. 2001;100:32-38. [PubMed] [DOI] |
| 6. | Ludewig B, Ochsenbein AF, Odermatt B. Immunotherapy with dendritic cells directed against tumor antigens shared with normal host cells results in severe autoimmune disease. J Exp Med. 2000;191:795-803. [DOI] |
| 7. | Wolfers J, Lozier A, Raposo G, Regnault A, Thery C, Masurier C, Flament C, Pouzieux S, Faure F, Tursz T. Tumor-derived exosomes are a source of shared tumor rejection antigens for CTL cross- priming. Nat Med. 2001;7:297-303. [PubMed] [DOI] |
| 8. | Barbulescu K, Becker C, Schlak JF. Cutting edge: IL-12 and IL-18 differentially regulate the transcriptional activity of the human INF promoter in primary CD4+ T lymphocytes. J Immunol. 1998;160:3642-3653. |
| 9. | Osaki T, Hashimoto W, Gambotto A. Potent antitumor effects mediated by local expression of the mature form of the interferon-gamma inducing factor, interleukin-18(IL-18). Gene Ther. 1999;6:808-812. [DOI] |
| 10. | Lamparski HG, Metha-Damani A, Yao JY, Patel S, Hsu DH, Ruegg C, Le Pecq JB. Production and characterization of clinical grade exosomes derived from dendritic cells. J Immunol Methods. 2002;270:211-226. [PubMed] [DOI] |
| 11. | Buttiglieri S, Galetto A, Forno S, De Andrea M, Matera L. Influence of drug-induced apoptotic death on processing and presentation of tumor antigens by dendritic cells. Int J Cancer. 2003;106:516-520. [PubMed] [DOI] |
| 12. | Nakayama H, Enzan H, Miyazaki E, Kuroda N, Naruse K, Kiyoku H, Toi M, Hiroi M. CD34 positive stromal cells in gastric adenocarcinomas. J Clin Pathol. 2001;54:846-848. [PubMed] [DOI] |
| 17. | 刘 剑勇, 张 力图, 李 挺, 赵 荫农, 张 春燕, 陈 建思, 张 丽生, 覃 宇周, 吴 飞翔, 唐 凯. 树突状细胞诱导肿瘤浸润性淋巴细胞抗胃癌免疫的研究. 世界华人消化杂志. 2002;10:467-469. [DOI] |
| 18. | Boczkowski D, Nair SK, Nam JH. Induction of tumor immunity and cytotoxic T lymphocyte responses using dendritic cells transfected with messenger RNA amplified from tumor cells. Cancer Res. 2000;60:1028-1042. |
| 19. | Chaput N, Schartz NE, Andre F, Zitvogel L. Exosomes for immunotherapy of cancer. Adv Exp Med Biol. 2003;532:215-221. [PubMed] [DOI] |
| 20. | Brouwer R, Pruijn GJ, van Venrooij WJ. The human exosome: an autoantigenic complex of exoribonucleases in myositis and scleroderma. Arthritis Res. 2001;3:102-106. [PubMed] [DOI] |
| 21. | Kim CH, Todoroki T, Matsumura M, Ohno T. Eligibility of antigenic-peptide-pre-loaded and fixed adhesive peripheral blood cells for induction of cytotoxic T lymphocytes from cancer patients with elevated serum levels of carcinoembryonic antigen. J Cancer Res Clin Oncol. 2000;126:383-390. [PubMed] [DOI] |
| 22. | Ishigami S, Natsugoe S, Hokita S, Xiangming C, Aridome K, Iwashige H, Tokuda K, Nakajo A, Miyazono F, Aikou T. Intranodal antitumor immunocyte infiltration in node-negative gastric cancers. Clin Cancer Res. 2000;6:2611-2617. [PubMed] |
| 23. | Thery C, Regnault A, Garin J. Molecular characterization of dendritic cell-derived exosomes. Selective accumulation of the heat shock protein hsc73. J Cell Biol. 1999;147:599-611. [DOI] |