修回日期: 2003-05-25
接受日期: 2003-06-02
在线出版日期: 2004-01-15
目的: 探讨三氧化二砷(As2O3)注射液抗肿瘤血管形成的作用及其相关机制.
方法: 采用MTT比色法、鸡胚绒毛尿囊膜(CAM)血管形成实验和免疫组化等方法观察As2O3对内皮细胞株ECV304增生、CAM 血管形成以及对裸鼠肝癌移植瘤LCI-D20表达血管内皮生长因子(VEGF)的影响.
结果: As2O3有显著抑制内皮细胞增生作用; 能抑制CAM血管形成, 其机制与损伤形成血管的原始间充质细胞、破坏血管形成中的内皮细胞的结构和功能有关; As2O3并能降低裸鼠人肝癌转移模型肝移植瘤VEGF的表达.
结论: As2O3注射液有明显的抗肿瘤血管形成作用, 其机制可能与破坏内皮细胞结构和功能、抑制内皮细胞增生以及抑制肿瘤组织表达VEGF有关.
引文著录: 华海清, 秦叔逵, 王锦鸿, 陈惠英. 三氧化二砷抗肿瘤血管形成研究. 世界华人消化杂志 2004; 12(1): 27-31
Revised: May 25, 2003
Accepted: June 2, 2003
Published online: January 15, 2004
AIM: To explore the effects and mechanisms of anti-vascularization of arsenic trioxide (As2O3) injection on the human hepatocellular carcinoma (HCC) cells.
METHODS: Human umbilical vein cell line ECV304 and the nude mice with the high metastastic human HCC transplanted in situ LCI-D20 were used. The growth of ECV304 was analyzed by MTT assay. The inhibitory effect of As2O3 on tumor neo-vascularization was investigated by the method of chick chorioallantoic membrane (CAM). The changes of VEGF's expression in the transplanted HCC tissue were investigated by using immunohistochemical SP staining.
RESULTS: As2O3 could inhibit the growth of ECV304 cell line, and down-regulate VEGF's expression. As2O3 could also inhibit the vascularization in the CAM, and electron microscopy showed that As2O3 could damage primitive mesenchymal cells and vascular endothelial cells, and inhibite neovascular gemmation. The expression of VEGF was down-regulated in vivo studies.
CONCLUSION: As2O3 injection can inhibit the tumor neovascularization by supressing the growth of vascular endothelial cell, down-regulating the expression of VEGF, damaging the primitive mesenchymal cells and inhibiting neovascular fromation.
- Citation: Hua HQ, Qin SK, Wang JH, Chen HY. Effect of arsenic trioxide on vascularization of tumor. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 27-31
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/27.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.27
近年来, 有关肿瘤血管形成的研究已成为肿瘤研究的热点[1-15]. 肿瘤的生长、扩散与转移离不开肿瘤血管的形成, 肿瘤细胞通过新形成的血管吸取营养而无限制的生长, 使肿瘤不断增大, 同时又可通过不健全的血管进入血液循环而向远处扩散和转移, 因此, 如何应用药物来阻断肿瘤新生血管的形成已是控制肿瘤生长和转移的关键措施之一[16-22]. 三氧化二砷(As2O3)注射液已获得我国SDA和美国FDA批准上市. 研究表明, As2O3具有诱导和促进肿瘤细胞凋亡和细胞毒等作用, 是否具有抗肿瘤血管形成作用尚未见报道. 我们通过观察As2O3对内皮细胞、肿瘤组织表达血管内皮生长因子(VEGF)的影响以及对鸡胚绒毛尿囊膜(CAM)新生血管形成的作用, 意在阐明As2O3抗肿瘤的作用机制, 为临床用药奠定基础.
人类肝癌细胞株SMMC-7221和建株人脐静脉内皮细胞(ECV304), 均引自中国科学院上海细胞生物研究所; As2O3注射液(亚砷酸注射液)为哈尔滨伊达药业有限公司产品; 胰蛋白酶为美国Difco公司产品; 小牛血清系杭州四季青生物工程公司产品. MTT试剂为美国Fluka公司产品; M-450甲基纤维素为南京化工原料公司产品. 鼠抗人VEGFmAb、鼠抗人CD34mAb及超敏SP(鼠)试剂盒为美国 Maxim Biotech, Inc. 公司产品; 液体DAB酶底物显色试剂盒为福建迈新生物技术开发公司产品; 受精鸡胚购自中牧集团南京小行药械厂动物繁殖场. ECV304细胞接种于无菌培养瓶中, 加入适量RPMI1640培养液(含100 mL/L的小牛血清、青霉素100 ku/L、链霉素100 mg/L), 于37 ℃、50 mL/L CO2及饱和湿度的培养箱中培养. 细胞呈单纯贴壁生长, 每3-5 d传代1次. 传代时用2.5 g/L胰蛋白酶消化2-3 min, 用培养液吹打制成细胞悬液, 按需要的浓度接种. 甲基纤维素碟制备: M450甲基纤维素0.5 g, 加双蒸水100 mL, 高压灭菌. 取上述溶液120 L分6次加入自制的直径为4 mm、深0.5 mm的塑料板圆形小槽中, 超净台内吹干, 将膜取下, 无菌保存备用.
1.2.1 抑制细胞生长: 取3×107/L的ECV304细胞接种于96孔培养板中, 每孔100 L, 设4复孔, 待细胞贴壁后(4-5 h), 加入浓度分别为2 mg/L, 4 mg/L, 8 mg/L的As2O3注射液100 L /孔, 对照孔加入100 L培养液, 置于37℃、50 mL/L CO2的培养箱中培养至预定时间, 每孔加入5 g/L的MTT20 L, 继续培养4 h, 弃去全部上清, 每孔加入0.04 mol/L盐酸异丙醇100 L, 微型振荡器振荡5-10 min使结晶完全溶解, 在酶联仪波长570 nm处测出用药后24 h、48 h、72 h各孔吸光度值(A), 按下列公式计算细胞生长抑制率: 抑制率(%)=(1-加药孔平均A值/对照孔平均A值)×100%. 实验共重复3次.
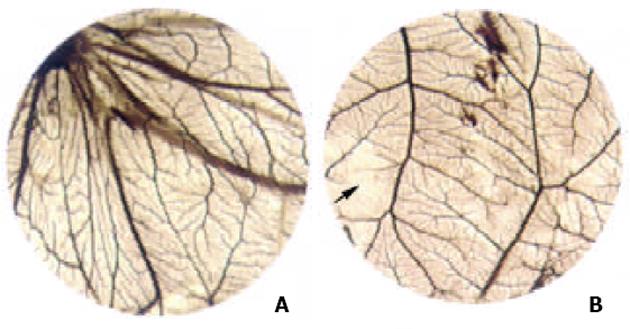
1.2.2 鸡胚尿囊膜[CAM]新生血管形成: 取繁殖场孵化的9 d龄受精鸡卵, 在照卵灯下寻找胚头右下方血管稀少区(约胚头右下方0.5-1.0 cm处), 划定1 cm×1 cm开窗位置, 在鸡胚气室端钻1 mm小孔并穿透壳膜. 用75%乙醇消毒开窗部位, 用手术剪轻轻揭去蛋壳及壳膜, 暴露出鸡胚尿囊膜, 将甲基纤维素碟轻轻放置于尿囊膜上血管较少的部位, 用微量进样器将浓度分别为40 mg/L, 20 mg/L, 10 mg/L的As2O3注射液20 L滴入甲基纤维素碟中, 阳性对照组用人参皂甙Rg3溶液(用无菌等渗盐水配制), 浓度为250 mg/L, 阴性对照组用生理盐水, 滴入量同As2O3组, 用无菌透明胶带封窗后放入孵化箱, 37.8 ℃继续孵化, 3 d后揭去透明胶带, 加入若干甲醇、丙酮等量混合固定液, 在室温下固定15 min, 待绒毛尿囊膜血管中的血液凝固后, 以纤维素小碟为中心剪下直径约3 cm的尿囊膜, 放入盛有水的平皿内展开, 然后平铺于滤纸上, 解剖显微镜下观察用药区血管形成情况. 甲基纤维素碟覆盖区及周围血管形成正常为(-); 甲基纤维素碟覆盖区无血管或血管明显稀少且直径大于或等于4 mm为阳性(+); 直径大于6 mm为强阳性(++). 根据这一评定标准, 计算出20个经药物作用的鸡胚尿囊膜血管受到抑制(+)的百分率.
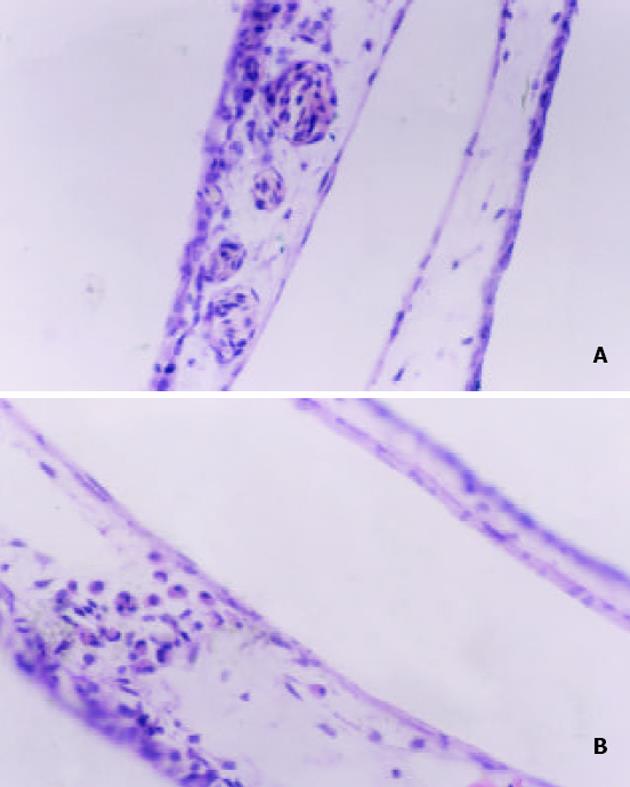
1.2.3 SMMC-7721细胞诱导新生血管形成: 9 天龄鸡胚45只, 随机分为3组, 每组15只, 按上述方法暴露鸡胚尿囊膜, 在相对无血管处接种对数生长期的SMMC-7721细胞, 每只5×109/L, 共接种2组. 接种24 h后以甲基纤维素碟为载体, As2O3组每只给予40 mg/L的As2O3注射液20 L, 对照组及未接种SMMC-7721细胞的空白组给予等量的生理盐水, 用无菌透明胶带封窗后放入孵化箱, 37.8 ℃继续孵化, 3 d后, CAM用40 g/L多聚甲醛原位固定15 min, 以接种区为中心取膜, 常规石蜡包埋, 切片, HE染色, 光镜下观察接种区新生血管的分布、数量等情况.
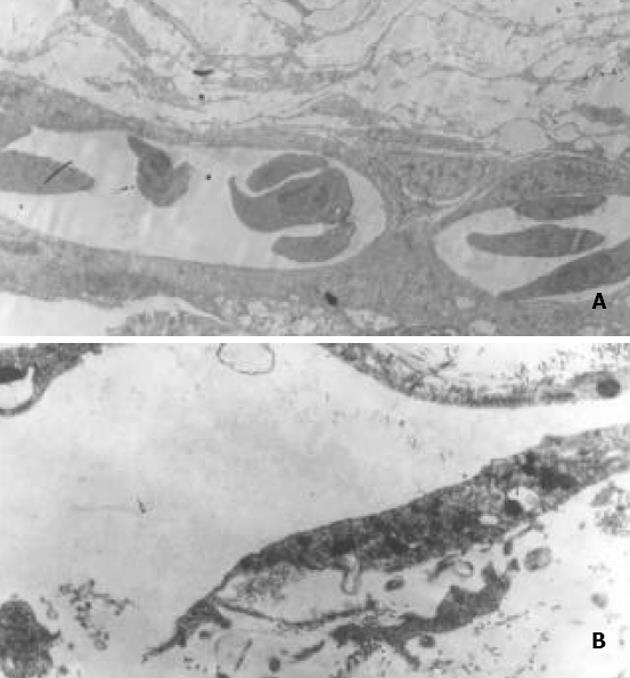
1.2.4 透射电镜观察: 取9 天龄鸡胚24只, 随机分为As2O3用药1 d组、2 d组、3 d组及生理盐水对照组共4组, 每组6只, 按上述方法暴露鸡胚尿囊膜, 在相对无血管处放入甲基纤维素碟, As2O3各组每只给予40 mg/L的As2O3注射液 20 L, 对照组给予等量的生理盐水, 用无菌透明胶带封窗后放入孵化箱, 37.8 ℃继续孵化, As2O3 1 d组于第1 d、2 d组于第2、3天组及对照组于第3 d取CAM, 40 g/L戊二醛固定, PBS缓冲液漂洗, 10 g/L锇酸后固定, 梯度酒精脱水, Epon812包埋, 超薄切片, 醋酸铀和柠檬酸铅双染色, 透射电镜观察CAM超微结构变化.
1.2.5 免疫组化检测: 将已构建的裸鼠人肝癌转移模型(LCI-D20) 21只裸鼠, 随机分为As2O3高剂量治疗组(As2O3注射液每日3.5 mg/kg组)、低剂量治疗组(As2O3注射液每日2.0 mg/kg组)和生理盐水对照组各7只, 于肝移植瘤块后第11 d开始用药, 均腹腔注射, 1次/d, 连续3 wk, 于停药后次日解剖裸鼠, 完整剥取肝移植瘤, 100 g/L甲醛固定, 石蜡包埋, 切片, 二甲苯中脱蜡, 高温高压组织抗原修复, 按说明滴加一抗和二抗, DAB显色, 苏木素复染, 中性树胶封固, 镜检. 采用已知阳性切片作阳性对照, 用PBS代替一抗作阴性对照. 观察裸鼠人肝癌转移模型肝移植瘤表达VEGF基因蛋白的情况. 阳性判断标准: 以胞质呈棕黄色为阳性细胞. 表达情况根据细胞染色强度(A)和染色细胞所占面积(B)二者积分之积来判断. 染色强度积分为: 不染色= 0, 轻度染色(浅黄色)= 1, 中度染色(棕黄色)= 2, 强染色(棕褐色)= 3; 染色面积分为: 小于25%细胞染色= 1, 大于或等于25%细胞染色= 2. 若两种积分之积(A×B)大于2, 则为表达阳性, 小于或等于2则为表达阴性. CD34所表达的MVD的计数方法: 采用Weidner的校正技术, 先在低倍镜(100倍)下寻找新生血管最密集区即"热点"(hotspot), 然后在高倍镜下(200倍)观察被染成棕黄色或棕褐色的新生血管数目及分布情况.
统计学处理 应用SPSS10.0统计软件进行相关资料处理, 统计变量以均数±标准差(mean±SD)表示, 用t检验和x2检验, P<0.05表示有显著性差异; P<0.01表示有非常显著性差异.
As2O3对ECV304细胞有显著的抑制作用, 各剂量组随着作用时间的延长, 其抑制作用增强, 特别是As2O3 1 mg/L组差异显著(P<0.05); 相同时间、不同浓度, 除24 h和48 h As2O3 1 mg/L组与2 mg/L组、2 mg/L组与4 mg/L组差异不显著外, 其余均有显著性差异(P<0.05), 但与阳性对照组5-Fu比较, 相同时间与相应浓度其抑制率低于5-Fu(P<0.01, 表1).
| mg/L | 24 h | 48 h | 72 h | |
| As2O3 | 1 | 8.0±3.7 | 20.9±1.7 | 38.0±3.1 |
| 2 | 15.7±0.5 | 28.2±3.1 | 45.3±1.0 | |
| 4 | 22.9±3.3 | 34.7±3.1 | 49.5±1.1 | |
| 5-Fu | 62.5 | 27.1±3.7 | 30.7±5.6 | 46.9±2.1 |
| 125 | 32.8±5.5 | 36.3±1.6 | 52.6±2.0 | |
| 250 | 40.0±3.3 | 44.4±3.2 | 65.1±3.9 |
As2O3各个剂量组对CAM 新生血管的形成均有抑制作用, 用药后新生血管得到完全抑制或明显减少, 而生理盐水对照组(阴性对照)则新生血管正常, 毛细血管丰富, 经统计学处理, 用药各组与生理盐水组比较, 均有非常显著性差异(P<0.01), 与人参皂甙Rg3 250 组比较, 则差异不明显(P>0.05), 抑制率以As2O3 40组为最高, 达60.0%(表2, 图1). 透射电镜观察: 生理盐水对照组见到胚外中胚层间充质细胞向毛细血管分化, 部分新形成的毛细血管腔中可见红细胞, 亦可见单个间充质细胞胞质突起围成的单细胞血管腔. 毛细血管内皮细胞结构完整, 未见明显改变. As2O3 40 mg/L用药后1 d, 2 d, 血管内皮细胞和间充质细胞的改变与对照组基本相同, 未见明显改变. 用药后3 d, 部分间充质细胞出现程度不同的退行性改变, 胞膜断裂, 胞质中线粒体嵴消失、空泡化, 出现髓样小体; 毛细血管内皮细胞出现大小不一的空泡; 新生毛细血管内皮细胞空泡化, 线粒体基质电子密度增高, 部分血管壁缺损; 有些单细胞血管芽的细胞核常染色质部分溶解, 胞质内线粒体空泡化(图2).
CAM 接种7721肿瘤细胞后, 生理盐水对照组可见瘤细胞弥漫分布, 有些地方呈团状, 诱生的新生血管较未接种7721肿瘤细胞组明显增多, 而As2O3组则肿瘤细胞较少, 分布稀疏, 新生血管较生理盐水对照组明显为少, 说明As2O3具有抑制肿瘤细胞诱导新生血管生成的作用(图3).
生理盐水组VEGF表达率为83.3%, 而As2O3高、低剂量治疗组则分别为28.6%和42.9%, 经统计学处理有显著性差异(P<0.05). 免疫组化实验表明, 用CD34标记的裸鼠移植瘤血管内皮细胞生理盐水组血管密度较高, 血管杂乱无序, 而As2O3高剂量组及低剂量组则肿瘤血管密度明显低于生理盐水组, 血管结构较为规则, 血窦样结构少.
As2O3是中药砒霜的主要成分, 研究表明该药对肿瘤细胞有一定的细胞毒作用, 并可促进和诱导肿瘤细胞凋亡, 对APL有突出疗效[23]. 我们发现该药对肝癌亦有较好的作用, 能诱导肝癌细胞凋亡, 抑制肝癌细胞端粒酶活性, 并有一定的抗肝癌细胞浸润与转移作用[24-35]. 本结果表明, As2O3的抗转移作用可能与其有一定的抗肿瘤血管形成作用有关, 不同浓度的As2O3均能抑制建株人脐静脉内皮细胞ECV304的增生, 且其抑制作用与时间和剂量呈一定的相关性, 即随着时间的延长, 剂量的增加, 其抑制作用不断增强. 鸡胚尿囊膜的实验显示, 无论是正常鸡胚绒毛尿囊膜的血管生长还是接种肿瘤细胞后的血管生长, As2O3均有较显著的抑制作用, 且疗效略优于目前认为有抗肿瘤血管形成作用的国家一类新药人参皂甙Rg3, 其机制与As2O3能损伤形成血管的原始间充质细胞、使新生毛细血管内皮细胞空泡化等有关, 这提示As2O3抗肿瘤血管形成作用可能是通过破坏内皮细胞的结构和功能实现的.
VEGF是血管生成因子和相关因子中特异性最强、作用最大的一种. 我们选择复旦大学肝癌研究所(原上海医科大学肝癌研究所)孙昉宪et al[36]所构建的裸鼠人肝癌高转移模型LCI-D20为研究对象, 观察As2O3对VEGF基因蛋白表达的影响. 该模型转移率高(100%), 表现为肝内播散、淋巴结和肺转移, 类似于临床肝癌患者, 是目前研究人肝癌转移机制及抗转移治疗较为理想的模型. 本结果显示, As2O3能抑制裸鼠肝移植瘤表达VEGF, As2O3 每日2.0 mg/kg 组和As2O3 3.5 mg/kg组表达率分别为42.9%和28.6%, 而生理盐水组表达率为83.3%(P均<0.05), 提示As2O3抑制肿瘤血管形成的作用还可能与调节VEGF的表达有关.
As2O3是我国从传统有毒中药砒霜中自主开发的抗肿瘤新药, 自发现该药对肿瘤细胞有诱导分化和促进凋亡作用以来, 围绕其抗癌机制进行了大量的研究, 特别是抗实体肿瘤的研究目前仍是方兴未艾. 本结果提示, As2O3可作为抗肿瘤血管形成药物用于抗肿瘤治疗, 特别是抗肿瘤转移的治疗, 但其临床实际疗效如何, 尚待进一步验证.
编辑: N/A
| 1. | Gupta MK, Qin RY. Mechanism and its regulation of tumor-induced angiogenesis. World J Gastroenterol. 2003;9:1144-1155. [PubMed] [DOI] |
| 2. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] [DOI] |
| 3. | Xiong B, Sun TJ, Yuan HY, Hu MB, Hu WD, Cheng FL. Cyclooxygenase-2 expression and angiogenesis in colorectal cancer. World J Gastroenterol. 2003;9:1237-1240. [PubMed] [DOI] |
| 4. | Du JR, Jiang Y, Zhang YM, Fu H. Vascular endothelial growth factor and microvascular density in esophageal and gastric carcinomas. World J Gastroenterol. 2003;9:1604-1606. [PubMed] [DOI] |
| 5. | Shi BM, Wang XY, Mu QL, Wu TH, Liu HJ, Yang Z. Angiogenesis effect on rat liver after administration of expression vector encoding vascular endothelial growth factor D. World J Gastroenterol. 2003;9:312-315. [PubMed] [DOI] |
| 6. | Sun HC, Li XM, Xue Q, Chen J, Gao DM, Tang ZY. Study of angiogenesis induced by metastatic and non-metastatic liver cancerby corneal micropocket model in nude mice. World J Gastroenterol. 1999;5:116-118. [PubMed] [DOI] |
| 7. | Xiong B, Gong LL, Zhang F, Hu MB, Yuan HY. TGF1 expression and angiogenesis in colorectal cancer tissue. World J Gastroenterol. 2002;8:496-498. [PubMed] [DOI] |
| 8. | Boudreau N, Myers C. Breast cancer-induced angiogenesis: multiple mechanisms and the role of the microenvironment. Breast Cancer Res. 2003;5:140-146. [PubMed] [DOI] |
| 9. | Kalluri R. Basement membranes: structure, assembly and role in tumour angiogenesis. Nat Rev Cancer. 2003;3:422-433. [PubMed] [DOI] |
| 10. | Streit M, Detmar M. Angiogenesis, lymphangiogenesis, and melanoma metastasis. Oncogene. 2003;22:3172-3179. [PubMed] [DOI] |
| 11. | Folkman J. Role of angiogenesis in tumor growth and metastasis. Semin Oncol. 2002;29:15-18. [PubMed] [DOI] |
| 12. | Jain RK. Tumor angiogenesis and accessibility: role of vascular endothelial growth factor. Semin Oncol. 2002;29:3-9. [PubMed] [DOI] |
| 15. | 张 燕敏, 邓 长生, 朱 尤庆, 毛 永荣, 张 可, 杨 院平. 胃腺癌中缺氧诱导因子-1αmRNA表达和血管生成的关系. 世界华人消化杂志. 2002;10:633-637. [DOI] |
| 16. | Li X, Fu GF, Fan YR, Shi CF, Liu XJ, Xu GX, Wang JJ. Potent inhibition of angiogenesis and liver tumor growth by administration of an aerosol containing a transferrin-liposome-endostatin complex. World J Gastroenterol. 2003;9:262-266. [PubMed] [DOI] |
| 17. | Fan YF, Huang ZH. Angiogenesis inhibitor TNP-470 suppresses growth of peritoneal disseminating foci of human colon cancer line Lovo. World J Gastroenterol. 2002;8:853-856. [PubMed] [DOI] |
| 18. | Giles FJ. The vascular endothelial growth factor (VEGF) signaling pathway: a therapeutic target in patients with hematologic malignancies. Oncologist. 2001;32-39. [PubMed] [DOI] |
| 19. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [PubMed] [DOI] |
| 20. | Baguley BC. Antivascular therapy of cancer: DMXAA. Lancet Oncol. 2003;4:141-148. [PubMed] [DOI] |
| 21. | Ellis LM. A targeted approach for antiangiogenic therapy of metastatic human colon cancer. Am Surg. 2003;69:3-10. |
| 23. | 张 鹏, 王 树叶, 胡 龙虎, 邱 凤芹, 杨 惠芬, 肖 彧君, 李 晓霞, 韩 雪英, 周 晋, 刘 彭. 三氧化二砷治疗急性早幼粒细胞白血病7 a 总结-附242例分析. 中华血液学杂志. 2000;21:67-70. |
| 33. | Wang W, Qin SK, Chen BA, Chen HY. Experimental study on antitumor effect of arsenic trioxide in combination with cisplatin or doxorubin on hepatocellular carcinoma. World J Gastroenterol. 2001;7:702-705. [PubMed] |
| 35. | Wang SS, Zhang T, Wang XL, Hong L, Qi QH. Effect of arsenic trioxide on rat hepatocarcinoma and its renal cytotoxicity. World J Gastroenterol. 2003;9:930-935. [PubMed] [DOI] |