修回日期: 2003-05-10
接受日期: 2003-05-17
在线出版日期: 2004-01-15
目的: 研究SF对大鼠乙酸性结肠炎的作用及其机制.
方法: 利用乙酸灌肠制备大鼠结肠炎模型. 实验设正常对照组, 模型对照组, SF给药组(200 mg/kg, 400 mg/kg, 800 mg/kg), 每天灌肠给药1次, 用药7 d. 实验结束后评价大鼠结肠黏膜损伤指数(CMDI)与粪便隐血实验(OBT)、检测结肠组织MDA, NO, PGE2, TXB2含量; MPO, SOD活性; COX-2, NF-Bp65表达水平及血小板聚集率.
结果: 模型组大鼠CMDI, OBT评分显著增加; MDA, NO, PGE2, TXB2含量, MPO活性, COX-2与NF-Bp65表达水平及血小板聚集率显著升高; 而SOD活性显著降. SF灌肠改善模型组大鼠CMDI, OBT评分; 使结肠组织MDA, NO, PGE2, TXB2含量, MPO活性, 血小板聚集率不同程度降低, SOD活性升高, 同时下调COX-2与NF-Bp65的过度表达. SF用药呈一定量效关系.
结论: SF通过抗氧化, 抑制血小板活化、花生四烯酸代谢及NF-B表达, 缓解大鼠乙酸性结肠炎炎症反应, 减轻结肠黏膜损伤.
引文著录: 刘少平, 董卫国, 罗和生, 余保平, 于皆平. 阿魏酸钠抗大鼠乙酸性结肠炎损伤的作用. 世界华人消化杂志 2004; 12(1): 108-111
Revised: May 10, 2003
Accepted: May 17, 2003
Published online: January 15, 2004
AIM: To study the effects of sodium ferulate on acetic acid-induced rat colitis and its mechanism.
METHODS: The colitis model of rats was produced by intracolon enema with acetic acid. The experiment animals were divided into 5 groups: normal group, model group, SF groups (200 mg/kg, 400 mg/kg, 800 mg/kg), and treated intracolonically with saline and SF respectively once per day for 7 d. At the end of the experiment, the colon mucosa damage index (CMDI) and the occult blood test (OBT) were evaluated.The contents of MDA, NO, PGE2, and TXB2 , the activities of myelopexoxidase (MPO) and SOD, the expression of COX-2 and NF-Bp65 in the rat colon were detected. Platelet agglutinability was also measured.
RESULTS: The extents of CMDI and OBT, the contents of MDA, NO, PGE2 and TXB2, the activity of MPO, the expression of COX-2 and NF-Bp65 in the colon and the platelet agglutinability in the model group were higher than those in normal group, while the activity of SOD was lower than that in normal group. SF could alleviate the CMDI and OBT, and ameliorate the abnormity of these detected indexes in a dose-depended manner.
CONCLUSION: Treatment with SF intracolon can relieve the inflammation reaction, attenuate the colon mucosal damage in the rat colitis through resisting oxidative stress, restraining arachidonic acid metabolism, platelet activation and the expression of NF-B.
- Citation: Liu SP, Dong WG, Luo HS, Yu BP, Yu JP. Protective effects of sodium ferulate on injury in acetic acid-induced rat colitis. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 108-111
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/108.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.108
阿魏酸钠(sodium ferulate, SF)是传统中药当归的主要药性成分之一, 具有抑制花生四烯酸(AA)代谢、拮抗组胺、降低血管通透性、清除自由基、抑制脂质过氧化、改善血液循环、抑制血小板聚集活化及血栓形成、抑制巨噬细胞活化等广泛药理作用[1-5]. 炎症性肠病(inflammatory bowel disease, IBD)中花生四烯酸代谢紊乱、氧自由基损伤、血小板活化、微循环障碍等均是重要的致病环节[6-10]. 为探讨SF是否通过作用于以上环节对IBD产生抗炎、抗损伤保护作用及其机制, 我们在建立大鼠乙酸性结肠炎模型的基础上灌肠给药, 观察SF对其氧自由基水平、血小板活化、花生四烯酸代谢及NF-B表达的影响, 并评价结肠损伤程度.
健康Sprague-Dawley大鼠, ♀♂兼用, 体质量(250±30 g), 由湖北预防医学科学院实验动物中心提供; SF(注射用当归素)由武汉大学中南医院制药厂生产, 批号 2011219; 分析纯乙酸, 武汉生化试剂厂产品; SOD、MDA、NO、MPO检测试剂盒均购于南京建成生物研究所; PGE2、TXB2放免试剂盒由解放军总院科技开发中心放免研究所提供; COX-2兔IgG多抗、NF-Bp65兔IgG多抗及S-P免疫组化试剂盒均由北京中山生物技术有限公司提供, 余试剂均为国产分析纯.
参照文献[11]制备动物模型, 乙醚麻醉固定大鼠, 橡胶输液管由肛门轻缓插入结肠内约8 cm, 推入8 mL/L乙酸2 mL, 作用20 s 后, 立即注入生理盐水5 mL, 冲洗 2 次. 实验设正常对照组、模型对照组、SF给药组(200 mg/kg, 400 mg/kg, 800 mg/kg), 每组8只, 均灌肠给药, 每日 1 次, 给药时间从制备模型后24 h开始, 用药7 d. 正常对照组及模型对照组均给予等量生理盐水灌肠. 实验完成后用OB试纸检测粪便隐血实验(OBT), 显色评分标准按OB试纸说明进行; 大鼠摘眼球取血2 mL, 肝素抗凝, 2 h内采用SH-93型智能血液凝聚仪(上海生化仪器厂产品)检测血小板聚集率; 处死动物评价结肠黏膜损伤指数(CMDI), 评分标准为: 0 = 无损伤; 1 = 轻度充血、水肿, 表面光滑, 无糜烂或溃疡; 2 = 充血水肿, 黏膜粗糙呈颗粒状, 有糜烂或肠粘连; 3 = 高度充血水肿, 黏膜表面有坏死及溃疡形成, 溃疡最大纵径小于1 cm, 肠壁增厚或表面有坏死及炎症; 4 = 在3分基础上溃疡最大纵径大于1 cm, 或全肠壁坏死. 在距肛门 7-9 cm处取适量结肠新鲜标本, 快速置于液氮中速冻, 供检测SOD, MDA, NO, MPO, PGE2, TXB2, 检测操作按相应试剂盒说明进行; 另取结肠组织约10 mg 制成石蜡切片, COX-2与NF-Bp65免疫组化检测步骤严格按试剂盒说明进行, 均以非免疫性山羊血清封闭非特异性抗原, 一抗分别为1: 120, 1: 200 的COX-2 与NF-Bp65兔IgG多抗, 二抗均为生物素化羊抗兔IgG工作液, 以PBS代替一抗做阴性对照, 以细胞核蓝色为阴性, 胞质内或核膜上呈棕黄色为阳性. 每张切片选取10个400倍视野, 采用全自动图像分析仪与HPIAS-2000图像分析软件, 分别扫描记录阳性细胞的吸光度A值, 取其平均值, 作为此切片COX-2, NF-Bp65的相对含量.
统计学处理 所有数据以(mean±SD)表示, 采用SPSS医学统计软件处理, 两组间均数差异的比较采用 t检验.
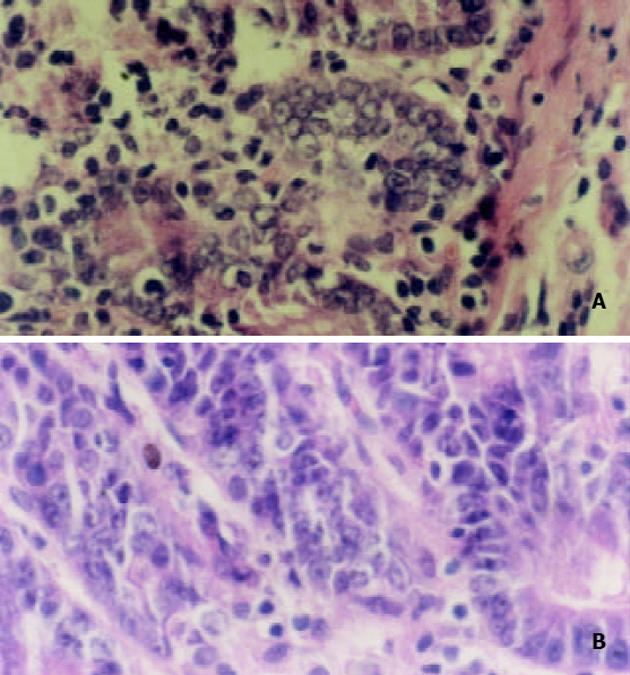
模型组大鼠反映结肠损伤与炎症反应程度的指标CMDI、OBT与MPO活性显著升高(P<0.01),SF灌肠剂量依赖性使三者降低, 中、大剂量组三者变化有显著性差异(P<0.05, 或P<0.01, 表1); 结肠标本HE染色显示, 模型组黏膜充血水肿, 溃疡形成, 大量炎性细胞浸润, 腺体中杯状细胞显著减少而大剂量SF用药组以上病理组织表现明显缓解(图1), 这些表明SF对大鼠乙酸性结肠炎具有明显抗炎、抗损伤作用.
模型组大鼠NO与OFR代谢的主要产物MDA含量及血小板聚集率显著升高(P<0.01),清除OFR的主要酶SOD活性显著降低(P<0.01), SF灌肠使MDA, NO含量及血小板聚集降低, SOD活性升高, 呈现一定量效关系, 中、大剂量组各指标变化均有显著性差异(P<0.05, 或P<0.01, 表2).
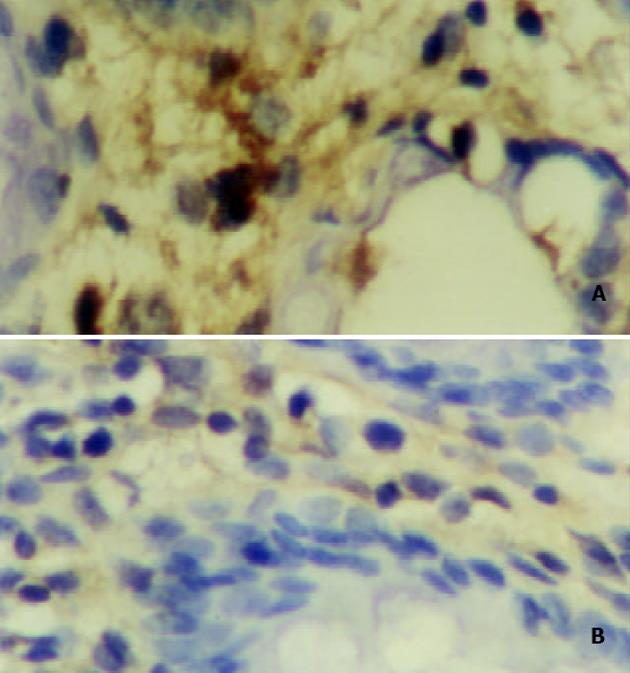
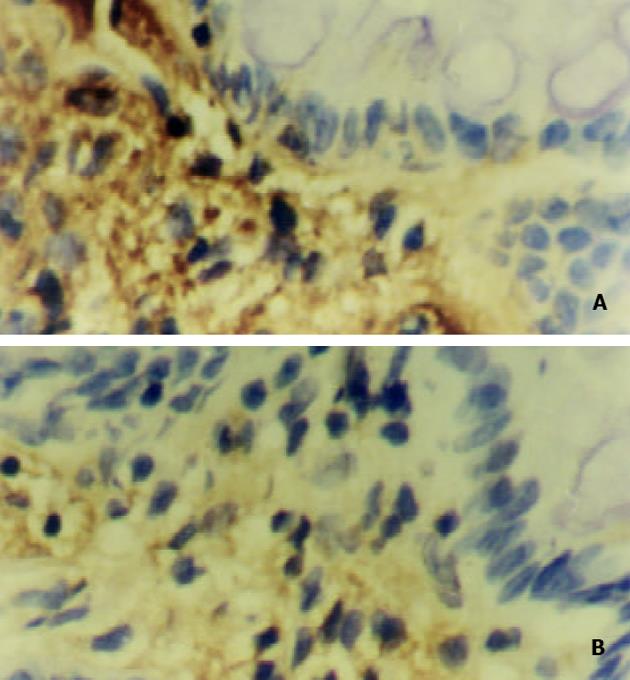
模型组大鼠PGE2, TXB2含量及COX-2,NF-Bp65表达均显著升高(P<0.01), SF灌肠剂量依赖性降低前二者的含量, 下调COX-2, NF-Bp65的表达水平, 用药各组各指标变化均有显著性差异(P<0.05, 或P<0.01, 见表3, 图2, 3).
乙酸诱导大鼠结肠炎的主要机制与结肠黏膜化学损伤、血管通透性增加、炎症递质激活、溶解纤维蛋白活性增加及凝血机制受干扰相关. 这种大鼠结肠炎模型因其发病机制和病理表现与人类IBD相似而常用于IBD治疗药物的筛选与评价[11-12]. IBD肠黏膜中氧自由基(OFR)水平明显升高, 抗氧化系统存在缺陷, 大量OFR对自身组织产生攻击作用, 且可激活炎性递质, 加重炎症反应[13-16]. 弱氧自由基NO不仅趋化中性粒细胞和单核细胞, 且可与炎性细胞产生的超氧阴离子反应生成具有高度细胞毒性的过氧亚硝酸盐, 破坏细胞结构与功能; 过量的NO还可使血管扩张, 通透性增加, 有助于炎症的始动与发展[17-18]. 本研究显示模型组大鼠氧自由基大量生成, SF灌肠用药明显降低其结肠组织MDA、NO含量, 升高SOD活性, 表现出较强的抗OFR损伤致炎作用.
IBD患者血小板处于激活状态, 直接参与IBD致病过程. 活化的血小板不仅促进血小板栓塞性疾病发生与肠系膜血管多灶性微梗死形成, 还可释放多种炎症递质, 如血小板活化因子、血栓素等, 亦能产生氧自由基[19-22]. 血小板聚集率升高是血小板激活化的代表性指标[23]. 本研究显示模型组大鼠血小板明显处于活化状态, SF灌肠用药降低血小板聚集率, 表明其可通过抑制血小板活化, 减轻模型组大鼠炎症反应, 同时改善微循环. AA代谢异常是IBD致病的重要环节[7,24]. 作为AA 代谢生成重要炎症递质PGE2, TXB2 的主要限速酶COX-2在IBD肠组织中迅速大量增加, 合成大量病理性PGE2, TXB2 . TXB2亦是强烈的血管收缩剂, 其含量增加可导致组织循环障碍, 进一步加重炎症反应, 抑制AA代谢可明显缓解IBD炎症程度[25-26]. 本研究中模型组大鼠结肠组织COX-2表达显著升高, AA代谢过度, PGE2 、TXB2显著增加, SF灌肠用药明显减少二者含量, 有效缓解炎症反应, 机制可能为SF显著下调了COX-2过度表达, 从而抑制AA代谢.
本研究进一步显示, SF的抗炎症损伤作用可能与影响NF-B表达相关. 大量研究表明NF-B在IBD炎症反应中占有核心地位, 其激活表达可促进多种炎性因子、趋化因子、黏附分子的生成, 亦可启动分别是合成NO与PGE2的重要限速酶iNOS, COX-2的过度表达; NF-B还可直接活化TNF受体相关基因(TRAF1, TRAF2)、Bcl-2同源体(A1/Bfl-1, IEX-1L)等抗细胞凋亡基因, 抑制IBD中多种炎性细胞的凋亡, 导致其功能周期延长, 加重组织炎症损伤. 抑制NF-B可成为治疗IBD 的有效靶点[27-34]. NF-B家族成员中, p65亚单位是含有活性转录区域的主要促炎亚单位, 其活化与氧化剂、细胞内Ca2+水平升高密切相关[32,35-36]. 本研究中模型组大鼠NF-Bp65表达显著增加, 可能是结肠组织中大量生成的OFR对其产生激活作用, 进而上调iNOS、COX-2表达, 促进NO生成与AA代谢. SF灌肠明显抑制NF-Bp65过度表达, 削弱其多途径致炎损伤作用, 有效缓解炎症反应. SF抑制NF-B的分子机制可能为SF具有浓度依赖性Ca2+通道阻滞作用, 可抑制细胞Ca2+内流, 降低胞内Ca2+浓度, 呈现NF-B活化抑制作用; SF亦可能通过其较强抗氧化与直接清除羟自由基作用, 抑制氧自由基对NF-B的激活[1-2,35].
编辑: N/A
| 1. | Kikuzaki H, Hisamoto M, Hirose K, Akiyama K, Taniguchi H. Antioxidant properties of ferulic acid and its related compounds. J Agric Food Chem. 2002;50:2161-2168. [PubMed] [DOI] |
| 2. | Zhang ZH, Yu SZ, Li GS, Zhao BL. Influence of sodium ferulate on human netrophil-derived oxygen metabolites. Chin Pharmacol Bull. 2001;17:515-517. |
| 3. | Zhou JY, Fan Y, Han ZF, Wu DZ, Hu ZB. Influence of ferulic acid sodium on the enhance of endothelial permeability induced by histamine. Chin Pharmacol Bull. 2000;16:664-666. |
| 4. | Liu SP, Dong WD, Wu DF, Luo HS, Yu JP, Mei Q. Effects of sodium ferulate on nitric oxide synthase and cyclooxygenase in colon of colitis rats. Chin Pharmacol Bull. 2003;19:571-574. |
| 5. | Xie L, Yang LH, Li XH. Resarch on the pharmacologic effects of Angelica Sinensis. Res Traditional Chin Med. 2000;16:56-58. |
| 6. | Jiang XL, Quan QZ, Liu T, Dong XC. Recent advances in reseach of ulcerative colitis. Shijie Huaren Xiaohua Zazhi. 2000;8:216-218. [DOI] |
| 7. | Xia B. Etiology and pathogenesis of inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi. 2001;9:245-250. [DOI] |
| 8. | Xu G, Tian KL, Liu GP, Zhong XJ, Tang SL, Sun YP. Clinical significance of plasma D-dimer and von Willebrand factor levels in patients with ulcer colitis. World J Gastroenterol. 2002;8:575-576. [PubMed] [DOI] |
| 9. | Kirsner JB. Historical origins of current IBD concepts. World J Gastroenterol. 2001;7:175-184. [PubMed] [DOI] |
| 10. | Jiang XL, Quan QZ, Wan ZK. Diagnosis, typing and therapy of ulcerative colitis. Shijie Huaren Xiaohua Zazhi. 2000;8:332-334. [DOI] |
| 11. | Mei Q, Yu JP, Xu JM, Xiang L. The effects of melatonin on the immunological function of colitis in rats. Shijie Huaren Xiaohua Zazhi. 2002;10:193-196. [DOI] |
| 12. | Li L, Wang ZL, Ke JT, Zhang M, Shao JF, Zhong CN. Select animal models for experimental colitis model. Shijie Huaren Xiaohua Zazhi. 2001;9:584-585. [DOI] |
| 13. | D'Odorico A, Bortolan S, Cardin R, D'Inca R, Martines D, Ferronato A, Sturniolo GC. Reduced plasma antioxidant concentrations and increased oxidative DNA damage in inflammatory bowel disease. Scand J Gastroenterol. 2001;36:1289-1294. [PubMed] [DOI] |
| 14. | Krieglstein CF, Cerwinka WH, Laroux FS, Salter JW, Russell JM, Schuermann G, Grisham MB, Ross CR, Granger DN. Regulation of murine intestinal inflammation by reactive metabolites of oxygenand nitrogen: divergent roles of superoxide and nitric oxide. J Exp Med. 2001;194:1207-1218. [PubMed] [DOI] |
| 15. | Huycke MM, Abrams V, Moore DR. Enterococcus faecalis produces extracellular superoxide and hydrogen peroxide that damages colonic epithelial cell DAN. Carcinogenesis. 2002;23:529-536. [PubMed] [DOI] |
| 16. | Pavlick KP, Laroux FS, Fuseler J, Wolf RE, Gray L, Hoffman J, Grisham MB. Role of reactive metabolites of oxygen and nitrogen in inflammatory bowel disease. Free Radic Biol Med. 2002;33:311-322. [PubMed] [DOI] |
| 17. | Bai AP, Shen ZX, Yu JP, Yu BP, Luo Y. Nitric oxide and the acute injury in colitis model. Shijie Huaren Xiaohua Zazhi. 1999;7:900-901. [DOI] |
| 18. | Zhang K, Deng CS, Zhu YQ, Yang YP, Zhang YM. Signifisance of nuclear factor-B, cyclooxygenase-2 and inducible nitric oxide synthase expression in human ulcerative colitis tissues. Shijie Huaren Xiaohua Zazhi. 2002;10:575-578. [DOI] |
| 19. | Suzuki K, Sugimura K, Hasegawa K, Yoshida K, Suzuki A, Ishizuka K, Ohtsuka K, Honma T, Narisawa R, Asakura H. Activated platelets in ulcerative colitis enhance the production of reactive oxygen species by polymorphonuclear leukocytes. Scand J Gastroenterol. 2001;36:1301-1306. [PubMed] [DOI] |
| 20. | Kapsoritakis AN, Koukourakis MI, Sfiridaki A, Potamianos SP, Kosmadaki MG, Koutroubakis IE, Kouroumalis EA. Mean platelet volume: a useful marker of inflammatory bowel disease activity. Am J Gastroenterol. 2001;96:776-781. [PubMed] [DOI] |
| 21. | Cui HF, Jiang XL. Treatment of corticosteroid-resistant ulcerative colitis with oral low molecular weight heparin. World J Gastroenterol. 1999;5:448-450. [PubMed] [DOI] |
| 22. | Carty E, MacEy M, Rampton DS. Inhibition of platelet activation by 5-aminosalicylic acid in inflammatory bowel disease. Aliment Pharmacol Ther. 2000;14:1169-1179. [PubMed] [DOI] |
| 23. | Carty E, Macey M, McCartney SA, Rampton DS. Ridogrel, a dual thromboxane synthase inhibitor and receptor antagonist: anti-inflammatory profile in inflammatory bowel disease. Aliment Pharmacol Ther. 2000;14:807-817. [PubMed] [DOI] |
| 24. | Gil A. Polyunsaturated fatty acids and inflammatory diseases. Biomed Pharmacother. 2002;56:388-396. [PubMed] [DOI] |
| 25. | McCowen KC, Ling PR, Bistrian BR. Arachidonic acid concentrations in patients with Crohn disease. Am J Clin Nutr. 2000;71:1008-1015. [PubMed] |
| 26. | Carty E, De Brabander M, Feakins RM, Rampton DS. Measurement of in vivo rectal mucosal cytokine and eicosanoid production in ulcerative colitis using filter paper. Gut. 2000;46:487-492. [PubMed] [DOI] |
| 27. | Dijkstra G, Moshage H, Jansen PL. Blockade of NF-kappaB activation and donation of nitric oxide: new treatment options in inflammatory bowel disease? Scand J Gastroenterol Suppl. 2002;236:37-41. [PubMed] [DOI] |
| 28. | Li JH, Yu JP, He XF, Xu XM. Expression of NF-B in rats with TNBS-induced ulcerative colitis. Shijie Huaren Xiaohua Zazhi. 2003;11:214-218. [DOI] |
| 29. | Potoka DA, Upperman JS, Nadler EP, Wong CT, Zhou X, Zhang XR, Ford HR. NF-kappaB inhibition enhances peroxynitrite-induced enterocyte apoptosis. J Surg Res. 2002;106:7-14. [PubMed] [DOI] |
| 30. | Yamamoto Y, Gaynor RB. Therapeutic potential of inhibition of the NF-kappaB pathway in the treatment of inflammation and cancer. J Clin Invest. 2001;107:135-142. [PubMed] [DOI] |
| 31. | Jobin C, Sartor RB. NF-kappaB signaling proteins as therapeutic targets for inflammatory bowel diseases. Inflamm Bowel Dis. 2000;6:206-213. [PubMed] [DOI] |
| 32. | Yamamoto Y, Gaynor RB. Role of the NF-kappaB pathway in the pathogenesis of human disease states. Curr Mol Med. 2001;58:287-296. [PubMed] [DOI] |
| 33. | Karmeli F, Cohen P, Rachmilewitz D. Cyclo-oxygenase-2 inhibitors ameliorate the severity of experimental colitis in rats. Eur J Gastroenterol Hepatol. 2000;12:223-231. [PubMed] [DOI] |
| 34. | Surh YJ, Chun KS, Cha HH, Han SS, Keum YS, Park KK, Lee SS. Molecular mechanisms underiying chemopreventive activites of anti-inflammatory phytochemicals: down-regulation of COX-2 and iNOS through suppression of NF-kappa B activation. Mutat Res. 2001;481:243-268. [PubMed] [DOI] |
| 35. | Reifen R, Nur T, Ghebermeskel K, Zaiger G, Urizky R, Pines M. Vitamin A deficiency exacerbates inflammation in a rat model of colitis through activation of nuclear factor-kappaB and collagen formation. J Nutr. 2002;132:2743-2747. [PubMed] |
| 36. | Liu SQ, Yu JP, Luo HS, Ran ZX. Effects of Ginkgo biloba extract on expression of NF-B in rat liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2002;10:922-926. [DOI] |