修回日期: 2003-03-20
接受日期: 2003-03-28
在线出版日期: 2004-01-15
目的: 探讨猪肝细胞内源性逆转录病毒(PERV)检测方法及意义.
方法: 采用体外二步灌流法获取猪肝细胞, 使用特异性引物对其前病毒序列进行观察; 以未逆转录PCR为对照, 采用RT-PCR方法检测原代猪肝细胞PERV携带及释放情况, 并用套式RT-PCR对扩增产物进行鉴定.
结果: 原代猪肝细胞基因组中可检测到PERV前病毒序列, 肝细胞中亦可检测到特异性的PERV RNA序列. 在缺乏有丝分裂原刺激的情况下, 猪肝细胞普通培养的不同时段均可检测到病毒释放, 并可持续至细胞死亡.
结论: 中国实验小型猪肝细胞携带PERV病毒序列, 猪肝细胞普通培养时可释放该病毒, 其感染性及生物安全性尚需进一步研究.
引文著录: 郭海涛, 王英杰, 刘鸿凌, 王海慧, 刘俊, 黄艳萍, 王宇明. 原代猪肝细胞PERV检测及其意义. 世界华人消化杂志 2004; 12(1): 101-104
Revised: March 20, 2003
Accepted: March 28, 2003
Published online: January 15, 2004
AIM: To investigate the significance of laboratory detection for PERV in primary porcine hepatocytes.
METHODS: Porcine hepatocytes was isolated and cultured with a two-stage perfusion method. Polymerase chain reaction (PCR) were used to detect PERV previrus sequences and reverse transcription polymerase chain reaction (RT-PCR) assays were used to detect PERV RNA sequences by using specific primers in primary porcine hepatocytes and culture supernate, controlled with no RT-PCR.
RESULTS: All these PCR assays gave positive results in tissue and serum samples from 2 HCV patients, 1 rabbit and 1 rat. Observation showed the persistent releasing of PERV in the culture supernate in different time points without the stimulation of mitogen by the established method and could last till cell death.
CONCLUSION: The method is rapid, cheap and safe, and it will be helpful to the further study of PERV infection and biosafety. The releasing of PERVs in the culture model demonstrates the existence of PERV security in the bioartificial liver support system.
- Citation: Guo HT, Wang YJ, Liu HL, Wang HH, Liu J, Huang YP, Wang YM. Detection and significance of PERV in primary porcine hepatocytes. Shijie Huaren Xiaohua Zazhi 2004; 12(1): 101-104
- URL: https://www.wjgnet.com/1009-3079/full/v12/i1/101.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i1.101
由于同种细胞来源有限, 且肝癌细胞株具有潜在危险性, 猪器官、组织和细胞逐渐成为异种移植使用较多的生物材料之一. 包括体外生物人工肝、肝细胞移植及肝移植的广义生物人工肝对终末期肝病患者的支持作用已经得到了国内外学者的共识, 其中, 以培养猪肝细胞为基础的生物人工肝成为研究热点之一. 采用猪或转基因猪肝细胞已成为生物人工肝的主要细胞来源, 具有良好的应用前景[1-7]. 但自报道猪内源性逆转录病毒(porcine endogenous retrovirus, PERV)感染体外培养人细胞来[8-12], 跨种族间感染越来越引起人们的重视. 为检测原代培养猪肝细胞PERV携带以及病毒释放情况, 我们选用了PERV特异性引物进行PCR及RT-PCR检测, 以为进一步研究PERV感染及其安全性研究奠定基础.
健康1-7日龄中国实验型小型猪由第三军医大学动物所提供; CollagenaseIV, DMSO, 台盼蓝等由Sigma公司提供; 离心管为Nuculon公司产品; 胎牛血清(FBS)、DMEM培养液等购于Gibco公司; 参照PREV RNA gag区的序列合成2对引物, 由上海生工合成, 上游引物序列P1: 5'-GCGACCCACGCAGTTGCATA-3'; 下游引物序列P2: 5'-CAGTTCCTTGCCCAGTGTCCTT-3', 目的片断为662 bp.套式PCR上游引物序列为P3: 5'-TGATCTAGTGAGAGAGGCAGAC-3'; 下游引物序列P4: 5'-CGCACACTGGTCCTTGTCG-3', 扩增目的片断为262 bp. 加样缓冲液购自FMC公司(美国), PCR Markers购自华美生物工程公司; 扩增仪为iCyclerPCR仪 (美国Bio-Rad公司); Protanase K, DEPC, Taq 酶, 10×PCR Buffer和25 mmoL/L MgCl2 RT-PCR试剂盒购自Promega公司, 10 mmoL/L dNTP购自Sigma公司, TRIzol试剂购自Roche公司, GET DOC2000型凝胶成像仪购自Bio Rad公司(美国).
常规消毒后采用改良Seglen体外二步胶原酶灌注法分离肝细胞, 双层消毒纱布过滤, 然后50 g×3 min离心3次, 获取肝细胞[13-20]. 从获取猪肝细胞中提取基因组DNA, 8 mL消化缓冲液重悬, 50 ℃温育12-16 h, 等体积酚/氯仿/异戊醇, 1 700 g离心10 min, 取上清, 加入1/2体积7.5 moL/L乙酸铵和2体积无水乙醇, 1 700 g离心2 min, 700 mL/L乙醇洗涤制成PCR模板. 分别于培养第1 d、3 d、5 d、7 d、9 d留取1 mL培养上清, 200 g离心10 min以去除脱落细胞, 3 500 g离心10 min, 10 000 g离心30 min以去除细胞碎片, 按TRIzol试剂操作说明提取血清及培养上清总RNA. 略作改动, 取血清50 L, 加入150 L TRIzol试剂, 震荡混匀, 静置后加入氯仿60 L, 离心后取上清液50 L加入等体积异丙醇, 静置离心去上清并加入750 mL/L乙醇450 L, 洗涤、离心、干燥、沉淀作逆转录. PCR扩增 100 L反应体系中含0.5 moL/L引物, 200 moL/L dNTP, 1.5 mmoL/LMgCl2, 1 L模板, 扩增条件: 95 ℃, 10 min; 95 ℃, 1 min; 55 ℃, 1 min; 72 ℃, 1 min; 72 ℃, 1 min; 共35个循环. RT-PCR扩增按Promga公司试剂盒进行, 稍作变动. 提高镁离子浓度为1.5 mmoL/L , 逆转录温度不变, 以未行逆转录PCR作对照. 产物经15 g/L琼脂糖凝胶电泳, 溴化乙锭染色后于凝胶成像仪上拍照. 参照DNA Marker, 在662 bp处出现特异性扩增核酸带为阳性. 使用套式PCR鉴定扩增产物, 取扩增产物5 L, 加入内循环引物按上述条件进行再次扩增, 在262 bp处出现特异性扩增核酸带为阳性.
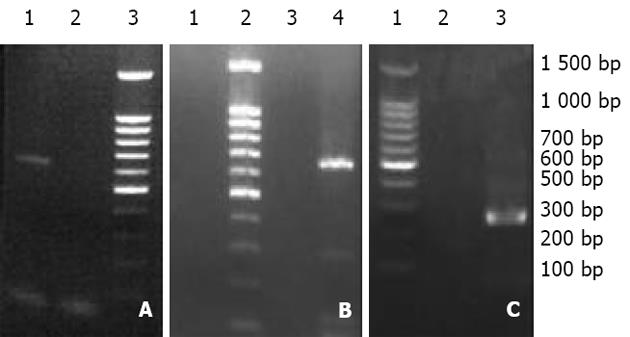
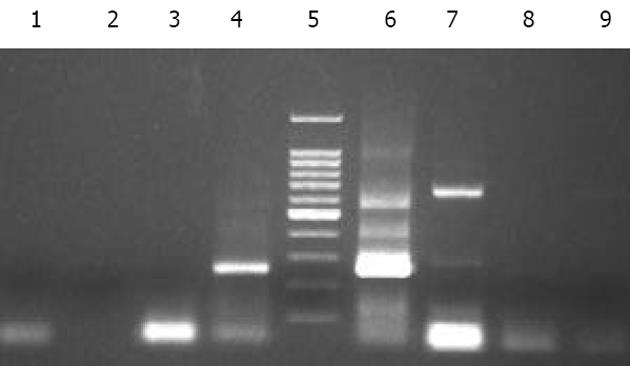
2.1 在6例中国实验香猪肝脏标本中均可检测出PERV前病毒序列, 阳性率为100%, 而在兔、鼠、正常人及HCV感染患者肝脏中均未检测出其前病毒序列(图1). 在中国实验香猪血清标本中均可检测出PERV RNA序列, 而在正常人、HBV、HCV感染患者血清以及其他动物血清中均未检测出其病毒序列(图2).
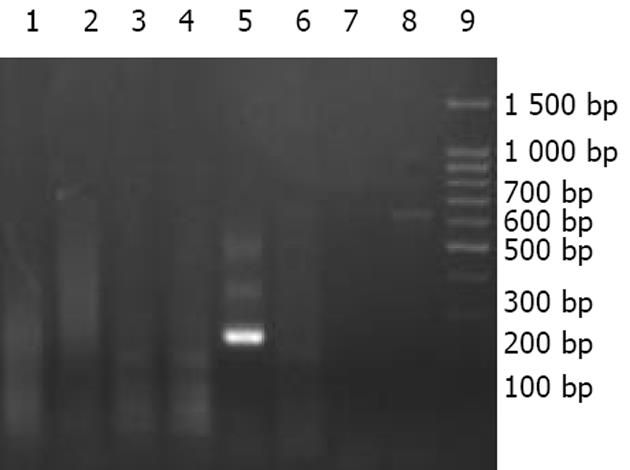
2.2 在原代猪肝细胞普通培养的早期, 未检测到PERV RNA序列, 在培养3-5 d时, 上清中可检测到262 bp的扩增产物, 并可持续至细胞死亡(图3).
近年来的研究显示, 以培养猪肝细胞为生物材料的广义生物人工肝系统可为急性肝衰竭患者提供可靠的过渡支持治疗, 但自报道PERV感染体外培养人细胞系[8], 并建立该病毒感染SCID鼠的动物模型以来[21-22], 当猪的细胞、组织或器官植入处于高度免疫抑制状态(如: 肝衰竭或肝移植)患者体内时, 是否会突破种间屏障而造成感染, 因此, PERV跨种族间感染及异种移植的生物安全性越来越受到重视[23-31].
当前, 在对猪源性细胞材料进行病毒安全性评估的诸多研究中, 多采用猪PK-15细胞系作为PERV来源细胞. 要全面、准确地了解中国实验小型猪PERV携带情况, 不仅需要可靠、特异的PERV检测方法, 同时还需要对病毒释放情况进行观察. 本研究采用体外两步灌流法获取中国实验小型猪肝细胞, 选用特异性引物, 对原代细胞、血清及培养上清进行了PERV检测. 结果发现, 中国实验小型猪原代细胞均携带有PERV前病毒序列, 血清及培养上清中亦可检测到该病毒释放, 且培养上清中所检测到的病毒属新产生病毒, 不是血清残留或是脱落细胞所致, 其理由在于: (1)体外分离获取的猪肝细胞经3-4次洗涤留取的最后一次洗液, 经RT-PCR检测证实为阴性; (2)根据Specke et al所使用的检测方法, 基本可以排除脱落细胞对实验结果造成的干扰. (3)对培养第3、5、7天培养上清的检测均得到相同的结果, 也对此作了佐证. 在培养的初期, 病毒释放量较少; 培养中后期, 病毒释放量比较恒定, 并可持续至细胞死亡. 据此可初步认为, 中国实验小型猪肝细胞能够作为PERV来源细胞, 应对其进行生物安全性评估, 此外, 还需对病毒分型、病毒复制的动态定量分析等工作进行深入研究.
免疫抑制剂的使用、病毒重叠感染以及细胞毒疗法等诸多因素均可增加逆转录病毒被动激活的可能性, 虽然在对使用胎猪神经细胞治疗Pakinson's Huntington's病、移植猪胰岛细胞治疗糖尿病以及使用猪肾进行透析治疗患者的实验研究中, 均未发现PERV感染的直接证据, 但Van der Laan et al[21]将猪的胰岛细胞移植入SCID鼠的肾囊下, 使用定量RT-PCR方法检测到PERV特异性mRAN的存在, 证实了PERV在体内能感染SCID鼠, 再次表明异种移植存在病原安全性问题. 正当猪源性生物材料应用逐渐增多[32-38], 并取得一定临床疗效之时, 对异源性生物材料的潜在感染性问题应引起足够的重视.
猪肝细胞被公认是目前生物人工肝较好的细胞材料之一, 由于暂无更好的细胞来源, 猪肝细胞在今后一段时期内仍会继续使用, 故需进一步建立和完善生物人工肝病毒安全性的评估系统. 随着对PERV的分子生物学以及免疫学特性研究的不断深入, 对其转录、翻译及感染机制将会更加清楚, 从而逐步完善异种移植安全性的评估体系, 进而推动猪源性生物材料临床应用的广泛开展.
编辑: N/A
| 1. | Secheser A, Osorio J, Freise C, Osorio RW. Artificial liver support devices for fulminant liver failure. Clin Liver Dis. 2001;5:415-430. [PubMed] [DOI] |
| 3. | Tsiaoussis J, Newsome PN, Nelson LJ, Hayes PC, Plevris JN. Which hepatocyte will it be? Hepatocyte choice for Bioartificial liver support systems. Liver Transplantation. 2001;7:2-10. [PubMed] [DOI] |
| 4. | Boudjema K, Bachellier P, Wolf P, Tempe JD, Jaeck D. Auxiliary liver transplantation and bioartificial bridging procedures in treatment of acute liver failure. World J Surg. 2002;26:264-274. [PubMed] [DOI] |
| 5. | Eguchi S, Kawazoe Y, Sugiyama N, Kawashita Y, Fujioka H, Furui J, Sato M, Ishii T, Kanematsu T. Effects of recombinant human hepatocyte growth factor on the proliferation and function of porcine hepatocytes. ASAIO J. 2000;46:56-59. [PubMed] [DOI] |
| 6. | Bain VG, Montero JL, de La Mata M. Bioartificial liver support. Can J Gastroenterol. 2001;15:313-318. [PubMed] [DOI] |
| 7. | Chen Z, Ding Y, Zhang H. Morphology, viability and functions of suckling pig hepatocytes cultured in serum-free medium at high density. Dig Surg. 2002;19:184-191. [PubMed] [DOI] |
| 8. | Patience C, Takeuchi Y, Weiss RA. Infection of human cells by an endogenous retrovirus of pigs. Nature Med. 1997;3:282-286. [PubMed] [DOI] |
| 10. | Birmingham K. FDA subcommittee finds no evidence of PERV transmission. Nature Med. 1999;5:855. [PubMed] [DOI] |
| 11. | Tacke SJ, Kurth R, Denner J. Porcine endogenous retroviruses inhibit human immune cell function: risk for xenotransplantation? Virology. 2000;268:87-93. [PubMed] [DOI] |
| 12. | Akiyoshi DE, Denaro M, Zhu H, Greenstein JL, Banerjee P, Fishman JA. Identification of a full-length cDNA for an endogenous retrovirus of miniature swine. J Virology. 1998;72:4503-4507. [PubMed] |
| 16. | Morsiani E, Brogli M, Galavotti D, Bellini T, Ricci D, Pazzi P, Puviani AC. Long-term expression of highly differentiated functions by isolated porcine hepatocytes perfused in a radial-flow bioreactor. Artificial Organs. 2001;25:740-748. [PubMed] [DOI] |
| 17. | Chen Z, Ding Y, Zhang H. Cryopreservation of suckling pig hepatocytes. Annals Clin Laborat Sci. 2001;31:391-398. [PubMed] |
| 18. | Benoist S, Sarkis R, Chafai N, Barbu V, Honiger J, Lakehal F, Becquemont L, Baudrimont M, Capeau J, Housset C. Survival and differentiation of porcine hepatocytes encapsulated by semiautomatic device and allotransplanted in large number without immunosuppression. J Hepatol. 2001;35:208-216. [PubMed] [DOI] |
| 20. | Unger JK, Catapano G, Horn NA, Schroers A, Gerlach JC, Rossaint R. Comparative analysis of metabolism of medium- and plasma perfused primary pig hepatocytes cultured around a 3-D membrane network. Int J Artif Organs. 2000;23:104-110. [PubMed] |
| 21. | Van der Laan LJ, Lockey C, Griffeth BC, Frasier FS, Wilson CA, Onions DE, Hering BJ, Long Z, Otto E, Torbett BE. Infection by porcine endogenous retrovirus after islet xenotransplantation in SCID mice. Nature. 2000;407:90-94. [PubMed] [DOI] |
| 22. | Deng YM, Tuch BE, Rawlinson WD. Transmission of porcine endogenous retroviruses in severe combined immunodeficient mice xenotransplanted with fetal porcine pancreatic cells. Transplantation. 2000;70:1010-1016. [PubMed] [DOI] |
| 23. | Switzer WM, Shanmugan V, Chapman L, Heneine W. Polymerase chain reaction assays for the diagnosis of infection with the porcine endogenous retrovirus and the detection of pig cells in human and nonhuman recipients of pig xenografts. Transplantation. 1999;68:183-188. [PubMed] [DOI] |
| 24. | Blusch JH, Pjatience C, Matin U. Pig endogenous retroviruses and xenotransplantation. Xenotransplantation. 2002;9:242-251. [PubMed] [DOI] |
| 25. | Tucker A, Belcher C, Moloo B, Bell J, Mazzulli T, Humar A, Hughes A, McArdle P, Talbot A. The production of transgenic pigs for potential use in clinical xenotransplantation: microbiological evaluation. Xenotransplantation. 2002;9:191-202. [PubMed] [DOI] |
| 26. | Kuddus R, Patzer JF 2nd, Lopez R, Mazariegos GV, Meighen B, Kramer DJ, Rao AS. Clinical and laboratory evaluation of the safety of a bioartificial liver assist device for potential transmission of porcine endogenous retrovirus. Transplantation. 2002;73:420-429. [PubMed] [DOI] |
| 27. | Clemenceau B, Jegou D, Martignat L, Sai P. Microchimerism and transmission of porcine endogenous retrovirus from a pig cell line or specific pathogen-free pig islets to mouse tissues and human cells during xenografts in nude mice. Diabetologia. 2002;45:4-23. [PubMed] [DOI] |
| 28. | Specke V, Schuurman HJ, Plesker R, Coulibaly C, Ozel M, Langford G, Kurth R, Denner J. Virus safety in xenotransplantation: first exploratory in vivo studies in small laboratory animals and non-human primates. Transplant Immunol. 2002;9:281-288. [PubMed] [DOI] |
| 29. | Bartosch B, Weiss RA, Takeuchi Y. PCR-based cloning and immunocytological titration of infectious porcine endogenous retrovirus subgroup A and B. J General Virol. 2002;83:2231-2240. [PubMed] [DOI] |
| 30. | Argaw T, Ritzhaupt A, Wilson CA. Development of a real time quantitative PCR assay for detection of porcine endogenous retrovirus. J Virol Meth. 2002;106:97-106. [PubMed] [DOI] |