修回日期: 2003-01-20
接受日期: 2003-02-12
在线出版日期: 2003-09-15
脂肪酸结合蛋白(fatty acid binding proteins FABPs)是一组低分子量(14-15 KD左右)结合长链脂肪酸的胞质蛋白, FABPs分布于哺乳动物的心肌、小肠、肝脏、脂肪组织、脑、表皮等组织细胞中. FABPs以其在组织中的分布而命名, 包括心肌型(H-FABP)、小肠型(I-FABP)、肝脏型(L-FABP)、脂肪细胞型(A-FABP)、脑细胞型(B-FABP)、肾脏型(K-FABP)、骨骼肌型(S-FABP)、牛皮癣相关型(PA-FABP)及表皮型(E-FABP)等9种类型, 具有组织特异性, 在同一细胞中可分布多种FABPs. 文献报道在长链脂肪酸的摄取、转运及代谢调节中发挥着重要作用. 本文对其组织分布、结构特性及脂肪酸的转运功能作一简要综述.
引文著录: 冯爱娟, 陈东风. 脂肪酸结合蛋白研究进展. 世界华人消化杂志 2003; 11(9): 1457-1459
Revised: January 20, 2003
Accepted: February 12, 2003
Published online: September 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1457-1459
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1457.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1457
脂肪酸结合蛋白(fatty acid binding proteins FABPs)是一组低分子量(14-15 KD左右)结合长链脂肪酸的胞质蛋白. 近年来, 已经采用大量实验方法对FABP的转运功能进行了研究. 这些方法包括分子水平的体内脂肪酸转运模型; 对脂肪酸的摄取和由基因控制的FABP的不同种类、数量的体内细胞转运的研究; 同时对缺乏特异FABPs表达的动物组织细胞进行检测. 研究数据均有力支持将FABPs定义为脂肪酸转运蛋白. 已经清楚知道FABPs周围包绕了大量的相关蛋白, 一些除结合脂肪酸外, 还结合了疏水的配体. 最近几年, 对FABPs的组织分布, 配体亲和力和特异性, 以及其结构特性进行了集中研究, 结果均表明FABPs参与细胞内脂质代谢.
FABPs分布于哺乳动物的心肌、小肠、肝脏、脂肪组织、脑、表皮等组织细胞中, 已发现的FABPs包括心肌型(H-FABP)、小肠型(I-FABP)、肝脏型(L-FABP)、脂肪细胞型(A-FABP)、脑细胞型(B-FABP)、肾脏型(K-FABP)、骨骼肌型(S-FABP)、牛皮癣相关型(PA-FABP) 及表皮型(E-FABP)等9种类型[1]. FABPs以其在组织中的分布而命名, 在同一细胞中可分布多种FABPs, 例如在小肠内皮细胞上存在两种不同FABPs, 即L-FABP和I-FABP, 二者具有29 %的同源性. 在植物中也发现有FABPs[2]. FABPs大约有130个标准氨基酸, 在小鼠L-FABP结构中有127个残基, 包括启始N-甲酰蛋氨酸. 不同类型FABPs的氨基酸序列有38-70 %的同源性, 在空间结构上也有相似之处, 都存在两个a 螺旋和一个b折叠结构. 各型FABPs的两个短b螺旋结构由肽链N末端的7个氨基酸组成, b折叠结构则是由92个氨基酸构成, 分为bA-J八个片层. L-FABP是第一个克隆并纯化的FABP家族的成员, 具有晶状体结构和氨基酸序列.
FABPs结合脂肪酸分子甲基并限制脂肪酸分子移动的重要功能单位是一个由a螺旋、bCF片层所组成的"开口"结构, 当此结构域与脂肪酸结合后, 由7个氢链所组成的静电网以及分子间范德华力的作用使得脂肪酸分子构象改变而被固定在FABPs分子内. FABPs"开口"结构在与脂肪酸结合的同时也与一个由Ash11、Asp34等组成的离子通道相耦联, 在特定的条件下通过这一离子通道的调节作用而结合或释放脂肪酸分子[3]. 这种结构决定了FABP能够结合各种类型脂肪酸, 在脂肪酸的摄取、转运及代谢调节中具有重要作用. 调节脂肪酸代谢是各型FABP的共同作用, 但在不同组织、不同条件下各型FABP的存在状况及活性均有所不同. 例如H-FABP特异地存在于心肌组织中, 约占心脏全部可溶性蛋白质的4-8 %, H-FABP与心肌细胞内的长链脂肪酸相结合, 将其从细胞质膜向脂化和氢化部位运输, 从而进入能量代谢体系氧化分解最终生成三磷酸腺苷(ATP), 为心肌收缩提供能量[4].
已对FABPs的转运功能进行了大量研究, 结果证明其转运功能与其和长链脂肪酸(C16-20)的亲和力密切相关. L-FABP的结合特性是FABP家族 中所特有的[5], L-FABP在细胞中, 特别是在细胞膜上, 不仅可与长链脂肪酸结合, 还可与其他酰基配体结合, 包括酰基辅酶A, 磷脂, 血红素蛋白及胆汁酸盐. 其中与长链脂肪酸的结合亲和力最高. 研究表明高脂饮食可增加肝脏和小肠中L-FABP、脂肪A-FABP含量, 对小肠I-FABPs无影响. 长链脂肪酸的疏水特性使结合力的测定复杂化. Kurian et al [6]改进1-磺酸盐-8-苯胺萘置换方法测定配体结合亲和力, 得出L-FABP对软脂酸盐、油酸盐、及花生四烯酸盐的亲和力最高. Richieri et al [7]利用不同的荧光方法检测FABPs与脂肪酸的亲和力, 结果证明FABPs的结合亲和力与脂肪酸的类型不同而不同(KD2-1 000 nm), 即饱和脂肪酸大于多聚不饱和脂肪酸. L-FABP结合溶血磷脂酸、血红蛋白素、胆盐、两种类型的过氧化物酶体增生体激活受体(PPAR)、类花生四烯酸类物质和肝脏致癌原. 大部分视黄醛分布在肝脏, L-FABP也结合视黄醇. L-FABP的一部分配体有可能通过改变其结合特性, 来调控蛋白功能. 如参与糖分解的中产物糖与6-磷酸葡萄糖结合, 增加对油酸盐及油酸辅酶A的亲和力. L-FABP结合胆固醇的作用目前尚有争议. 小鼠L-FABP的晶体结构可以促进中性脂肪酸的结合. L-FABP对油酸盐的亲和力随盐浓度的增加而降低.
大量的研究表明细胞内酶的活性是由FABPs调控的, 提出FABPs参与细胞内的脂质代谢. 已经对FABPs对线粒体和微粒体酶活性的作用, 特别是对L-FABP进行了研究, 对其他类型FABPs对细胞酶活性的研究未获取相关信息. 利用线粒体或微粒体制剂作为酶原提纯FABPs检测其对配体代谢的直接作用. 许多研究结果证明, FABPs作为配体供体这一作用特性, 提示这些蛋白对配体特殊的靶作用以及FABP与酶类有直接交互作用, 如酰基辅酶A合成酶, 此酶催化长链脂肪酸酯化, 为脂肪酸代谢的第一步.
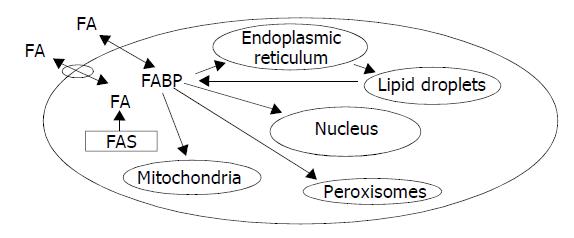
脂肪酸是细胞生命重要的分子, 通过b-氧化分解产生ATP, 酯化为甘油和固醇. 脂肪酸能否自由地从脂质双层转移或FABPs是否为转运所必需, 是脂代谢的关键问题. 试验表明未电离的脂肪酸或其衍生物能够快速通过磷脂双分子层. 多种因素影响脂肪酸从膜上被动转运[7] : (1)跨膜pH梯度; (2)脂肪酸在膜上结合区的分布; (3)游离脂肪酸转化为非透膜性衍生物(脂酰辅酶A酯); (4)为合成代谢和分解代谢利用脂肪酸. 目前长链脂肪酸有两种转运机制, 一是脂肪酸经过被动扩散穿过细胞膜; 另一种是在蛋白的参与下完成脂肪酸的跨膜转运(图1).
研究表明具有高亲和力的FABPs, 作为细胞内和细胞外的脂肪酸受体, 对脂肪酸及其衍生物的亲和力均促进脂肪酸的摄取. FABPs最基础的功能是参与食物中脂质的利用. 脂肪酸摄取、代谢和储存多的组织, 如肝脏、脂肪细胞及肌肉, 其FABP的含量增加. Ockner et al [8]是最早发现高脂饮食可以增加肝脏和小肠中L-FABP的含量, 对I-FABP影响较小. 除可增加肝L-FABP的含量, 用高脂饮食喂养的啮齿类动物可以使过氧化物酶体增生、增加酯酰CoA氧化酶以及细胞色素P450 4A1和过氧化物酶氧化, 这些作用为过氧化物酶体增生体反应. 正常浓度的长链脂肪酸对组织中FABPs的含量无影响, 只有线粒体氧化功能受到抑制时, L-FABP及过氧化物酶体氧化水平增加. 高脂饮食不但能增加L-FABP水平, 而且还能增加脂肪细胞 A-FABP的含量, 对心脏、肾脏和肌肉的影响尚未发现[9]. 长链脂肪酸诱导A-FABP的表达, 并且A-FABP的表达水平与长链脂肪酸的量密切相关. 几种转录因子, 如过氧化物酶体增生体激活受体(PPAR)能够促进脂肪细胞分化, 且PPAR DNA结合区位于A-FABP基因启动子区域. 已经证明PPAR结合长链脂肪酸, 控制A-FABP基因表达, 提示增加长链脂肪酸的浓度可以诱导A-FABP的含量, 同样, L-FABP也是通过PPAR来调控的. PPAR在脂肪酸分解代谢率高的组织中高表达, 如肝脏、肾脏、心脏及肌肉组织中, 通过诱导线粒体和过氧化物酶体氧化水平及L-FABP基因表达来刺激脂肪酸分解代谢. 因为细胞内脂肪沉积可以增加L-FABP的含量, 因此可以推断L-FABP与线粒体和过氧化物酶体氧化有关[10]. 同时, L-FABP又使胞质内游离脂肪酸含量保持最低浓度, 以免游离脂肪酸对胞膜的损害.
检测FABPs对脂肪酸内流的作用, 发现L-FABP可以增加油酸盐的内流, 对油酸盐表面扩散系数可以增加6倍[11]. 利用一系列荧光共振能量转换测定法对不同的FABPs家族成员不同的脂肪酸转运功能进行比较, 发现从FABPs到膜囊泡的脂肪酸转运比率可以发生变化, 认为FABPs的功能是作为脂质代谢过程分解代谢的或是合成代谢的中特异调控酶, 来维持细胞膜脂肪酸水平以及脂肪酸应答基因的表达规律[12]. 例如, FABP可以作为一种完全或更特定的特异酶通过底物或产物在胞质间隙的浓度, 来调控脂质代谢, 参与脂肪酸的摄取与输出过程; 或者是通过从特殊酶上传送或消除脂肪酸来调控脂质代谢.
Ockner et al [8]于1974年在研究I-FABP时采用的放射免疫法获得纯化的I-FABP, 然后用纯化I-FABP免疫家兔以获得I-FABP抗血清并用14C进行放射性标记, 14C标记抗血清与待测标本反应后, 通过测定免疫沉淀中放射性比活度来检测相应I-FABP的浓度. 1997年Wodzig et al [13]报道的一步法ELISA检测FABPs, 操作尤为简捷, 整个测定过程仅需45 min, 应用较广. 1998年, Robers et al [14]采用免疫比浊法测定血浆中FABPs, 这种方法的基本原理是将抗各型FABPs的单克隆抗体通过物理黏附法黏附到胶乳颗粒, 制成特定的胶乳检测试剂来检测相应FABPs的浓度, 操作更为简便快速.
总之, FABPs具有组织特异性, 从分子水平采用大量方法来测定FABPs的脂肪酸转运功能, 其确切的转运机制尚不十分清楚, 有待进一步研究. 目前FABPs检测在心肌梗塞等疾病的早期诊断中具有重要的价值[15]. 近年来, FABPs的测定还用于结肠癌、膀胱癌的早期诊断中, 由于结肠脱落上皮细胞、膀胱移行上皮细胞中I-FABP、L-FABP基因表达水平的检测有着重要价值, 一些分子生物学技术如核酸杂交、PCR、RT-PCR等在这些方面已显现出一定的应用前景. 由于其参与脂肪酸的摄取转运及代谢, 因此, 对于FABPs的研究因脂肪酸代谢异常引起的疾病, 如2型糖尿病、肥胖症及脂肪肝等, 有重要的意义.
| 1. | Van Nieuwenhoven FA, Van der Vusse GJ, Glatz JF. Membrane associated and cytoplasmic fatty acid binding proteins. Lipids. 1996;31:223-227. [DOI] |
| 2. | Glatz JF, van der Vusse GJ. Cell ularfatty acid-binding proteins: Current concepts and future directions. Mol Cell Biochem. 1990;98:237-251. [DOI] |
| 3. | Sacchettini JC, Gordon JI. Rat intestinanl fatty acid binding protein, A model system for analyzing the forces that can bind fatty acids to proteins. J Biol Chem. 1993;268:18399-18402. |
| 4. | 董 解菊. 脂肪酸结合蛋白测定及临床应用研究进展. 国外医学. 临床生物化学与检验学分册. 2001;22:74-76. |
| 5. | Storch J, Thumser AE. The fatty acid transport function of fatty acid-binding proteins. Molecul Cell Biol Lipid. 2000;1486:28-44. [DOI] |
| 6. | Kurian E, Kirk WR, Prendergast FG. Affinity of fatty acid for (g) rat intestinal fatty acid binding protein: Further examination. Biochemistry. 1996;35:38653874. |
| 7. | Richieri GV, Low PJ, Ogata RT, Kleinfeld AM. Thermodynamics of fatty acid binding to engineered mutants of the adipocyte and intestinal fatty acid-binding proteins. J Biol Chem. 1998;273:73977405. [DOI] |
| 8. | Ockner RK, Manning JA. Fatty acid-binding protein in small intestine. Identification, isolation, and evidence for its role in cellular fatty acid transport. Lipids. 1996;31:5223-5227. |
| 9. | Kaikaus RM, Chan WK, Ortiz de Montellano PR, Bass NM. Mechanisms of regulation of liver fatty acid-binding protein. Mol Cell Biochem. 1993;123:93100. |
| 10. | Zimmerman AW, van Moerkerk HT, Veerkamp JH. Ligand specificity and conformational stability of human fatty acid-binding proteins. J Biochem Cell Biol. 2001;33:865-876. [DOI] |
| 11. | Stewart JM, Driedzic WR, Berkelaar JA. Fatty-acid-binding protein facilitates the diffusion of oleate in a model cytosol system. Biochem J. 1991;275:569573. |
| 12. | Wootan MG, Bernlohr DA, Storch J. Mechanism of fluorescent fatty acid transfer from adipocyte fatty acid binding protein to membranes. Biochemistry. 1993;32:86228627. [DOI] |
| 13. | Wodzig KW, Pelsers MM, van der Vusse GJ, Roos W, Glatz JF. One-step enzyme-linked immunosorbent assay (ELISA) for plasma fatty acid binding protein. Anncl Biochem. 1997;34:263-268. [DOI] |
| 14. | Robers M, Van der Hulst FF, Fischer MA, Roos W, Salud CE, Eisenwiener HG, Glatz JF. Development of a rapid micropaticle-enhanced turbidimetric immunoassay for plasma fatty acidbinding protein, an early marker of acute myocardial infarction. Clin Chem. 1998;44:1564-1569. |
| 15. | Glatz JF, van der Vusse GJ, Simoons ML, Kragten JA, van Dieijen-Visser MP, Hermens WT. Fatty acid 朾inding protein and the early detection of acute myocardial infarction. Clinica Chimica Acta. 1998;272:87-92. [DOI] |