修回日期: 2003-05-25
接受日期: 2003-06-06
在线出版日期: 2003-09-15
动物体内的肽转运载体主要有两种, PepT1和PepT2. PepT1主要是肠肽转运载体, PepT2主要是肾脏肽转运载体.肽载体的分子结构特征主要有: (1)有12个假想的穿膜区, 在9区和10区之间有一大的胞外环, 且所有穿膜区内的序列都高度保留, 胞外环上的序列保留的很少;(2)被编码的蛋白上有多个N-糖基化和蛋白激酶的识别位点, 他们可能参与肽转运的调控; (3)PepT1上的His-57和PepT2上的His-87是最关键的组氨酸残基, 他们可能是转运蛋白发挥吸收功能时最关键的结合位点; (4)不同动物肽转运蛋白的氨基酸范围在707到729之间, 且不同动物相同器官肽转运载体的同源性高(大约80 %), 同种动物不同器官肽转运载体的同源性低(大约50 %). 了解肽载体的分子特征和组织分布, 可以更好地理解肽吸收的分子机制并有利于今后肽类药物的研发.
引文著录: 韩飞, 施用晖, 乐国伟, 王立宽. 肽转运载体的分子特征. 世界华人消化杂志 2003; 11(9): 1436-1442
Revised: May 25, 2003
Accepted: June 6, 2003
Published online: September 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1436-1442
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1436.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1436
肌体能否从消化道将完整的小分子肽吸收入血是近年来蛋白质研究领域的热点之一. 肽若完整吸收, 需穿越两个膜屏障, 一是肠上皮细胞的刷状缘膜, 另一个是肠上皮细胞的基底膜. 现已知小肽能借助刷状缘膜上的肽转运载体PepT1进入肠上皮细胞, 这些进入肠上皮细胞的小分子肽有多少能免遭肽酶的水解并穿过基底膜进入血液循环, 目前还不清楚[1-5]. 本文仅对不同动物体内, 肽穿越第一膜屏障时需借助的肽转运载体的分子特征, 以及其他组织上肽转运载体的分布情况和分子特征作一综述.
1990年代中期, 肽载体的分子结构逐渐明晰.在1994年, 两个实验小组同时确定了兔子的寡肽转运载体PepT1[6,7]. 兔子PepT1的cDNA长度为2.7 kb, 他编码的蛋白质由707个氨基酸残基组成.氨基酸序列研究表明PepT1是由12个穿膜区组成的膜蛋白. 该蛋白在9区和10区之间有一大的亲水环, 这一结构区别于以往报道的载体蛋白. 体外翻译的结果表明, 膜蛋白中的亲水环是与N相连的糖基化的靶点, 且位于细胞外.该蛋白还有其他特征, 如其上有一蛋白激酶C的磷酸化位点和一依赖性cAMP的磷酸化位点[7].
其他研究者克隆了人[8]和大鼠[9]的PepT1. 人的PepT1(h PepT1) cDNA长为2.2 kb, 有一开放的阅读框, 编码由708个氨基酸组成的蛋白质[8]. 大鼠的PepT1 cDNA长为2.9-3.0 kb, 有一开放的阅读框, 编码由710个氨基酸组成的蛋白质[9-12].
尽管不同种类动物PepT1 cDNA的长度不同, 但是他们编码的蛋白质在结构上却非常相似[13]. 他们都有12个假想的穿膜区, 且在9区和10区之间有一长的亲水片段, 这也是这一组转运蛋白最显著的特征. 结构预测模型表明, 长的亲水环位于细胞膜的外侧, 包含有几个与N相连的糖基化位点. 膜内容纳所有的12个a-螺旋, 且氨基端和羧基端都位于胞质一侧.这些PepT1蛋白具有高度的同源性.大鼠PepT1的氨基酸序列与兔子和人的PepT1氨基酸序列分别有77 %和88 %的同源性[9]. 兔子和人的PepT1有81 %的同源性[8]. 但这些转运蛋白的氨基酸序列与其他已知的转运蛋白没有强的同源性. 值得注意的是, 所有穿膜区内的序列都高度保留, 而胞外环上的序列却保留的很少.转运蛋白在结构上的差别表明蛋白激酶A和C磷酸化位点的位置和数量可能有所不同.但这些转运蛋白结构上的差异与其转运功能有何联系, 现在还不清楚.
另一种肽的转运载体, PepT2, 与PepT1在结构和功能上都有所不同[14-19]. 人的PepT2 cDNA的全长是2.7 kb, 有一长为2.2 kb的开放阅读框[16]. 大鼠的PepT2 cDNA长为3.9 kb[14]. 尽管这些PepT2 cDNA的长度不同, 但他们都编码由729个氨基酸组成的蛋白质[20]. PepT1和PepT2的共同特征包括假想的12个穿膜区, 一个大的胞外环和几个依赖于磷酸化的蛋白激酶位点.
虽然PepT1和PepT2转运蛋白在结构上有如此多的相似性, 但他们仍属于两个不同的转运体系[13]. 同种动物的PepT1和PepT2相比, 其同源性低于不同动物相同转运体系之间的同源性. 例如, 人的PepT2与大鼠的PepT2转运蛋白的氨基酸有83 %的同源性, 而人的PepT2与人的PepT1转运蛋白仅有50 %的同源性. 而且, PepT2蛋白比PepT1蛋白的分子量大.
被克隆的肽转运蛋白的转运活性通常是通过肽转运蛋白的cDNA在非洲爪蛙卵母细胞(xenopus oocytes)或其他细胞体系中体外表达来研究的. 体外转运研究表明, 肽载体能广泛的吸收二肽和三肽, 这些二肽和三肽可由酸性, 碱性或疏水性氨基酸组成. 在不同的条件下肽载体的转运底物可能是带电荷的或是中性的. 在生理pH条件下, 中性底物比带电荷的底物更容易被肽转运载体转运. 且PepT1对中性和阴性底物的亲和性比对阳性底物的亲和性大.若想转运阳性底物, pH必须再高一些[21-23,26].
肽转运载体的转运特征之一是肽底物与质子耦联转运[24,25,27-29]. Brandsch et al [30]研究了Gly-Ser通过Caco-2(PepT1)和SKPT细胞系(PepT2)时, 胞外pH为6.0或7.0的情况下, 质子对Gly-Ser吸收的影响.在Caco-2细胞里, 转运载体与Gly-Ser的亲和常数(Kt)在pH6.0时为1.0 mmol/L-1, 在pH7.0时是1.2 mM.而Gly-Ser的最大吸收速度(Vmax)在pH6.0时为13.7±0.3 nmol 10 min-1mg-1蛋白, 在pH7.0时为5.8±0.3 nmol 10 min-1mg-1蛋白. 在SKPT细胞系里也获得了相似的结果.可见, 在两种细胞系里, 质子仅影响了Vmax, 而对底物与转运载体的亲和性没有影响. Steel et al [31]的研究表明, 质子与肽之间存在一个耦联比例, 对中性, 酸性和碱性的二肽来说, 该比例分别为1:1, 2:1, 和1:1. 且pH在5.5-6.0的情况下, PepT1优先转运中性和酸性底物.
影响转运蛋白结构的因子, 如转运蛋白在细胞膜上的位置, 底物与转运蛋白结合的特定位点等都影响转运蛋白的转运活性. 有报道表明, 转运蛋白的组氨酸残基中, hPepT1上的His-57和PepT2上的His-87是最关键的组氨酸残基, 他们可能是转运蛋白在发挥吸收功能时最关键的结合位点[32-37], 而大鼠PepT1上的必须组氨酸残基可能涉及到与H+和底物a-氨基的结合[23,26,39].
蛋白激酶A和C可能参与了肽转运的调控. Muller et al [38]的研究表明, 表达PepT1的Caco-2细胞内, 增加cAMP的水平, 可以导致Gly-Ser的吸收下降50 %.锌是一种必需的微量元素, 他在许多蛋白的结构和功能方面发挥着重要作用, 如稳定酶的结构, 是酶活性位点的必需成分, 作为酶的调控因子等等. Daniel et al [40] 认为, 锌对肽的转运有选择作用. 他们用硫酸锌培养刷状缘膜囊(BBMV), 在不改变底物扩散速率的情况下, 观察到Gly-Gln和Leu-Tyr的吸收增加. 而相同情况下锌对谷氨酰胺或葡萄糖通过BBMV却没有影响.
肽载体在不同组织的分布信息主要来自于对编码肽转运蛋白的mRNA的研究. 基本技术是用特定的作了放射性标记的DNA作为探针, 进行Northern杂交分析, 大多数研究报道采用的是全长cDNA. 有人报道, 在兔子的小肠中发现有2.9 kb长的mRNA, 在肝脏和肾脏里的量比较低, 而在大脑中量则更低[7,41]. 在结肠, 骨骼肌, 心脏, 脾脏或肺中没有检测到mRNA.大鼠PepT1 mRNA长为2.9-3.0 kb, 主要位于小肠[19, 12]. 在肾脏的皮质发现有微量的mRNA, 但在肝脏中未发现有mRNA的存在. Liang et al [8]报道, 人的PepT1 mRNA长为3.3 kb, 主要出现在小肠和来自于Caco-2细胞系的肠道上皮细胞. 在肾脏, 胎盘, 肝脏和胰腺中也观察到了PepT1 mRNA, 而在肌肉, 大脑和心脏中没有发现.
在大鼠肾脏髓质中发现一长约4 kb的PepT2 mRNA, 而在肾脏皮质中的丰度较低. 在大脑, 肺和脾脏中也发现了这种mRNA, 但在心脏, 肝脏和小肠中未检测到[14,42,43]. 在兔子的肾脏皮质, 以及大脑, 肺, 肝脏和心脏中发现一4.8 kb的PepT2 mRNA[15]. 在人的肾脏和小肠中也检测到了PepT2 mRNA[16].
PepT1 mRNA能够在小肠中全长表达, 在结肠中表达的丰度低的多[41], 在胃和盲肠中未能检测到. 他在小肠中的表达仅限于上皮表面, 在较深的组织, 如肌黏膜或肌浆膜, 未检测到PepT1 mRNA的表达[7]. 沿着肠绒毛的轴线(crypt-villus axis), 发现mRNA的最大表达量位于腺窝汇合点(crypt-villus junction) 以上大约100-200 mm处. 在整个小肠腺窝的较低部到中部未检测到这种mRNA的存在.
Ogihara et al [44]首次研究了转运蛋白本身而不是他的mRNA的位置. 他们研制了一种抗-PepT1抗体, 并用他(通过免疫杂交技术)在大鼠体内寻找PepT1蛋白. 研究结果证实, 在整个小肠PepT1被严格地表达, 而在肠绒毛底部没有PepT1. 并且PepT1对于特殊的有吸收能力的上皮细胞是专有的, 且主要位于细胞的刷状缘膜.
由以上可知, PepT1和PepT2在不同的组织分布不同. PepT1主要是肠肽转运载体, PepT2主要是肾脏肽转运载体.有趣的是, PepT1在肾脏中也能检测到[42].PepT1存在于动物的小肠, 表明其在营养和医药领域上有重要的作用, 可以借助他吸收肠道中的小肽和类肽药物[45-51]. PepT2在肾脏中也发挥着重要的作用, 通过他可以重吸收部分肽和类肽药物, 从而提高了某些类肽药物的有效性并保存了以肽形式存在的氮源[52-57].
近来, 在大鼠的大脑中克隆出第三种肽的转运载体[58], PHT1, 他编码由572个氨基酸组成的蛋白质, 该转运蛋白也有12个穿膜区, 且在胞外的亲水环上也有多个与N相连的糖基化位点和多个依赖性蛋白激酶C的磷酸化位点. 但PHT1是一个全新的肽转运载体, 因其能够转运小肽和组氨酸, 而以往的肽载体只能转运小肽而不能转运游离氨基酸. PHT1能在大脑和眼睛中被表达, 而在肠道和肾脏中不能被表达.且PHT1与PepT1和PepT2的同源性很低(小于20 %), 其生理作用目前尚不清楚.
鸡肠肽转运载体(cPepT1)的cDNA长为2 914 bp, 编码714个氨基酸组成的蛋白质, 估计其分子大小为79.3 kD, 等电点为7.48[59].
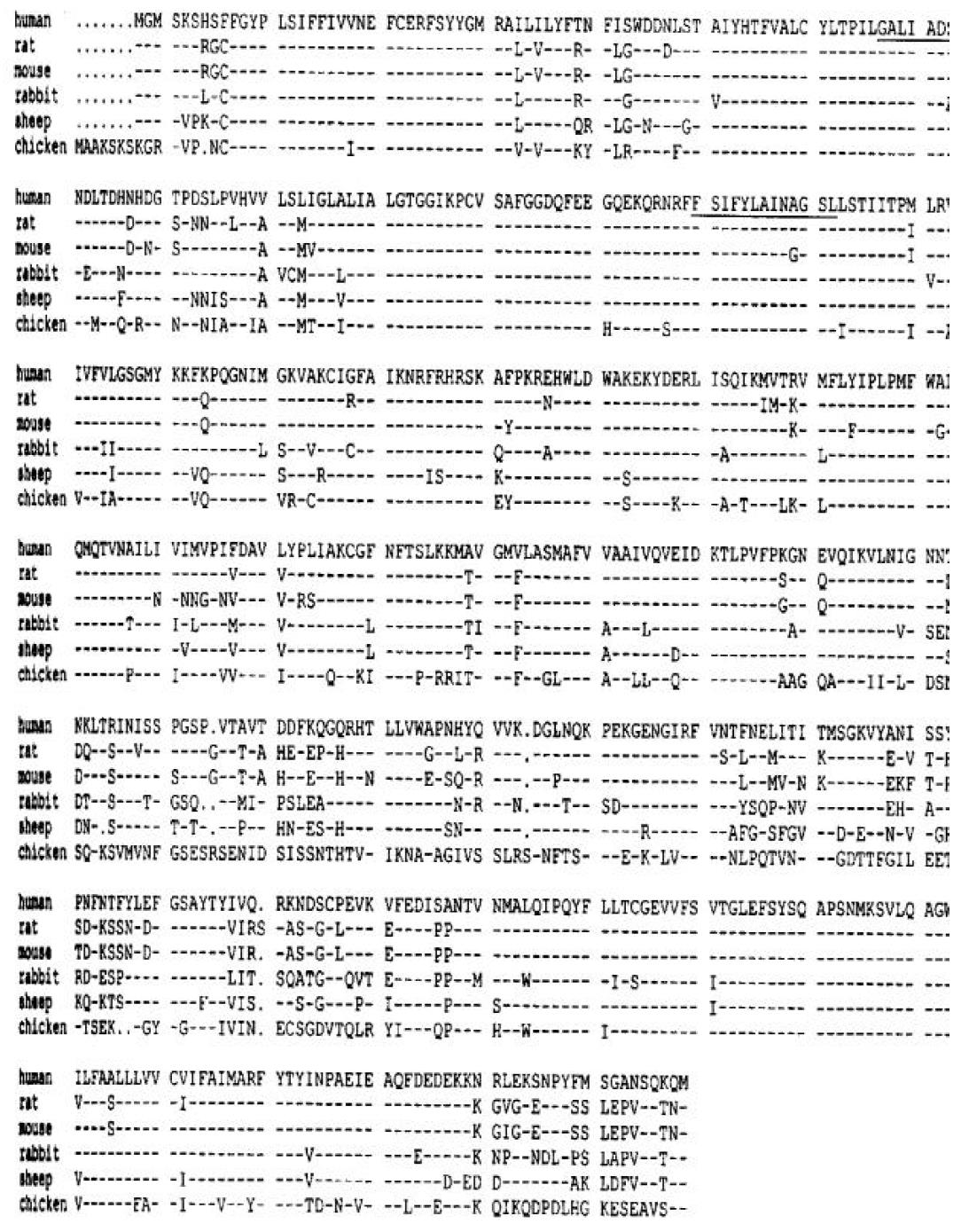
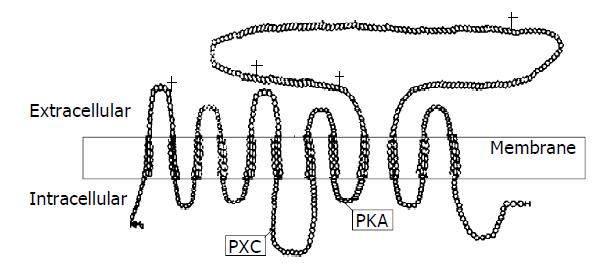
cPepT1 氨基端的前15个氨基酸残基与哺乳动物的PepT1完全不同(图1). cPepT1预测的氨基酸序列与兔子、人、小鼠、大鼠和绵羊的PepT1有62.4 %, 62.5 %, 63.8 %, 64.8 %和65.1 %的同源性.疏水性研究表明, cPepT1, 类似于哺乳动物的PepT1, 有12个假想的穿膜区, 且在穿膜区9和10之间有一个大的胞外环(图2). 模型也预测到了氨基端和羧基端均位于膜的胞质一侧.与其他种类动物的PepT1相比, 其穿膜区有84 %的同源性, 而胞外环仅有21 %的同源性.序列分析也表明cPepT1存在PTR2家族标记(family signatures), 他位于cPepT1的第2和第3个穿膜区(FALIADSWLGKFKTIV SLSIVYTI)以及第5个穿膜区的核心序列(FSIFYLAINAGSL, 图1)上.
大的胞外环含有4个潜在的与N-相连的糖基化位点, 分别位于Asn414 (N-F-S), Asn423(N-V-T), Asn485(N-F-T)和Asn508(N-I-T)处.在穿膜区1和2之间的胞外环上Asn56 (N-F-T)也有一个潜在的与N-相连的糖基化位点.预测的蛋白还包含一个潜在的依赖性蛋白激酶C(PKC)的磷酸化位点, 其位于穿膜区6和7的胞内环上(Ser272, S-E-K), 而且在穿膜区8和9之间的胞内环(The365, R-R-I-T)上有一个潜在的依赖性蛋白激酶A(PKA)的磷酸化位点.
在严格的杂交实验递质条件下, 十二指肠、空肠、回肠、肾脏和盲肠里检测到长为2.9 kb的mRNA. 在十二指肠、空肠和回肠组织中, mRNA有非常强烈的杂交现象, 肾脏和盲肠的mRNA杂交现象较弱, 而其他组织, 包括肝脏, 嗉囊, 腺胃和腓骨肌上未检测到任何杂交的痕迹. 尽管有实验表明[61,62]大鼠的肌浆细胞(C2C12)和绵羊的肌浆卫星细胞能够利用外源肽作为蛋白合成的前体, 但Chen et al [59] (2 002)在腓骨肌上未检测到任何mRNA的杂交痕迹. 兔子、大鼠和人[7,8,12]的肝脏和肾脏中有PepT1 mRNA存在, 但在Chen et al [59]的研究中, cPepT1 mRNA在肾脏和盲肠中能勉强检测到一些, 而在肝脏中却未检测到任何cPepT1 m RNA的痕迹.说明cPepT1 m RNA的表达模式与其他动物的PepT1稍有不同.
对cPepT1功能特性的研究表明[59,60], 肽转运过程是一个依pH的过程, 且其最佳的pH为6.0和6.5 (优于pH在5.0、5.5和7.0).Na+、K+或Ca2+对cPepT1的转运活性无任何影响. cPepT1对大多数的二肽和三肽有高的亲和性, 而四肽和游离氨基酸不能作为cPepT1的底物.
绵羊肽转运载体(oPepT1)的cDNA长度为2 829 bp, 编码由707个的氨基酸组成的蛋白质, Mr约为78 kD, 等电点为6.57[64]. oPepT1预测的氨基酸序列与人、大鼠和兔子的PepT1有83 %、81 %和78 %的同源性(图1).
与人、兔子和大鼠的PepT1相比, oPepT1也有12个假想的穿膜区, 且在9区和10区之间有一长的胞外环(200个氨基酸). 氨基端和羧基端也位于膜的胞质一侧.但在长的胞外环上含有5个与N相连的糖基化位点, 分别位于Asn404 (N-N-S), Asn434 (N-L-S), Asn438 (N-I-S), Asn508 (N-V-S), Asn513 (N-A-S).在穿膜区3和4之间短的胞外环上观察到一个与N相连的糖基化位点, 位于Asn117 (N-I-S). 预测的蛋白上包含4个潜在的依赖性蛋白激酶C(PKC)的磷酸化位点, 位于穿膜区6和7 (Ser252, S-K-K, Ser266, S-E-K), 8和9(Ser357, S-L-K), 以及10和11 (Ser611, S-N-M-K)之间的胞内环上. 还含有3个潜在的依赖性蛋白激酶A (PKA)的磷酸化位点, 位于穿膜区6和7 (Ser249, R-I-S, Ser275, R-L-I-S)以及8和9 (Thr362, K-M-T)之间的胞内环上[64].
尽管oPepT1在结构上与其他动物的PepT1存在一定的相似性, 但他们之间还是有显著的区别.首先, oPepT1的等电点(6.57) 低于其他动物PepT1的等电点 (大鼠PepT1, PI 7.39; 兔子PepT1, PI 7.47; 人PepT1, PI 8.58). 这可能是由于不同动物肠道的生理条件不同造成的. 小肠和大肠的黏膜细胞, 以及胰腺和胆囊分泌的碳酸氢盐是一种基础的缓冲物质.胰腺和胆囊分泌的碳酸氢盐中和胃酸并提供合适的pH值用于酶对饲料组分的降解和营养物质的吸收.单胃动物小肠的pH值为5.5-6.0 [63]. 而对于反刍动物, 胰腺和胆囊分泌的碳酸氢盐不足以中和从胃运送到小肠的酸性物质. 绵羊十二指肠和空肠上段的pH值为2.5到4.5, 直到空肠下段pH才接近6. 因此, 反刍动物PepT1蛋白的等电点低于其他动物的等电点是可以理解的. 第二, PepT1蛋白上潜在的磷酸化位点也存在显著的区别. 兔子PepT1上仅有一个PKC的磷酸化位点和一个PKA的磷酸化位点[7]. 人的PepT1上有两个PKC的磷酸化位点, 但没有PKA的磷酸化位点[8]. 大鼠PepT1上有一个PKC的磷酸化位点和一个PKA的磷酸化位点[12]. Brandsch et al [68]的研究结果显示, 在人的Caco-2细胞里表达的H+依赖型肽转运系统可以被PKC调控. 因此, 可以推测oPepT1可以被蛋白激酶调控. 但是, 不同动物潜在的磷酸化位点不同与其生理作用有何关系目前还不清楚. 第三, 电荷分配分析表明, oPepT1蛋白的672到691氨基酸之间有一负电荷团. 与其他动物的PepT1相比, oPepT1的负电荷团里有更多带负电荷的氨基酸. PepT1和PepT2的化学功能分析显示, 大的胞外环和C末端对于转运系统的动力学特征没有影响[65]. 因此, 这个范围很可能对肽转运蛋白运送到细胞或者调控转运功能有关, 因为潜在的PKC位点位于C末端. C末端的负电荷可能通过改变oPepT1蛋白插入到血浆膜的速度影响oPepT1的转运活性.
Northern Blot分析表明, 绵羊和泌乳奶牛的PepT1能够在小肠, 瓣胃和瘤胃中表达[64,66]. poly(A)+RNA在这些组织中的表达模式为, 空肠和回肠的PepT1丰度最高, 瓣胃和十二指肠的较低, 瘤胃中的丰度最低. 小肠是oPepT1 mRNA表达的最主要位点. 这一模式与以前报道的反刍动物蛋白消化产物的主要吸收位点在小肠相一致. 在绵羊和奶牛的真胃、肝脏、肾脏、盲肠和结肠中未检测到PepT1的存在[64,66]. 尽管有实验表明, 奶牛和小鼠的乳腺细胞能利用外源肽作为蛋白合成的前体[69-71], 但在Chen et al [66]和Pan et al [64]的实验中未能检测到乳腺中有PepT1的存在。其他研究者报道在兔子, 大鼠和人的肝脏和肾脏能检测到PepT1 mRNA[7,8,12], 说明反刍动物肽载体mRNA的表达模式与其他动物有所不同.
Matthews et al [69]观察到Met-Gly 和肌肽(-Ala-His)能够通过瘤胃和瓣胃上皮被吸收. 底物浓度检测结果发现这种吸收基本上是非递质(non-mediated)的, 且瓣胃上皮比瘤胃上皮更有能力吸收和转运这些肽.在其他研究中, oPepT1被提取出来并注射进非洲爪蛙的卵母细胞中[64,66,67,72]. 注射了oPepT1的卵母细胞比注射水的卵母细胞能吸收更多的Gly-Sar, 说明oPepT1能够在卵母细胞中表达. 这种被表达的肽转运载体是依H+的, 但与Na+、Cl- 或Ca2+无关.且Gly-Sar在注射了oPepT1的卵母细胞中的吸收是有饱和性的, 吸收1 mM的Gly-Sar能够被5 mM的b-Ala-His, Met-Gly和Gly-Leu所抑制, 但不被5 mM Gly抑制, 说明这些二肽是通过相同的转运蛋白转运的, 而Gly不是. pH对带电荷肽的转运影响较大, 中性和阴性底物(Gly-Sar, Gly-Sar和Glu-Glu)通过oPepT1转运的最适pH为5.0, 而阳性底物, Lys-Lys, 最适pH为7.0. 但在pH5.5时, Lys-Lys也能内向流动, 说明在肠道的生理pH条件下(反刍动物的这一pH范围为4.5-5.0), oPepT1能转运带各种电荷的肽底物, 只是中性和阴性肽可能比阳性肽转运的更快一些. 这与兔子和人的PepT1在生理pH条件(5.5-6.0)下, 优先转运中性和酸性肽底物[29,31]相一致.
Pan et al [73]为了研究影响肽载体亲和力的肽的结构特点, 在pH 5.5时用注射了绵羊poly (A)RNA的非洲爪蛙的卵母细胞, 研究了几种肽的转运情况. 研究显示, 注射了poly(A)RNA的卵母细胞能够转运二肽Gly-Sar, Gly-Leu, Gly-Pro, Phe-Leu, Leu-Leu; 三肽Leu-Ser-Phe, Leu-Gly-Phe, Lys-Tyr-Lys, Ala-Pro-Gly, Meu-Leu-Phe, Leu-Leu-Tyr和四肽Met-Gly-Met-Met, Val-Gly-Asp-Glu, Ala-Gly-Ser-Glu, Val-Gly-Ser-Glu, 但不能转运Pro-Phe-Gly-Lye, Val-Ala- Ala-Phe. 且不能转运实验中的五肽、六肽、七肽和八肽. 在所采用的实验条件下, 能被转运的肽的分子量大小, 疏水性, 电荷的变化非常大.实验中二, 三, 四肽的转运能力与Mr的相关关系是r =0.02 (P =0.94), 转运与疏水性的相关关系是r =0.34 (P =0.21), 转运与净电荷的相关关系是r =0.1 (P =0.72).因此, 转运载体的转运能力似乎与被转运分子的Mr, 疏水性或带电量无关. 对哺乳动物质子与肽转运载体耦联的研究中也发现, 肽载体与肽底物的理化特点(即Mr, 电荷)无关. 肽载体对底物的特异性表明, 许多(但并不是所有的)二肽、三肽、四肽能被转运, 但游离氨基酸不能被转运.
Matthews et al [69]最初的研究表明, 肽的吸收可能在很大程度上不需要载体介导, 但是在反刍动物的胃区确实有肽转运载体的存在.从绵羊体内收集瓣胃上皮用于测定在其他肽存在的情况下Gly-Sar的吸收情况[74,75]. 结果表明, Gly-Sar的吸收非但没有被抑制反而被促进了.这与我们所想象的多底物在同一转运体系被转运时, 相互竞争的结果将会使Gly-Sar的转运受抑制(即吸收量减少)的结果相反.因此可以推测, 通过消化道上皮的肽的转运可能涉及多种机制, 而不是仅依靠肽转运载体转运.确认这些机制的存在并澄清这些机制的相互关系有利于更好的理解肽吸收的重要意义.
尽管许多动物的肽转运载体已被克隆和表达, 其分子结构也逐渐明晰, 但对不同肽载体分子结构与功能的关系却知之甚少. 现尚有许多问题亟待研究: (1)肽转运载体表达上调和下调的细胞和分子机制; (2)肽载体结构和功能的关系, 即怎样改变肽载体的分子构型从而获得最大的转运效果. 对这个问题的回答有助于解释为什么PepT1是低亲和力/高容量的肽载体, 而PepT2是高亲和力/低容量的肽载体[76]. (3)怎样调整类肽药物的结构使其与肽载体更好的亲和; (4)基底膜肽载体的研究.
| 1. | Webb KE Jr, Dirienzo DB, Matthews JC. Recent developments in gastrointestinal absorption and tissue utilization of peptides: a review. J Dairy Sci. 1993;76:351-361. [DOI] |
| 2. | Webb KE Jr, Matthews JC, DiRienzo DB. Peptide absorption: a review of current concepts and future perspectives. J Anim Sci. 1992;70:3248-3257. [DOI] |
| 3. | Webb KE Jr. Intestinal absorption of protein hydrolysis products: a review. J Anim Sci. 1990;68:3011-3022. |
| 4. | Webb KE Jr. Amino acid and peptide absorption from the gastrointestinal tract. Fed Proc. 1986;45:2268-2271. |
| 5. | Gewirtz AT, Liu Y, Sitaraman SV, Madara JL. Intestinal epithelial pathobiology: past, present and future. Best Pract Res Clin Gastroenterol. 2002;16:851-867. |
| 6. | Boll M, Markovich D, Weber WM, Korte H, Daniel H, Murer H. Expression cloning of a cDNA from rabbit small intestine related to proton-coupled transport of peptides, beta-lactam antibiotics and ACE-inhibitors. Pflugers Arch. 1994;429:146-149. [DOI] |
| 7. | Fei YJ, Kanai Y, Nussberger S, Ganapathy V, Leibach FH, Romero MF, Singh SK, Boron WF, Hediger MA. Expression cloning of a mammalian proton-coupled oligopeptide transporter. Nature. 1994;368:563-566. |
| 8. | Liang R, Fei YJ, Prasad PD, Ramamoorthy S, Han H, Yang-Feng TL, Hediger MA, Ganapathy V, Leibach FH. Human intestinal H+/peptide cotransporter. Cloning, functional expression, and chromosomal localization. J Biol Chem. 1995;270:6456-6463. [DOI] |
| 9. | Saito H, Okuda M, Terada T, Sasaki S, Inui K. Cloning and characterization of a rat H+/peptide cotransporter mediating absorption of beta-lactam antibiotics in the intestine and kidney. J Pharmacol Exp Ther. 1995;275:1631-1637. |
| 10. | Terada T, Saito H, Sawada K, Hashimoto Y, Inui K. N-terminal halves of rat H+/peptide transporters are responsible for their substrate recognition. Pharm Res. 2000;17:15-20. [DOI] |
| 11. | Sawada K, Terada T, Saito H, Hashimoto Y, Inui K. Effects of glibenclamide on glycylsarcosine transport by the rat peptide transporters PEPT1 and PEPT2. Br J Pharmacol. 1999;128:1159-1164. |
| 12. | Miyamoto K, Shiraga T, Morita K, Yamamoto H, Haga H, Taketani Y, Tamai I, Sai Y, Tsuji A, Takeda E. Sequence, tissue distribution and developmental changes in rat intestinal oligopeptide transporter. Biochim Biophys Acta. 1996;1305:34-38. |
| 13. | Fei YJ, Ganapathy V, Leibach FH. Molecular and structural features of the proton-coupled oligopeptide transporter superfamily. Prog Nucleic Acid Res Mol Biol. 1998;58:239-261. [DOI] |
| 14. | Saito H, Terada T, Okuda M, Sasaki S, Inui K. Molecular cloning and tissue distribution of rat peptide transporter PEPT2. Biochim Biophys Acta. 1996;1280:173-177. |
| 15. | Boll M, Herget M, Wagener M, Weber WM, Markovich D, Biber J, Clauss W, Murer H, Daniel H. Expression cloning and functional characterization of the kidney cortex high-affinity proton-coupled peptide transporter. Proc Natl Acad Sci USA. 1996;93:284-289. |
| 16. | Liu W, Liang R, Ramamoorthy S, Fei YJ, Ganapathy ME, Hediger MA, Ganapathy V, Leibach FH. Molecular cloning of PEPT 2, a new member of the H+/peptide cotransporter family, from human kidney. Biochim Biophys Acta. 1995;1235:461-466. [DOI] |
| 17. | Amasheh S, Wenzel U, Weber WM, Clauss W, Daniel H. Electrophysiological analysis of the function of the mammalian renal peptide transporter expressed in Xenopus laevis oocytes. J Physiol. 1997;504:169-174. [DOI] |
| 18. | Wenzel U, Diehl D, Herget M, Daniel H. Endogenous expression of the renal high-affinity H+-peptide cotransporter in LLC-PK1 cells. Am J Physiol. 1998;275:C1573-1579. |
| 19. | Daniel H, Herget M. Cellular and molecular mechanisms of renal peptide transport. Am J Physiol. 1997;273:F1-8. |
| 20. | Boll M, Herget M, Wagener M, Weber WM, Markovich D, Biber J, Clauss W, Murer H, Daniel H. Expression cloning and functional characterization of the kidney cortex high-affinity proton-coupled peptide transporter. Proc Natl Acad Sci USA. 1996;93:284-289. [DOI] |
| 21. | Nussberger S, Steel A, Trotti D, Romero MF, Boron WF, Hediger MA. Symmetry of H+ binding to the intra-and extracellular side of the H+-coupled oligopeptide cotransporter PepT1. J Biol Chem. 1997;272:7777-7785. |
| 22. | Pan X, Terada T, Irie M, Saito H, Inui K. Diurnal rhythm of H+-peptide cotransporter in rat small intestine. Am J Physiol Gastrointest Liver Physiol. 2002;283:G57-64. |
| 23. | Turner JR, Black ED, Ward J, Tse CM, Uchwat FA, Alli HA, Donowitz M, Madara JL, Angle JM. Transepithelial resistance can be regulated by the intestinal brush-border Na(+)/H(+) exchanger NHE3. Am J Physiol Cell Physiol. 2000;279:C1918-1924. [DOI] |
| 24. | Lister N, Bailey PD, Collier ID, Boyd CA, Bronk JR. The influence of luminal pH on transport of neutral and charged dipeptides by rat small intestine, in vitro. Biochim Biophys Acta. 1997;1324:245-250. |
| 25. | Lister N, Sykes AP, Bailey PD, Boyd CA, Bronk JR. Dipeptide transport and hydrolysis in isolated loops of rat small intestine: effects of stereospecificity. J Physiol. 1995;484:173-182. [DOI] |
| 26. | Chen Z, Fei YJ, Anderson CM, Wake KA, Miyauchi S, Huang W, Thwaites DT, Ganapathy V. Structure, function and immunolocalization of a proton-coupled amino acid transporter (hPAT1) in the human intestinal cell line Caco-2. J Physiol. 2003;546:349-361. |
| 27. | Fei YJ, Nara E, Liu JC, Boyd CA, Ganapathy V, Leibach FH. Preferential recognition of zwitterionic dipeptides as transportable substrates by the high-affinity peptide transporter PEPT2. Biochim Biophys Acta. 1999;1418:344-351. [DOI] |
| 28. | Mackenzie B, Fei YJ, Ganapathy V, Leibach FH. The human intestinal H+/oligopeptide cotransporter hPEPT1 transports differently-charged dipeptides with identical electrogenic properties. Biochim Biophys Acta. 1996;1284:125-128. |
| 29. | Amasheh S, Wenzel U, Boll M, Dorn D, Weber W, Clauss W, Daniel H. Transport of charged dipeptides by the intestinal H+/peptide symporter PepT1 expressed in Xenopus laevis oocytes. J Membr Biol. 1997;155:247-256. [DOI] |
| 30. | Brandsch M, Brandsch C, Ganapathy ME, Chew CS, Ganapathy V, Leibach FH. Influence of proton and essential histidyl residues on the transport kinetics of the H+/peptide cotransport systems in intestine (PEPT 1) and kidney (PEPT 2). Biochim Biophys Acta. 1997;1324:251-262. |
| 31. | Steel A, Nussberger S, Romero MF, Boron WF, Boyd CA, Hediger MA. Stoichiometry and pH dependence of the rabbit proton-dependent oligopeptide transporter PepT1. J Physiol. 1997;498:563-569. [DOI] |
| 32. | Fei YJ, Liu W, Prasad PD, Kekuda R, Oblak TG, Ganapathy V, Leibach FH. Identification of the histidyl residue obligatory for the catalytic activity of the human H+/peptide cotransporters PEPT1 and PEPT2. Biochemistry. 1997;36:452-460. |
| 33. | Chen XZ, Steel A, Hediger MA. Functional roles of histidine and tyrosine residues in the H(+)-peptide transporter PepT1. Biochem Biophys Res Commun. 2000;272:726-730. |
| 34. | Terada T, Saito H, Inui K. Interaction of beta-lactam antibiotics with histidine residue of rat H+/peptide cotransporters, PEPT1 and PEPT2. J Biol Chem. 1998;273:5582-5585. [DOI] |
| 35. | Terada T, Saito H, Mukai M, Inui KI. Identification of the histidine residues involved in substrate recognition by a rat H+/peptide cotransporter, PEPT1. FEBS Lett. 1996;394:196-200. |
| 36. | Ganapathy V, Balkovetz DF, Ganapathy ME, Mahesh VB, Devoe LD, Leibach FH. Evidence for histidyl and carboxy groups at the active site of the human placental Na+-H+ exchanger. Biochem J. 1987;245:473-477. |
| 37. | Fei YJ, Liu JC, Fujita T, Liang R, Ganapathy V, Leibach FH. Identification of a potential substrate binding domain in the mammalian peptide transporters PEPT1 and PEPT2 using PEPT1-PEPT2 and PEPT2-PEPT1 chimeras. Biochem Biophys Res Commun. 1998;246:39-44. |
| 38. | Muller U, Brandsch M, Prasad PD, Fei YJ, Ganapathy V, Leibach FH. Inhibition of the H+/peptide cotransporter in the human intestinal cell line Caco-2 by cyclic AMP. Biochem Biophys Res Commun. 1996;218:461-465. [DOI] |
| 39. | Terada T, Sawada K, Saito H, Hashimoto Y, Inui K. Functional characteristics of basolateral peptide transporter in the human intestinal cell line Caco-2. Am J Physiol. 1999;276:G1435-1441. |
| 40. | Daniel H, Adibi SA. Selective effect of zinc on uphill transport of oligopeptides into kidney brush border membrane vesicles. FASEB J. 1995;9:1112-1117. |
| 41. | Freeman TC, Bentsen BS, Thwaites DT, Simmons NL. H+/di-tripeptide transporter (PepT1) expression in the rabbit intestine. Pflugers Arch. 1995;430:394-400. |
| 42. | Wang H, Fei YJ, Ganapathy V, Leibach FH. Electrophysiological characteristics of the proton-coupled peptide transporter PEPT2 cloned from rat brain. Am J Physiol. 1998;275:C967-975. [DOI] |
| 43. | Terada T, Sawada K, Irie M, Saito H, Hashimoto Y, Inui K. Structural requirements for determining the substrate affinity of peptide transporters PEPT1 and PEPT2. Pflugers Arch. 2000;440:679-684. |
| 44. | Ogihara H, Saito H, Shin BC, Terada Y, Takenoshita S, Nagamachi Y, Inui KI, Takata K. Immuno-localization of H+/peptide cotransporter in rat digestive tract. Biochem Biophy Res Commun. 1996;848-852. |
| 45. | Terada T, Saito H, Mukai M, Inui K. Characterization of stably transfected kidney epithelial cell line expressing rat H+/peptide cotransporter PEPT1: localization of PEPT1 and transport of beta-lactam antibiotics. J Pharmacol Exp Ther. 1997;281:1415-1421. |
| 46. | Ganapathy ME, Prasad PD, Mackenzie B, Ganapathy V, Leibach FH. Interaction of anionic cephalosporins with the intestinal and renal peptide transporters PEPT 1 and PEPT 2. Biochim Biophys Acta. 1997;1324:296-308. [DOI] |
| 47. | Ganapathy ME, Brandsch M, Prasad PD, Ganapathy V, Leibach FH. Differential recognition of beta -lactam antibiotics by intestinal and renal peptide transporters, PEPT 1 and PEPT 2. J Biol Chem. 1995;270:25672-25677. |
| 48. | Nusrat A, von Eichel-Streiber C, Turner JR, Verkade P, Madara JL, Parkos CA. Clostridium difficile toxins disrupt epithelial barrier function by altering membrane microdomain localization of tight junction proteins. Infect Immun. 2001;69:1329-1336. |
| 49. | Nusrat A, Turner JR, Madara JL. Molecular physiology and pathophysiology of tight junctions. IV. Regulation of tight junctions by extracellular stimuli: nutrients, cytokines, and immune cells. Am J Physiol Gastrointest Liver Physiol. 2000;279:G851-857. [DOI] |
| 50. | Temple CS, Stewart AK, Meredith D, Lister NA, Morgan KM, Collier ID, Vaughan-Jones RD, Boyd CA, Bailey PD, Bronk JR. Peptide mimics as substrates for the intestinal peptide transporter. J Biol Chem. 1998;273:20-22. [DOI] |
| 51. | Sugawara M, Huang W, Fei YJ, Leibach FH, Ganapathy V, Ganapathy ME. Transport of valganciclovir, a ganciclovir prodrug, via peptide transporters PEPT1 and PEPT2. J Pharm Sci. 2000;89:781-789. |
| 52. | Inui K, Terada T, Masuda S, Saito H. Physiological and pharmacological implications of peptide transporters, PEPT1 and PEPT2. Nephrol Dial Transplant. 2000;15:11-13. |
| 53. | Ganapathy ME, Huang W, Wang H, Ganapathy V, Leibach FH. Valacyclovir: a substrate for the intestinal and renal peptide transporters PEPT1 and PEPT2. Biochem Biophys Res Commun. 1998;246:470-475. [DOI] |
| 54. | Daniel H, Adibi SA. Functional separation of dipeptide transport and hydrolysis in kidney brush border membrane vesicles. FASEB J. 1994;8:753-759. [DOI] |
| 55. | Minami H, Daniel H, Morse EL, Adibi SA. Oligopeptides: mechanism of renal clearance depends on molecular structure. Am J Physiol. 1992;263:F109-115. |
| 56. | Daniel H, Morse EL, Adibi SA. The high and low affinity transport systems for dipeptides in kidney brush border membrane respond differently to alterations in pH gradient and membrane potential. J Biol Chem. 1991;266:19917-19924. |
| 57. | Daniel H, Morse EL, Adibi SA. Determinants of substrate affinity for the oligopeptide/H+ symporter in the renal brush border membrane. J Biol Chem. 1992;267:9565-9573. |
| 58. | Yamashita T, Shimada S, Guo W, Sato K, Kohmura E, Hayakawa T, Takagi T, Tohyama M. Cloning and functional expression of a brain peptide/histidine transporter. J Biol Chem. 1997;272:10205-10211. [DOI] |
| 59. | Chen H, Pan Y, Wong EA, Bloomquist JR, Webb KE Jr. Molecular cloning and functional expression of a chicken intestinal peptide transporter (cPepT1) in Xenopus oocytes and Chinese hamster ovary cells. J Nutr. 2002;132:387-393. |
| 60. | Pan Y, Wong EA, Dibner JJ, Vazquez-Anon M, Webb KE Jr. Poly(A)(+) RNA encoding proteins capable of transporting L-methionine and/or DL-2-hydroxy-4-(methylthio) butanoic acid are present in the intestinal mucosa of broilers. J Nutr. 2002;132:382-386. [DOI] |
| 61. | Pan Y, Bender PK, Akers RM, Webb KE Jr. Methionine-containing peptides can be used as methionine sources for protein accretion in cultured C2C12 and MAC-T cells. J Nutr. 1996;126:232-241. [DOI] |
| 62. | Pan Y, Webb KE Jr. Peptide-bound methionine as methionine sources for protein accretion and cell proliferation in primary cultures of ovine skeletal muscle. J Nutr. 1998;128:251-256. |
| 63. | Ganapathy V, Leibach FH. Electrogenic transport of 5-oxoproline in rabbit renal brush-border membrane vesicles. Effect of intravesicular potassium. Biochim Biophys Acta. 1983;732:32-40. |
| 64. | Pan Y, Wong EA, Bloomquist JR, Webb KE Jr. Expression of a cloned ovine gastrointestinal peptide transporter (oPepT1) in Xenopus oocytes induces uptake of oligopeptides in vitro. J Nutr. 2001;131:1264-1270. |
| 65. | Doring F, Dorn D, Bachfischer U, Amasheh S, Herget M, Daniel H. Functional analysis of a chimeric mammalian peptide transporter derived from the intestinal and renal isoforms. J Physiol. 1996;497:773-779. [DOI] |
| 66. | Chen H, Wong EA, Webb KE Jr. Tissue distribution of a peptide transporter mRNA in sheep, dairy cows, pigs, and chickens. J Anim Sci. 1999;77:1277-1283. [DOI] |
| 67. | Matthews JC, Wong EA, Bender PK, Bloomquist JR, Webb KE Jr. Demonstration and characterization of dipeptide transport system activity in sheep omasal epithelium by expression of mRNA in Xenopus laevis oocytes. J Anim Sci. 1996;74:1720-1727. |
| 68. | Brandsch M, Miyamoto Y, Ganapathy V, Leibach FH. Expression and protein kinase C-dependent regulation of peptide/H+ co-transport system in the Caco-2 human colon carcinoma cell line. Biochem J. 1994;299:253-260. |
| 69. | Matthews JC, Webb KE Jr. Absorption of L-carnosine, L-methionine, and L-methionylglycine by isolated sheep ruminal and omasal epithelial tissue. J Anim Sci. 1995;73:3464-3475. [DOI] |
| 70. | Wang S, Webb KE Jr, Akers MR. Peptide-bound methionine can be a source of methionine for the synthesis of secreted proteins by mammary tissue explants from lactating mice. J Nutr. 1996;126:1662-1672. [DOI] |
| 71. | Backwell FR, Bequette BJ, Wilson D, Calder AG, Metcalf JA, Wray-Cahen D, MacRae JC, Beever DE, Lobley GE. Utilization of dipeptides by the caprine mammary gland for milk protein synthesis. Am J Physiol. 1994;267:R1-6. |
| 72. | Chen H, Pan YX, Wong EA, Webb KE Jr. Characterization and regulation of a cloned ovine gastrointestinal peptide transporter (oPepT1) expressed in a mammalian cell line. J Nutr. 2002;132:38-42. |
| 73. | Pan YX, Wong EA, Bloomquist JR, Webb KE Jr. Poly(A)+ RNA from sheep omasal epithelium induces expression of a peptide transport protein(s) in Xenopus laevis oocytes. J Anim Sci. 1997;75:3323-3330. |
| 74. | McCollum MQ, Webb KE Jr. Glycyl-L-sarcosine absorption across ovine omasal epithelium during coincubation with other peptide substrates and volatile fatty acids. J Anim Sci. 1998;76:2706-2711. [DOI] |
| 75. | McCollum MQ, Vazquez-Anon M, Dibner JJ, Webb KE Jr. Absorption of 2-hydroxy-4-(methylthio)butanoic acid by isolated sheep ruminal and omasal epithelia. J Anim Sci. 2000;78:1078-1083. [DOI] |
| 76. | Adibi SA. Renal assimilation of oligopeptides: physiological mechanisms and metabolic importance. Am J Physiol. 1997;272:E723-36. |