修回日期: 2003-05-28
接受日期: 2003-06-06
在线出版日期: 2003-09-15
观察牛磺酸对四氯化碳(CCl4)诱导大鼠肝纤维化的保护及其机制.
采用CCl4诱导的大鼠肝纤维化模型, 研究牛磺酸(400 and 800 mg/kg per day for 12 weeks) 对血清丙氨酸氨基转移酶(ALT)、血浆蛋白、透明质酸(HA)、III型前胶原(PCIII)及肝组织羟脯氨酸(HYP)、肝药酶和抗转化生长因子b1 (TGF-b1)的影响, 并观察肝组织病理学变化.
牛磺酸能明显减轻纤维化程度, 降低ALT(2 601±300→1367±317 nkat/L, P <0.01), HA (324±95→219±79 mg/L, P <0.01), PCIII (33±14→19±8 mg/L, P <0.01)和HYP (1 282±523→381±147 mg/L, P <0.01)水平, 提高肝细胞色素P450 (Cyt.P450) (211±27→811±136 nmol/g, P <0.01), 细胞色素b5(Cyt.b5) (256±69→761±131 nmol/g, P <0.01) 和血清白蛋白含量(23±3→31±4 g/L, P <0.05), 并明显减少TGF- b1的表达(33±13→20±6, P <0.01).
牛磺酸具有显著的抗CCl4诱导的大鼠肝纤维化作用, 其作用机制可能与减轻肝细胞损伤和抑制TGF-b1的表达有关.
引文著录: 梁健, 杨光业, 张锡流, 庞玉生, 袁海锋, 梁劲松, 黄仁彬, 韦新, 韦明. 牛磺酸对CCl4诱导的大鼠肝纤维化的保护作用及其机制的研究. 世界华人消化杂志 2003; 11(9): 1392-1395
Revised: May 28, 2003
Accepted: June 6, 2003
Published online: September 15, 2003
To study the protective effect of taurine on hepatic fibrosis induced by carbon tetrachloride (CCl4) in rats and its mechanisms.
CCl4-induced rat hepatic fibrosis was treated by taurine (400 and 800 mg/kg per day for 12 weeks), and serum alanine aminotransferase (ALT), plasma protein, hyaluronic acid (HA) and procollagen III (PC III), and hepatic hydroxyproline (HYP), hepatic microsomal drug-metabolizing enzyme and anti-transforming growth factor b1 (TGF-b1) were measured. In addition, pathological changes of liver tissue were observed by light microscope.
The hepatic fibrosis, activity of serum ALT(2 601±300→1367±317 nkat/L, P <0.01), and contents of serum HA (324±95→219±79 mg/L, P <0.01), PC III (33±14→19±8 mg/L, P <0.01) and hepatic HYP (1 282±523→381±147 mg/L, P <0.01) were markedly reduced by the treatment with taurine (32.57±13.73 vs 19.20±8.25 ng/ml, P <0.01 and 1.282±0.523 vs 0.463±0.159 mg/ml, P <0.05). The contents of plasma albumin (23±3→31±4 g/L, P <0.05) and hepatic cytochrome P450(Cyt.P450)(211±27→811±136 nmol/g, P <0.01) and cytochrome b5 (Cyt.b5) (256±69→761±131 nmol/g, P <0.01) were increased by the same treatment (0.211±0.027 vs 0.765±0.106 nmol/mg protein, P <0.01 and 0.256±0.069 vs 0.697±0.120 nmol/mg protein, P <0.01). In addition, taurine could also significantly inhibit the expression of TGF-b1 (33±13→20±6 , P <0.01).
CCl4-induced hepatic fibrosis is markedly relieved by the treatment of taurine, and its protective mechanisms are related to the decrease in liver injury and expression of TGF-b1.
- Citation: Liang J, Yang GY, Zhang XL, Pang YS, Yuan HF, Liang JS, Huang RB, Wei X, Wei M. Inhibitory mechanism of taurine against CCl4 induced hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1392-1395
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1392.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1392
肝纤维化是以细胞外基质(ECM)[1-10]合成增多, 降解相对不足, 过多沉积在肝内引起,是可逆病变, 因此, 减轻纤维化反应十分重要[11-16]. 牛磺酸是体内含量最丰富的氨基酸, 参与膜主要成分磷脂代谢, 保护膜磷脂免受降解, 具有直接膜稳定作用[2]. 此外, 还具有清除自由基和抗脂质过氧化[3,4]等广泛的生物学作用. 我们建立实验性大鼠CCl4肝纤维化模型, 探讨牛磺酸对肝纤维化的防治作用及其可能的机制.
Wistar大鼠, SPF级, ♂, 体质量230±20 g, 由广西医科大学实验动物中心提供; 牛磺酸为湖州市生物化学试剂厂产品; CCl4为上海试剂三厂产品; HA、PCIII放射免疫分析测定盒, 均为上海海军医学研究所生物技术中心产品; HYP试剂盒为南京建成生物工程公司研究所产品, 批号分别20020108; TGF-b1 mAb及SABC免疫组化染色试剂盒,由武汉博士德生物工程有限公司提供; 彩色病理图纹分析系统, 型号HPIAAS-1000, (JVCKY-F30B3-CCD摄像头, 日本Olympus研究型显微镜, 华海公司生产的全自动图像分析系统)为中国华海电子有限公司产品, 紫外-可见光分光光度计比色, 型号DU-640, 为美国Beckman公司产品; 自动生化分析仪, 型号TBA-120FR, 为日本东芝公司产品.
将实验动物分为正常对照组, 模型组, 牛磺酸大剂量组和小剂量组, 每组20只. 给予大鼠皮下注射400 mL/L CCl4橄榄油溶液, 首剂量按质量计算为5 mL/kg, 以后2次/wk, 每次剂量为3 mL/kg, 连续注射12 wk, 并在实验过程自由饮用100 mL/L乙醇作为饮水. 牛磺酸小剂量组在造模的同时给予牛磺酸400 mg/kg, 牛磺酸大剂量组给予牛磺酸800 mg/kg, ig, 1次/d, 并予正常饮食. 正常对照组ig. 等容积的生理盐水. 实验动物在最后1次注射CCl4隔夜禁食16 h后, 取血用作生化学、HA和PCIII含量测定, 取部分肝组织匀浆用作测定肝药酶和HYP, 肝组织用40 g/L甲醛溶液常规固定、石蜡切片, 用作病理组织学检查和免疫组化实验. 用自动生化分析仪测定血清TP, ALB和ALT, 用放射免疫法测定血清HA, PCIII含量. 按Omura and Sato方法测定肝组织Cyt. P450含量(J Biol Chem 1964;239:2370-2385), 唐跃年et al [9]方法测定Cyt.b5含量, 周少春et al [10]方法测定HYP . 用免疫组化法测定肝组织TGF-b1的表达. 肝组织分别用HE染色和Masson法胶原纤维染色, 在光学显微镜下观察, 按肝组织病理诊断标准做出肝组织病理分期诊断, 分级方法参见曾民德et al [11]方法. 胶原纤维定量测定: 采用肝组织胶原纤维染色标本, 放大400倍, 于标本四角和中央位置选取5个视野, 测定每一视野中胶原纤维含量, 以纤维占视野面积的百分比表示, 取其平均值.
统计学处理 用SPSS10.0软件统计, 计量资料用表示, 组间均数比较用t检验, 各组大鼠纤维增生程度的比较用秩和检验.
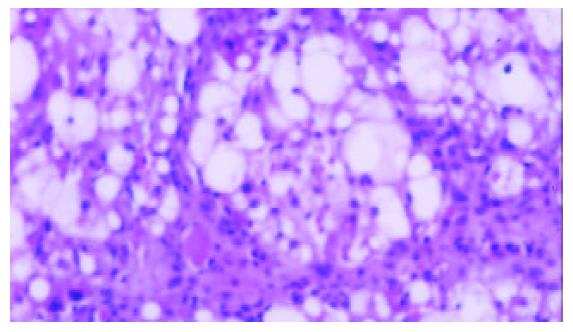
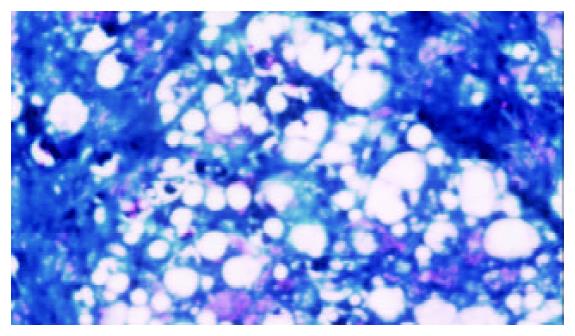
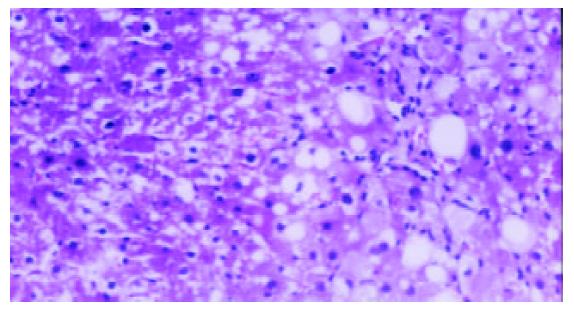
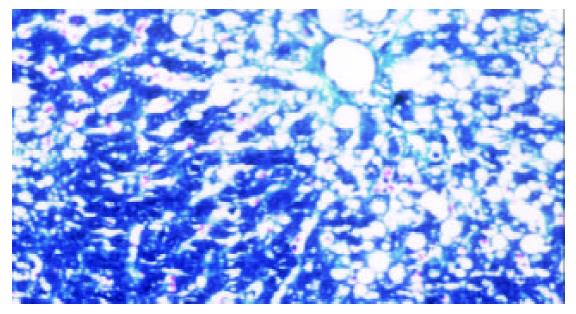
模型组可见多数肝小叶结构紊乱, 肝细胞脂肪变性广泛, 部分有坏死, 门管区及肝小叶内有较多炎性细胞浸润, 纤维组织增生显著, 包绕肝小叶(图1, 2). 牛磺酸治疗组肝组织结构有较明显改善, 肝细胞脂肪变性显著减轻, 炎性细胞浸润和纤维组织增生减少(图3, 4)(表1).
| 分组 | n | 肝纤维化分期 | ||||
| S0 | S1 | S2 | S3 | S4 | ||
| 正常对照组a | 20 | 20 | 0 | 0 | 0 | 0 |
| 模型组 | 20 | 0 | 3 | 3 | 10 | 4 |
| 牛磺酸小剂量a | 20 | 0 | 12 | 5 | 3 | 0 |
| 牛磺酸大剂量a | 20 | 0 | 14 | 4 | 2 | 0 |
肝纤维化常伴炎症, 可发展为肝硬化[11,12]. 血清HA, PCIII水平和肝组织HYP含量与肝组织纤维含量有良好的相关性, 可以做为反映肝纤维化程度的指标[13-15]. 而HA在目前所有肝纤维化血清学指标中是诊断价值最高的一个[16]. TGF-b1是作用最强的致肝纤维化细胞因子, TGF-b1的活化是大量细胞外间质合成的主要来源[17]. 为了准确的反映纤维化程度, 我们采用肝组织病理学检查和反映细胞外间质成分的HA, PCIII, HYP以及反映纤维化形成的相关因子TGF-b1进行联合检测.
CCl4引起肝损害的作用机制主要是CCl4经肝微粒体内依赖于Cyt.P450的混合功能酶的激活, 产生了自由基CCl3及Cl, 这些自由基可与肝细胞内大分子发生共价结合, 使肝细胞损伤. 此外, 二者均可导致微粒体钙泵活性降低, 使胞质Ca2+升高, 细胞内Ca2+稳态遭到破坏, 从而引起细胞代谢紊乱甚至死亡[18-22]. 坏死物质及其继发的炎性细胞浸润产生肝纤维化刺激因子, 后者促进贮脂细胞-肌成纤维细胞-成纤维细胞增生, 产生大量胶原纤维, 形成肝纤维化[23,24]. 因而, 抑制炎症的发生, 可阻止肝纤维化的进展. 肝组织的慢性炎症损伤和纤维化使肝功能障碍, 血浆总蛋白、白蛋白水平降低. 研究结果显示, 牛磺酸治疗组能显著提高血浆白蛋白水平, 降低CCl4导致的肝纤维化大鼠血清ALT, HA, PCIII和肝组织HYP水平, 说明牛磺酸可减轻肝脏的炎症反应, 促进肝组织损伤的修复和改善功能, 同时抑制胶原蛋白及蛋白多糖的合成[4,5,25]. 本结果还显示, 经牛磺酸治疗后, 肝组织TCF-b1表达显著下降, 与模型对照组比较差异有显著性, 说明牛磺酸可抑制TGF-b1的活性, 拮抗TGF-b1在肝纤维化形成中的作用. Cyt.P450系统是位于滑面内质网上的一组混合功能氧化酶系, 他参与内源性物质和外源性物质代谢, 能够反映肝脏的解毒功能[26]. 本实验表明, 模型组大鼠Cyt.P450和Cyt.b5含量明显低于其他各组, 说明大鼠在形成肝纤维化时肝脏解毒功能明显下降, 而经牛磺酸干预后, 大鼠肝脏Cyt.P450和Cyt.b5含量明显增加, 解毒功能明显增强.
总之, 牛磺酸具有显著的防治实验性大鼠肝纤维化的作用. 其机制可能是通过拮抗CCl4的肝毒性作用, 抑制炎症, 保护肝细胞, 以及抑制TGF-b1的活性有关.
| 2. | Lee HS, Huang GT, Chen CH, Chiou LL, Lee CC, Yang PM, Chen DS, Sheu JC. Less reversal of liver fibrosis after prolonged carbon tetrachloride injection. Hepatogastroenterology. 2001;48:1312-1315. |
| 3. | Huxtable RJ. Physiological actions of taurine. Physiol Rev. 1992;77:101-163. [DOI] |
| 4. | Birdsall TC. Therapeutic applications of taurine. Altern Med Rev. 1998;3:128-136. |
| 5. | Balkan J, Dogru-Abbasoglu S, Kanbagli O, Cevikbas U, Aykac-Toker G, Uysal M. Taurine has a protective effect against thioacetamide-induced liver cirrhosis by decreasing oxidative stress. Hum Exp Toxicol. 2001;20:251-254. [DOI] |
| 6. | Koyman I, Nakamura T, Ogasawara M, Nemoto M, Yoshida T. The protective effect of taurine on the biomembrane against damage produced by the oxygen radical. Adv Exp Med Biol. 1992;315:335-339. |
| 7. | Du G, Mouothys-Mickalad A, Sluse FE. Generation of superoxide anion by mitochondria and impairment of their functions during anoxia and reoxygenation in vitro. Free Radic Biol Med. 1998;25:1066-1074. [DOI] |
| 8. | Omura T, Sato R. The carbon monoxide binding pigment of liver microsomes. J Biol Chem. 1964;239:2370-2385. |
| 10. | 周 少春, 车 建图, 李 定国. 大鼠肝组织羟脯氨酸的测定. 上海第二医科大学学报. 1997;17:458-460. |
| 15. | Huang Z, Li Q, Wang Z. Observation on dynamic changes of serum procollagen III, hyaluronic acid and laminin in rats with hepatic fibrosis treated with Hujin pill. Zhongguo Zhong Xiyi Jiehe Zazhi. 2000;20:447-449. |
| 16. | Housset C, Guechot J. Hepatic fibrosis: physiopathology and biological diagnosis. Pathol Biol. 1999;47:886-894. |
| 17. | Potter JJ, Rennie-Tankesley L, Mezey E. Influence of leptin in the development of hepatic fibrosis produced in mice by Schistosoma mansoni infection and by chronic carbon tetrachloride administration. J Hepatol. 2003;38:281-288. [DOI] |
| 19. | Rechnagel RO, Glende EH Jr. Carbon tetrachloride hepatotoxicity: an example of lethal cleavage. CRC Crit Rev Toxicol. 1973;2:263-297. [DOI] |
| 20. | Huang R, Okuno H, Takasu M, Shiozaki Y, Inoue K. Protective effect of rifampicin against acute liver injury induced by Carbon tetrachoride in mice. Jpn J Pharmacol. 1995;69:325-334. [DOI] |
| 21. | Chae HB, Jang LC, Park SM, Son BR, Sung R, Choi JW. An experimental model of hepatic fibrosis induced by alcohol and CCl4: can the lipopolysaccharide prevent liver injury induced by alcohol and CCl4? Taehan Kan Hakhoe Chi. 2002;8:173-178. |
| 22. | Zim MC, Silveira TR, Schwartsmann G, Cerski T, Motta A. Potentiation of carbon tetrachloride hepatotoxicity by pentosan polysulfate in rats. Braz J Med Biol Res. 2002;35:1339-1346. [DOI] |
| 24. | Jeong WI, Lee CS, Park SJ, Chung JY, Jeong KS. Kinetics of macrophages, myofibroblasts and mast cells in carbon tetrachloride-induced rat liver cirrhosis. Anticancer Res. 2002;22:869-877. |
| 25. | Chen Y, Li S, Zhang X. Taurine inhibits deposition of extracellular matrix in experimental liver fibrosis in rats. Zhonghua Ganzangbing Zazhi. 1999;7:165-167. |
| 26. | Hung DY, Chang P, Cheung K, McWhinney B, Masci PP, Weiss M, Roberts MS. Cationic drug pharmacokinetics in diseased livers determined by fibrosis index, hepatic protein content, microsomal activity, and nature of drug. J Pharmacol Exp Ther. 2002;301:1079-1087. [DOI] |