修回日期: 2002-12-15
接受日期: 2002-12-25
在线出版日期: 2003-09-15
评价树突状细胞负载凋亡肝癌细胞后的免疫应答.
用放线菌素-D诱导肝癌细胞调亡, 在体外用负载凋亡肝癌细胞的DC诱导自身淋巴细胞, 使其活化为肝癌特异性T细胞, 并用其进行杀伤实验.
DC负载凋亡肝癌细胞后活化的CTL细胞分泌较高水平Th1型细胞因子IL-12和TNF, 并表现出较高的杀伤活性, 对NK 细胞敏感的靶细胞慢性髓原性白血病细胞K562 也有较强的杀伤作用, 提示此CTL同时具备NK特征.
负载凋亡肝癌细胞的DC对原发性肝癌的研究和治疗具有潜在应用价值.
引文著录: 郭建巍, 秦力维, 蔡美英, 吕同德. DC负载凋亡肝癌细胞后的免疫应答. 世界华人消化杂志 2003; 11(9): 1365-1368
Revised: December 15, 2002
Accepted: December 25, 2002
Published online: September 15, 2003
To estimate the immune responses of dendritic cells after loaded with apoptotic hepatocellular carcinoma cells.
IApoptosis of hepatocellular carcinoma cells(HCCs) was induced with actinomycin-D. Interactions of DCs and apoptotic HCCs were observed under transmission electron microscope. Growth inhibition test of DC against HCC lines was also performed.
After stimulated by apoptotic HCCs pulsed DCs, the culture medium of primed lymphocytes contained a a high level of Th1 cytokines IL-12 and TNF. Lymphocytes primed by apoptotic HCCs pulsed DC were not only specific lysis HCC lines but also K562 cells, and showed a characteristic of NK cells. DCs inhibited the growth of human HCC lines and other cancer cells.
Apoptotic HCCs pulsed DCs have a potential prospect in research and treatment in primary hepatocellular carcinoma.
- Citation: Guo JW, Qin LW, Cai MY, Lu TD. Immune responses of DC after loaded with apoptotic Hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2003; 11(9): 1365-1368
- URL: https://www.wjgnet.com/1009-3079/full/v11/i9/1365.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i9.1365
对原发性肝癌患者DC的研究表明, 肝癌患者DC诱导同种异体淋巴细胞转化的能力降低, HLA-DR分子表达下降, 处于非成熟状态[1,2]. 因为只有成熟DC才能有效呈递抗原, 激发特异性T细胞的抗肿瘤应答, 所以从健康人DC入手使之负载肿瘤相关抗原, 持续高水平表达多种肿瘤抗原表位, 并通过MHC-I、II类分子得到充分呈递, 然后将这些功能正常且负载有肿瘤抗原的致敏DC回输患者, 诱导机体产生有效的抗肝癌免疫应答, 是肝癌治疗中一有效的途径.
rhGM-CSF(pepro tech ), rhIL-4 (pepro tech ), 鼠抗人DC单克隆抗体[3] (镇江医学院许化溪教授馈赠), RPMI1640 (Gibco); 淋巴细胞分离液(上海试剂二厂), 新生小牛血清(杭州四季青生物工程材料研究所), MTT(华美生物工程公司); 放线菌素-D(Sigma), IL-12 P70 ELISA检测试剂盒(jingmei biothch); 细胞凋亡检测试剂盒(北京宝赛生物技术有限公司), 兔抗人Fas-L多克隆抗体(santa cruz, USA), 羊抗兔-FITC标记二抗(华美公司); 18-25岁健康志愿者; 肝癌细胞SMMC-7721, QGY-7703, HEPG-2[4] , Alexander et al [5], 胃癌细胞SGC-7901, 慢性髓原性白血病细胞K562, Burkitt淋巴瘤细胞Raji, L929细胞和正常人二倍体细胞为本教研室液氮保存. Elite-ESP型流式细胞检测仪(beckman coulter公司); 激光共聚焦显微镜(Radio); 透射电镜(Hitachi).
DC的体外诱导和培养(参照华西医科大学学报 2002;33:68). 肝癌细胞凋亡的诱导和检测[6]: 在对数生长期肝癌细胞SMMC-7721中加入放线菌素-D 10 mg/L, 37 °C含50 mL/L CO2的培养箱中培养24 h, PBS洗涤3次, TV液消化细胞, PBS洗涤, 将细胞重悬于200 mL binding buffer, 加入10 mL AnnexinV-FITC 和 5 mL PI, 轻轻混匀, 4 °C反应30 min. 最后加入300 mL Binding Buffer, 将细胞混合液离心, 取细胞沉淀涂片, 激光共聚焦显微镜观察. 将凋亡的肝癌细胞和DC以1:5混合, 37 °C含50 mL/L CO2的培养箱中培养4 h, PBS洗涤3次, 细胞沉淀用30 g/L戊二醛及10 g/L 锇酸固定, 经乙醇梯度脱水, 超薄切片铅铀染色后透射电镜观察.
1.2.1 淋巴细胞培养上清中TNF和IL-12水平测定 将凋亡的肝癌细胞和DC以1: 5混合, 37°C含50 mL/L CO2的培养箱中培养4 h, 不完全RPMI1640洗涤3次. 将负载凋亡肝癌细胞后的DC与自身淋巴细胞以1:5混合后用含300KU/l基因重组IL-2的完全RPMI1640分瓶培养, 3, 5 d换液, 7 d收集培养上清. 常规法检测TNF和IL-12.
1.2.2 DC 活化的淋巴细胞对肝癌细胞的特异性杀伤[7] 将负载凋亡肝癌细胞的DC与自身淋巴细胞以1:5混合后用含300 KU/l基因重组IL-2的完全RPMI1640分瓶培养3, 5 d换液. 7 d收集活化的淋巴细胞, 按3×105, 1.5×105, 7.5×104最终效靶比(E/T)分别为6/1, 3/1, 1.5/1分别加入96孔细胞培养板作效应细胞, 靶细胞分别为肝癌细胞SMMC-7721, QGY-7703, HEPG-2, Alexander , 胃癌细胞SGC-7901, 慢性髓原性白血病细胞K562. 靶细胞浓度为5×104/孔. 同时设相同浓度的效应细胞和每种靶细胞对照各3复孔.
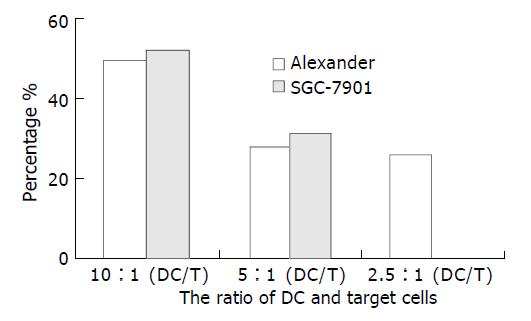
1.2.3 DC 对肝癌细胞的生长抑制试验[8] 收集诱导7 d的DC, 分为两组, 一组直接加入96孔细胞培养板中, 另一组加LPS 10 g/L后再加入96孔细胞培养扳, 每一组DC细胞浓度分别为2×105和1×105/孔(效靶比分别为2/1, 1/1), 靶细胞分别为肝癌细胞SMMC-7721, QGY-7703, HEPG-2 , Alexander , 胃癌细胞SGC-7901, 慢性髓原性白血病细胞K562, Burkitt淋巴瘤细胞Raji 和正常人二倍体细胞, 靶细胞浓度为1×105/孔, 同时做每种靶细胞和效应细胞对照各三复孔. 效应细胞与靶细胞混合培养16 h, 加入5 g/L MTT 10 mL继续培养8 h. 离心培养板(2 000 r/min, 10 min), 弃去上清, 每孔加DMSO 100 mL, 于570 nm处测定A值. 按抑制率=[1-(实验孔A值-效应细胞对照孔A均值)/靶细胞对照孔A均值]×100 %计算实验结果; 用肝癌细胞Alexander 和胃癌细胞SGC-7901分别作靶细胞, 以效靶比10/1, 5/1, 2.5/1重复以上实验, 并计算抑制率.
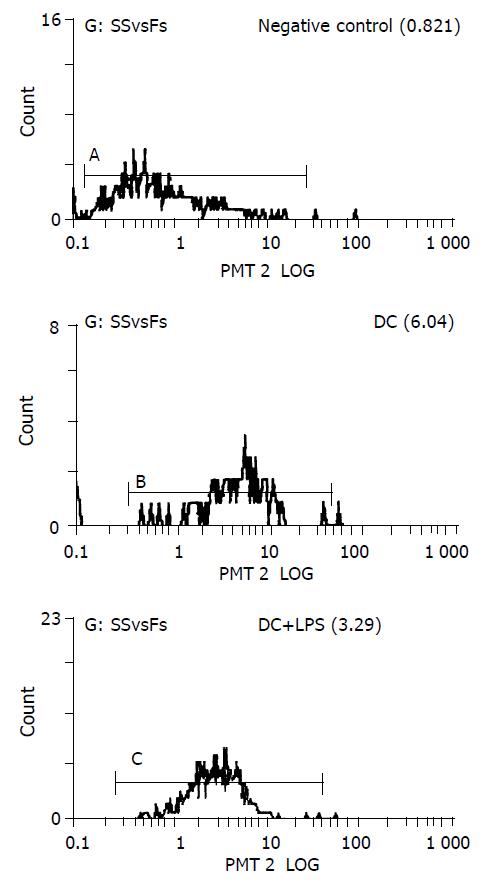
1.2.4 DC表面Fas-L表达 常规法诱导DC, 分为两组, 一组于诱导7 d加入LPS 10 g/L, 一组不加, 37 °C含50 mL/L CO2的培养箱中培养24 h, PBS洗涤2次, 用40 g/L多聚甲醛4 °C固定30 min, PBS洗涤2次, 加入兔抗人Fas-L多克隆抗体100 mL, 4 °C 120 min, PBS洗涤2次, 加入羊抗兔-FITC二抗100 mL, 以正常人淋巴细胞作阴性对照, 4 °C 120 min, PBS洗涤2次, 流式细胞术检测淋巴细胞表面Fas-L表达.
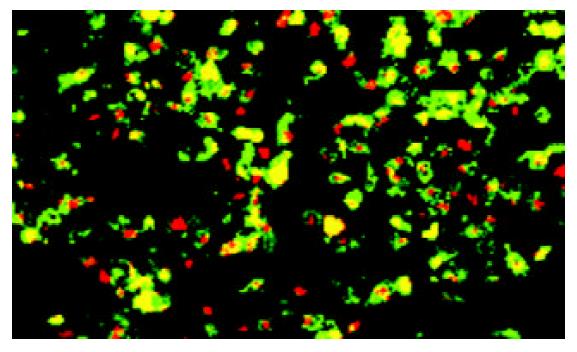
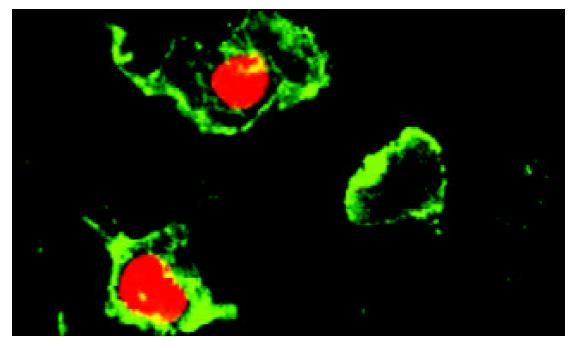
对数生长期的肝癌细胞SMMC-7721经放线菌素-D 10 g/L处理 24 h, 激光共聚焦显微镜观察, 观察早期, 主要为绿色荧光, 随着观察时间的延长, 大部分细胞出现红色和绿色两种荧光(图1, 2).
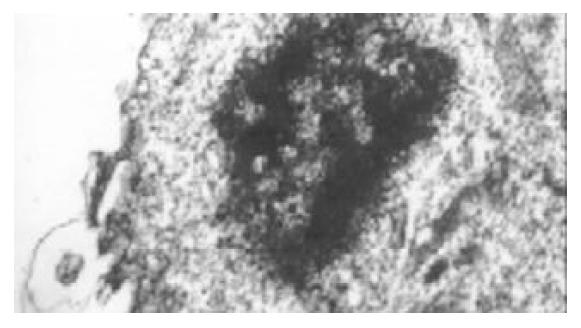
将凋亡的肝癌细胞和DC共同培养后, 透射电子显微镜观察发现, DC伸出伪足捕捉凋亡的肝癌细胞及其碎片, 有的DC胞质中可见电子密度较高的物质, 推测可能为吞噬的凋亡肝癌细胞及其碎片(图3).
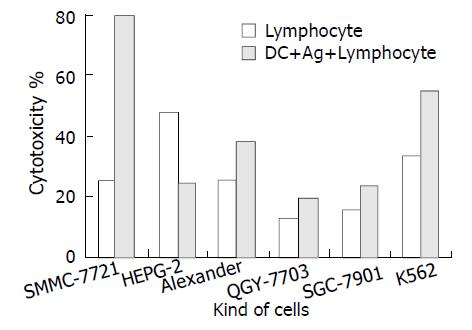
负载凋亡肝癌细胞DC活化的CTL细胞( 效靶比6:1-1.5:1)对各种肝癌细胞均有不同程度的杀伤作用(图4, 效靶比6:1), 杀伤效果明显高于非特异性淋巴细胞对照.
效靶比为1:1时, 诱导7 d的DC对4种肝癌细胞和胃癌细胞均有不同程度抑制作用(抑制率22.8-49.2 %), 但不抑制正常人二倍体细胞生长. 加入LPS后, DC对4种肝癌细胞和胃癌细胞的抑制减弱. 随着效靶比增加为2.5:1, 5:1和10:1时, 诱导7 d的DC对肝癌细胞和胃癌细胞的抑制作用逐渐增加(图5).
流式细胞术检测DC表面Fas-L表达, 结果表明经LPS作用后, DC表面Fas-L的表达略低于诱导7 d未处理DC, 平均荧光强度分别为3.29和6.04(N =3, 图6 ).
DC在成为有效抗原呈递细胞之前必须经历一个成熟过程. 研究表明, 未成熟的DC可吞噬凋亡和坏死的肿瘤细胞, 而只有坏死肿瘤细胞才可诱导DC的成熟. 成熟DC表达DC特异性标志CD83、与溶酶体相连的膜糖蛋白(LAMP)、及共刺激分子CD40和CD86, 并可激活CD4+T和CD8+T细胞. 非成熟DC吞噬ACTS, 并与MHCI、II类分子相结合, 在坏死肿瘤细胞或其培养上清, 或标准的促成熟分子(IL-6, IL-1P, TNF-α, PGE2)和单核细胞条件培养基(MCM)提供的成熟信号作用下成熟, 此DC称为交叉呈递DC(cross presenting DC, CPDC), CPDC将肿瘤肽提呈给T细胞, 以激发免疫应答[9].
非成熟HLA-A2+DC负载凋亡的HLA-A2-, MEL-397黑色素瘤细胞, 不能诱导DC的成熟, 在IL-6, IL-1B, TNF-α, PGE2作用下负载凋亡MEL-397的DC自然成熟. 经CPDC作用后产生的自身CD8+ CTL经源于MelanA/MART1 和MAGE-3 (被MEL397细胞表达)HLA-A2结合肽刺激后可产生肿瘤坏死因子(TNF); 经酪氨酸酶HLA-A2结合肽(MEL-397不表达)刺激后不产生TNF, 用CPDC产生的CTL可有效溶解HLA-A2+ MEL-256黑色素瘤细胞, 而非成熟DC与肽产生的CTL几乎无溶解能力. 预示: 负载凋亡黑色素瘤细胞的成熟DC可成为黑色素瘤治疗的另一手段 [10]. 用IV期黑色素瘤患者外周血DC负载经放线菌素D处理24 h的自身凋亡肿瘤细胞, 在含60 KU/L IL-2的培养基中, 用负载黑色素瘤凋亡小体(MABS)的DC每周诱导一次, 诱导3次后产生的效应T细胞可分泌高水平的IFN-r(ELISPOT), 镜检证实DC吞噬有MABS, 此T细胞为Th1型[11]. 用HLA-A2+健康志愿者外周血中非成熟DC负载头颈部鳞状细胞癌PCI-13 细胞ATCS, 非成熟DC和ATCS作用后2-18 h用流式细胞术和共聚焦显微镜可检测到ATCS被非成熟DC摄取, 当非成熟DC在细胞因子作用下成熟后, 其摄取ATCS的能力下降. 负载ATCS的DC诱导CD8+CTL的能力远远强于单独肿瘤细胞或负载肿瘤细胞的DC[6].
以上述理论和实验为基础, 我们用DC负载凋亡的肝癌细胞, 在体外诱导自身淋巴细胞使其活化为肝癌特异性T细胞, 活化后的CTL细胞分泌较高水平的Th1型细胞因子IL-12和TNF, 并表现出较高的杀伤活性, 对NK 细胞敏感的靶细胞慢性髓原性白血病细胞K562 也有较强的杀伤作用, 提示此CTL同时具备NK特征. 预示用DC负载凋亡的肝癌细胞对原发性肝癌的研究和治疗也具潜在应用价值. 我们认为, 负载调亡肝癌细胞的DC最终通过激发机体的免疫系统, 诱导机体产生肝癌特异性CTL而发挥作用. 以此作为主线, 至少联合3种以上机制, 抑制杀伤肝癌细胞. 首先, DC通过吞噬和Fas/Fas-L途径, 抑制肝癌细胞的生长; 其次, 负载调亡肝癌细胞的DC诱发的CTL识别并杀伤部分肝癌细胞; 再次, 肝癌特异性CTL分泌的IFN-g、IFN-a等细胞因子, 以非杀伤性方式直接或间接地抑制肝癌细胞生长繁殖. 上述三种机制相辅相成, 互为条件, 共同发挥作用.
| 1. | Mailliard RB, Dallal RM, Son YI, Lotze MT. Dendritic cells promote T-cell survival or death depending upon their maturation state and presentation of antigen. Immunol Invest. 2000;29:177-185. [DOI] |
| 2. | Ninomiya T, Akbar SM, Masumoto T, Horiike N, Onji M. Dendritic cells with immature phenotype and defective function in the peripheral blood from patients with hepatocellular carcinoma. J Hepatol. 1999;31:323-331. [DOI] |
| 3. | 许 化溪, 王 胜军, 潘 志超, 严 俊, 臧 磊, 马 斌, 邵 启祥, 李 娜, 刘 恭植. 人树突状细胞单克隆抗体的制备及其生物学应用. 中华医学杂志. 1999;79:195-196. |
| 4. | Aden DP, Fogel A, Plotkin S, Damjanov I, Knowles BB. Controlled synthesis of HBsAg in a differentiated human liver carcinoma-derived cell line. Nature. 1979;282:615-616. [DOI] |
| 5. | Alexander JJ, Bey EM, Geddes EW, Lecatsas G. Establishment of continuously of growing cell line from primary carcinoma of the liver. S Afr Med J. 1976;50:2124-2128. |
| 6. | Hoffmann TK, Meidenbauer N, Dworacki G, Kanaya H, Whiteside TL. Generation of tumor-specific T-lymphocytes by cross-priming with human dendritic cells ingesting apoptotic tumor cells. Cancer Research. 2000;60:3542-3549. |
| 8. | Chapoval A, Tamada K, Chen L. In vitro growth inhibition of a broad spectrum of tumor cell lines by activated human dendritic cells. Blood. 2000;95:2346-2351. |
| 9. | Sauter B, Albert ML, Francisco L, Larsson M, Somersan S, Bhardwaj N. Consequences of cell death: exposure to necrotic tumor cells, but not primary tissue cells or apoptotic cells, induces the maturation of immunostimulatory dendritic cells. J Exp Med. 2000;191:423-434. [DOI] |
| 10. | Jenne L, Arrighi JF, Jonuleit H, Saurat JH, Hauser C. Dendritic cells containing apoptotic melanoma cells prime human CD8+ T cells for efficient tumor cell lysis. Cancer Res. 2000;60:4446-4452. |
| 11. | Chang JW, Peng M, Vaquerano JE, Zhou YM, Clinton RA, Hyun WC, Giedlin MA, Leong SP. Induction of Th1 response by dendritic cells pulsed with autologous melanoma apoptotic bodies. Anticancer Res. 2000;20:1329-1336. |