修回日期: 2002-08-20
接受日期: 2002-09-13
在线出版日期: 2003-07-15
了解P53基因突变与VEGF在大鼠实验性胃癌中的表达及中药胃康宁的防治作用.
Wistar♂大白鼠, 2-3月龄, 体重120-140 g, 用MNNG限期饲饮法诱导大鼠发生胃腺癌, 设对照组, 胃康宁1组、2组, 用光镜、电镜观察大鼠胃黏膜细胞形态, 用免疫组化法检测突变型P53及VEGF表达.
与对照组比较, 胃康宁组大鼠胃黏膜细胞异形性、核浓染、核浆比增大等恶性表型轻微, 能降低突变型P53蛋白表达(3.4905±1.5225), 和VEGF表达(3.519±2.204), (P<0.001).
以MNNG诱导大鼠实验性胃癌的发生与P53基因突变及VEGF高表达有关, 中药胃康宁具有良好的防治作用, 能显著抑制P53蛋白和VEGF表达.
引文著录: 李庆明, 余谦, 闵存云. P53突变与VEGF在大鼠胃癌中的表达及中药胃康宁的防治作用. 世界华人消化杂志 2003; 11(7): 997-1000
Revised: August 20, 2002
Accepted: September 13, 2002
Published online: July 15, 2003
To study the expression of P53 gene mutation and VEGF in rats with experimental gastric cancer and the preventing effects of decoction Weikang-ning(WKN).
Male Wistar rats aged 2-3month (weight 120-140 g) were fed with MNNG to induce gastric adenocarcinoma. Rats were divided into control group, WKN group 1 and 2. The morphology of gastric mucous were observed by light microscope and electric microscope. Expression of mutant P53and VEGF were studied with immunohistochemistry.
The malignancy phenotype of stomach epithelial cell such as heteromorphism, heteropyknosis and increased nucleus plasma ratio in rats of WKN group were slightly less severe than that in control group, also the expressed mutant P53 protein (3.4905±1.5225) and VEGF (3.519±2.204) in WKN group were decreased (P<0.01) significantly.
The development of experimental gastric cancer by WKN in rats is associated with high expression of P53 and VEGF. The decoction WKN suppresses the expression P53 and VEGF and thus has the preventive and therapeutic effects on gastric cancer.
- Citation: Li QM, Yu Q, Min CY. Expression of mutant P53 and VEGF in experimental gastric cancer in rats and the effect of decoction Weikang-ning. Shijie Huaren Xiaohua Zazhi 2003; 11(7): 997-1000
- URL: https://www.wjgnet.com/1009-3079/full/v11/i7/997.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i7.997
胃癌的发病率和死亡率, 在我国的恶性肿瘤中占第一位, 是严重影响人类生命健康的恶性肿瘤. 在胃癌的发生、发展过程中, 原癌基因的激活与抑癌基因的失活以及一些相关的分子对胃癌生物学行为起着重要的作用. 本文研究了P53突变与血管内皮细胞生长因子(VEGF)在大鼠实验性胃癌中的表达, 及中药胃康宁的防治作用, 为探讨P53与VEGF在胃癌发生发展过程中的作用及中药胃康宁的防治效果.
链霉菌抗生物素蛋白-过氧化酶免疫组化染色试剂盒(加强型)系福州迈新生物技术开发公司产品, 第一抗体来源: Broad Spectrum; 产品编号: Cat. No: Kit-9710/9720/9730. 德国 KONTRON IBAS2.5版本全自动分析系统, 德国ZEISS AXIOTRON研究型显微镜, 物镜×20. 图像输入: 日本JVCKy-F30B 3-CCD彩色摄入仪. 实验动物由中山医科大学实验动物中心提供♂Wistar大白鼠50只, 2-3月龄, 体重120-140 g, 清洁级.
1.2.1 大鼠实验性胃癌造模方法 采用甲基硝基亚硝基胍(MNNG)限期给药饲饮法, 予♂健康Wistar大白鼠每日自由饮用浓度为100 μg/ml的MNNG水溶液24 wk, 再予饮用自来水16 wk, 实验时间共计40 wk.
1.2.2 中药胃康宁配制 由党参、半枝莲、五灵脂等组成. 制成每ml含生药1 g浓度的制剂, 加防腐剂苯甲酸(0.1 g/100 ml)、4 ℃冷藏保存, 供大鼠灌胃之用. 功效: 健脾化痰、清热解毒、理气活血、消瘀散结.
1.2.3 实验分组及给药方法 (1)对照组20只, MNNG限期给药饲饮法. (2)胃康宁1组15只, MNNG限期给药饲饮法, 加全程40 wk每日灌用10 g生药/kg体重的胃康宁. (3)胃康宁2组15只, MNNG限期给药饲饮法, 加后16 wk每日灌用10 g生药/kg体重的胃康宁.
1.2.4 取材方法 饲养期第40周末处死全部大鼠并取材. 即时另购♂健康Wistar大白鼠2只, 4月龄, 体重200 g左右, 作正常对照. 先予灌注固定, 经左心室穿刺至主动脉, 用生理盐水100 ml快冲血管床, 用含4%多聚甲醛的0.1 mol/L的磷酸缓冲液(PH7.4, 4 ℃)经升主动脉灌注, 时间约1 h. 剖腹取胃, 沿胃大弯切开, 生理盐水洗净, 剪除前胃, 将腺胃展平, 暴露黏膜面, 进行观察; 在有颜色异常和粟粒状结节处, 则连同周围组织行条形切割, 大小约152 mm, 可取多条组织, 分置两处, 置于2.5%戊二醛(PBS液配制)4 ℃固定1-2 h, 送电镜室行透射电镜检查; 置于4%多聚甲醛固定12 h, 再入20%蔗糖PBS液24 h, 取出, 石蜡包埋, 切片后行病理检查(HE染色)P53及VEGF检测(免疫组化法).
1.2.5 VEGF表达检测 采用免疫组化法, 染色程序, 按试剂盒说明进行. 结果判定: 以细胞质呈现明确的棕黄色颗粒状染色为阳性反应, 并以此为目标进行真彩色图像分析处理, 获得定量数据.
1.2.6 突变型P53蛋白表达检测 采用免疫组化法, 染色程序, 按试剂盒说明进行. 结果判定: 以细胞核呈现明确的棕黄色颗粒状染色为阳性反应. 定量方法同VEGF检测.
统计学处理 采用方差分析、两两比较法, 由中山医科大学统计学教研室采用SPSS for Windows 7.0版统计软件进行.
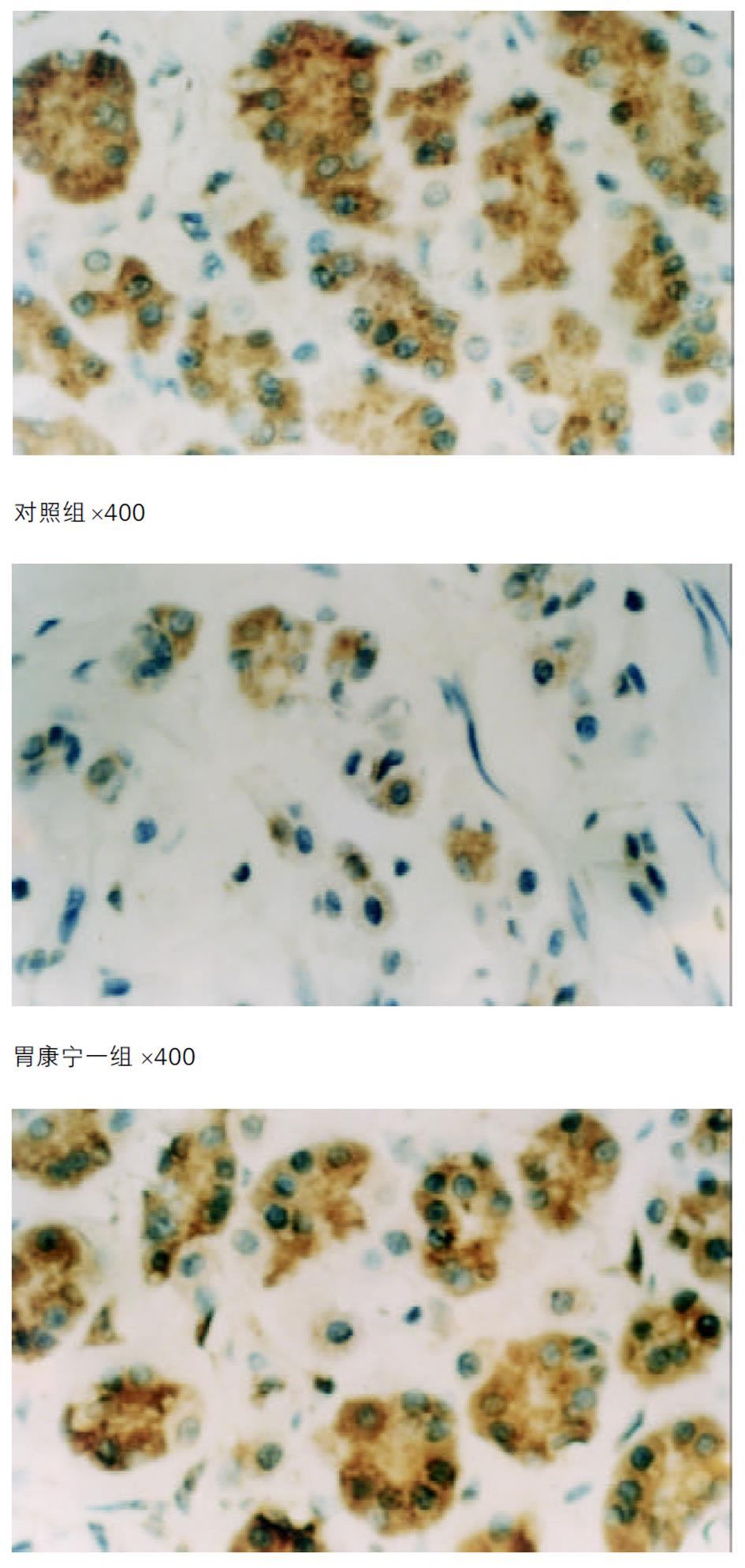
对照组大鼠胃黏膜面的颜色异常和粟粒状结节较为多见; 胃康宁2组黏膜面亦有颜色异常和粟粒状结节, 但较不多见; 胃康宁1组黏膜面未见有粟粒状结节, 颜色异常少见(表1).
正常大鼠胃黏膜上皮细胞连接完整, 腺管排列整齐; 上皮细胞圆形, 大小正常; 细胞核圆形, 染色正常; 核浆比正常. 胃康宁1组大鼠胃黏膜上皮细胞连接比较完整, 腺管排列整齐; 上皮细胞圆形, 大小正常; 细胞核圆形, 染色正常; 核浆比正常. 胃康宁2组大鼠胃黏膜上皮细胞连接比较完整, 腺管排列比较整齐; 上皮细胞圆形, 大小接近正常; 细胞核圆形, 染色基本正常; 核浆比基本正常. 对照组大鼠胃黏膜上皮细胞连接缺如, 腺管排列紊乱; 上皮细胞大小形状不一; 细胞核异形性, 胞核浓染; 核浆比增大.
胃康宁1组大鼠胃黏膜组织中, 细胞数量少, 腺腔完整, 细胞分化良好, 偶见未分化细胞, 呈现细胞凋亡改变. 胃康宁2组大鼠胃黏膜组织中细胞量较多, 核异形性. 对照组大鼠胃黏膜组织中细胞数明显增多, 细胞小, 分化程度低, 核浓染, 核异形性, 腺腔不明显, 细胞排列不规整, 形态各异.
胃康宁1组和胃康宁2组的P53表达量均较对照组明显减少, 有非常显著性差异(P<0.001); 胃康宁1组的P53表达量亦较胃康宁2组明显减少, 且有显著性差异(P<0.05). 表明胃康宁具有显著抑制P53异常表达(图1, 表2).
根据祖国医学理论, 胃癌的发生与气郁、痰积、脾虚、瘀毒等病理因素密切相关的认识, 采用健脾化痰、清热解毒、理气活血、消瘀散结的方法防治胃癌, 取得一定疗效, 但仍有许多问题尚需进一步研究[1-6]. 本实验采用MNNG饲喂Wistar♂大鼠诱导生成胃腺癌, 经病理切片检查, 符合癌变特征[7]. 通过本实验, 从病理检查及电镜检查表明, 胃康宁具有防治MNNG诱导的大鼠胃黏膜组织细胞恶性表型的作用. 同时通过免疫组化技术检测, 胃康宁对大鼠实验性胃癌突变型P53基因VEGF的表达均有明显抑制作用.
在胃癌的发生、发展过程中, 原癌基因的激活与抑癌基因的失活以及一些相关的分子对胃癌生物学行为起着重要的作用[8-11]. P53在多种肿瘤中有50%存在P53基因突变, 在癌的病变中也倍受重视[12-14], 通过PCR-SSCP等方法, 研究发现25例原发性胃癌中48%存在P53基因突变. 突变的P53蛋白可通过"负显性效应"阻碍野生型P53基因的抑制生长功能, 突变型P53蛋白与野生型P53蛋白结合形成几乎没有结合DNA能力的寡聚蛋白复合物, 从而不能控制这些位点的基因转录, 这些位点可能包括抑制细胞或癌变的基因, 这样突变型P53蛋白将导致肿瘤进一步生长. 且P53在本病的发生、发展中与P16, P21, nm23, hTRT等基因及相关分子有密切的关系[15-17]. 甚至与幽门螺杆菌的感染也有一定的关系[19-21]. 而且用于治疗胃癌的药物对P53的表达具有调控作用[22,23]. 本研究结果显示在对照组P53呈高表达, 表明在致癌因素MNNG长期饲喂条件下, 胃黏膜组织细胞中P53基因已发生突变, 产生致癌效应, 使大鼠发生胃癌.
血管内皮细胞生长因子(VEGF)是一种促血管生长因子, 对原位肿瘤的形成和生长以及转移瘤的形成中起着十分重要的作用. 消化道肿瘤、膀胱癌、造血系统肿瘤、胶质细胞瘤等都存在VEGFmRNA及蛋白的过度表达[24-27]. VEGF表达与胃癌的浸润转移有关[28-30]. 在肿瘤生长过程中, 血浆蛋白(如纤维蛋白原和纤溶酶原)从高渗透性的血管中外渗并凝固, 形成纵横交错的纤维蛋白胶滞体, 纤维蛋白胶滞体为肿瘤细胞或炎症细胞和从邻近结缔组织来的再生血管提供暂时性基质, 这种暂时基质最终降解并转化成胶原结缔组织, 将无限地维持肿瘤的生长[31]. 血管内皮细胞的表面存在着VEGF受体, VEGF通过与VEGF受体结合而诱导血管内皮细胞的增生. 还通过其他机制参与血管形成[32]. VEGF的表达受到基因水平的调控, 阻断VEGF与VEGF受体的结合及VEGF的信号转导, 便可抑制VEGF的生理功能, 从而抑制肿瘤的形成[33]. 此外, VEGF与P53突变有密切关系, P53基因突变可以下调抑制血管增生的凝血酶反应素-1(TSP-1)和上调促进血管增生的VEGF, 因而成为调控肿瘤血管生长的重要因素[34]. Kondo et al[35]也发现突变型P53可诱导VEGF表达. 本研究结果在对照组(造模组)突变型P53、VEGF呈高表达, 显示了P53基因突变与VEGF在胃癌发生、发展过程中的重要作用. 而在用药组(1组与2组)P53、VEGF均呈低表达, 表明胃康宁可阻止P53基因突变和抑制VEGF而防治胃癌的发展浸润过程.
| 2. | Guo WJ, Yu EX. Evaluation of combined therapy with chemoembolization and irradiation for largehepatocellular carcinoma. Br J Radiol. 2000;73:1091-1097. [PubMed] [DOI] |
| 3. | 赵 群, 李 勇, 王 力利, 焦 志凯, 刘 冀红, 马 志学, 刘 品一, 于 跃明, 范 立侨. 参芪扶正注射液对胃癌患者手术及化疗时免疫功能的影响. 中国中西医结合杂志. 2001;21:424-426. |
| 8. | Wang YK, Ji XL, Ma NX. nm23 expression in gastric carcinoma and its relationship withlymphoproliferation. World J Gastroenterol. 1999;5:87-89. [DOI] |
| 18. | Sasano H, Date F, Imatania A, Asaki S, Nagura H. Double immunostaining of c-erbB-2 and P53 in human stomach cancer cells. Human Pathol. 1993;24:584-589. [DOI] |
| 19. | 郭 长青, 王 玉萍, 刘 国永, 马 社旺, 丁 贯一, 李 继昌. 胃黏膜癌变过程中的幽门螺杆菌感染与p53, c-erbB-2基因表达的研究. 世界华人消化杂志. 1999;7:313-315. |
| 23. | 吴 金莺, 周 晓峰, 姜 文霞, 王 君利, 杨 凡, 蔡 宣松, 张 志刚. 肿瘤化疗药物对胃癌细腻Bcl-2, p53和Ki-67表达的影响. 世界华人消化杂志. 1999;7:589. |
| 24. | Brown L, Berse B, Jackman RW, Tognazzi K, Guidi AJ, Dvorak HF, Senger DR, Connolly JL, Schnitt SJ. Expression of vascular permeability factor (vascular endothelial growth factor)and its receptors in brestcancer. Hum Pathol. 1995;26:86-91. [DOI] |
| 31. | 李 健, 牛 正先, 王 立东. 血管内皮生长因(VEGF)与肿瘤微环境. 国外医学临床生物化学与检验学分册. 1997;18:231. |
| 32. | Brock TA, Dvorak HF, Senger DR. Tumor-secreted vascular permeability factor increases cytosolic Ca2+ and von Willebrand factor release in human endothelial cells. Am J Pathol. 1995;138:213-221. |
| 33. | Hu DE, Fan TP. Suppression of VEGF-induced angiogenesis by the protein tyrosine kinase inhibitor, lavendustin A. Br J Pharmacol. 1995;114:262-268. [DOI] |