修回日期: 2003-02-20
接受日期: 2003-03-21
在线出版日期: 2003-07-15
了解丙型肝炎病毒核心蛋白和NIP3基因的表达的关系, 研究HCV核心蛋白在HCV致病的分子生物学机制中的作用.
聚合酶链反应(PCR)扩增NIP3基因启动子, 以T-A克隆法, 将NIPP基因片段连入载体pGEM-T.获得的质粒pT-NIPP, 和报告质粒pCAT3-basic分别用SacI和BglII双酶切后构建报告载体pCAT3-NIPP, 分别以重组报告载体pCAT3-NIPP和pcDNA3.1(-)-core应用FuGENE 6转染试剂瞬时转染NIH3T3细胞, 以转染pCAT3 basic的HepG2细胞为阴性对照, 48 h后收获细胞. 应用酶联免疫黏附方法(ELISA)检测细胞中氯霉素乙酰转移酶(CAT)的表达活性, 以了解HCV核心蛋白对NIP3基因启动子的反式激活作用.
构建的表达载体pcDNA3.1(-)-core和报告载体pCAT3-NIPP经过序列分析和酶切鉴定正确. pCAT3-NIPP和pcDNA3.1(-)-core瞬时转染的NIH3T3细胞中的CAT表达活性为pCAT3-NIPP的1.9倍, 是pCAT3 basic的3.6倍, 明显升高.
丙型肝炎病毒核心蛋白可反式激活NIP3基因启动子, 进而上调NIP3基因的表达.
引文著录: 王建军, 刘妍, 成军, 杨倩, 杨艳杰. 丙型肝炎病毒核心蛋白上调NIP3基因表达研究. 世界华人消化杂志 2003; 11(7): 951-954
Revised: February 20, 2003
Accepted: March 21, 2003
Published online: July 15, 2003
To investigate the transactivating effect of HCV core protein on NIP3 gene and the molecular biological mechanisms of HCV core protein in HCV pathogenicity.
Polymerase chain reaction (PCR) technique was employed to amplify the sequence of NIP3 promoter from HepG2 genomic DNA, and the product was cloned into pGEM-T vector. The NIPP gene was cut from T- NIPP by SacI and Bgl, and then was cloned into pCAT3 basic, named pCAT3-NIPP. pCAT3-NIPP was transfected into the NIH3T3 cell line and cotransfected NIH3T3 cells with pcDNA3.1(-)-core by FuGENE 6 transfection reagents. The NIH3T3 cells transfected with pCAT3-basic as negative control. The activity of CAT in NIH3T3 cells transfected was detected by an ELISA kit after 48 hours, which reflect the transactivating function of HCV core protein to NIP3 gene promoter.
The expressive vector pcDNA3.1(-)-core and report vector pCAT3-NIPP have been constructed and confirmed by restriction enzyme digestion and sequencing.The expression of CAT in NIH3T3 cells transfected with pCAT3-NIPP and pcDNA3.1(-)-core was 3.6 times as higher as that of pCAT3-basic, and 1.9 times as higher as that of pCAT3-NIPP.
It is suggested that HCV core protein can transactivate NIP3 gene promoter and upregulate the expression of NIP3 gene.
- Citation: Wang JJ, Liu Y, Cheng J, Yang Q, Yang YJ. Upregulating effect of hepatitis C virus core protein on NIP3 gene. Shijie Huaren Xiaohua Zazhi 2003; 11(7): 951-954
- URL: https://www.wjgnet.com/1009-3079/full/v11/i7/951.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i7.951
丙型肝炎病毒(HCV)基因组含有单一的开放读码框架, 编码3010-3033个氨基酸残基的多肽前体, 两侧是5'-非翻译区及3'-非翻译区. 多肽前体至少被加工为十种结构蛋白和非结构蛋白, 其中核心区(1-573 nt)编码的21 kDa HCV核衣壳蛋白(191 aa)是一种多功能蛋白质, 在HCV致病过程中可能起着重要的作用[1-5], 最近研究其与HCV感染后脂肪肝的形成也有一定关系[6-8]. 本研究采用基因重组技术构建pCAT3-NIPP、pcDNA3.1(-)-core报告基因载体, 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 测得下游CAT基因的表达增强. 证明HCV核心蛋白可上调NIP3启动子活性, 进而上调NIP3基因的表达, 从而为研究HCV致病的分子生物学机制提供了证据.
(1)菌种及细胞株: 重组表达载体pcDNA3.1(-)-core为本室构建, 人肝母细胞瘤细胞系Hep G2细胞及大肠杆菌JM109菌株为本室保存. (2)工具酶: Tag DNA聚合酶、T4 DNA 连接酶及限制性内切酶均购自Takara公司. (3)试剂盒: 质粒DNA提取试剂盒, 中间载体pGEM-T及报告质粒pCAT3-basic均购自Promega公司; CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司.其他生化试剂购自Sigma公司.
以Hep G2细胞基因组DNA为模板, 设计引物. 在上下游引物的5'端分别引入XhoI和BglII单一酶切位点, PCR扩增包含NIPP基因启动子全序列的DNA片段, PCR产物经1%琼脂糖凝胶电泳, 切胶, 回收纯化.
以T-A克隆法, 用T4 DNA连接酶将NIPP基因片段连入载体pGEM-T. 将获得的质粒pT-NIPP, 和报告质粒pCAT3-basic分别用SacI和BglII双酶切后用T4 DNA连接酶进行定向连接, 产物转化JM109宿主菌, 筛选抗氨苄青霉素阳性菌落; 提取质粒, 再次双酶切及单酶切鉴定正向插入克隆, 命名为pCAT3-NIPP.
将pcDNA3.1(-)-core质粒分别进行EcoRI/BamHI双酶切和HindIII单酶切及PCR鉴定. PCR鉴定核心基因的上下游引物分别为: 5'-C GCA GAA TTC ATG AGC ACG AAT CCT AA-3', 5'-AT ATG GAT CCA GGC TGA AGC GGG CAC A-3'. 最后测序鉴定. DNA测序由上海博亚公司完成.
磁珠法提取质粒pCAT3-NIPP以备转染, 以标准方案培养NIH3T3细胞. 具体转染方法参照转染说明书进行. 转染48 h后收集细胞, 收集细胞裂解液, 用于CAT活性检测.
pcDNA3.1(-)-core与pCAT3-NIPP共转染Hep G2细胞, 同时以转染pCAT3-NIPP p的NIH3T3细胞作阴性对照.转染48 h后, 收集细胞裂解液, 用于CAT活性检测.所有实验严格平行操作.
按照试剂盒说明书进行. 取1.0ng/mL的CAT标准品(试剂盒提供)及细胞裂解液200 μl加入已包被抗体的96孔板中, 37 °C温育2 h, 再依次加入第一抗体(地高辛标记的抗-CAT)、第二抗体(偶联有过氧化物酶的地高辛抗体抗-DIG-POD) 200 μl 37 °C温育1 h后, 加入过氧化物酶的底物室温显色10-30 min.用酶标仪检测标本在415 nm波长的吸光度, 其数值反映细胞提取物中的CAT表达水平. 以未作转染的细胞裂解液平行实验作空白对照.
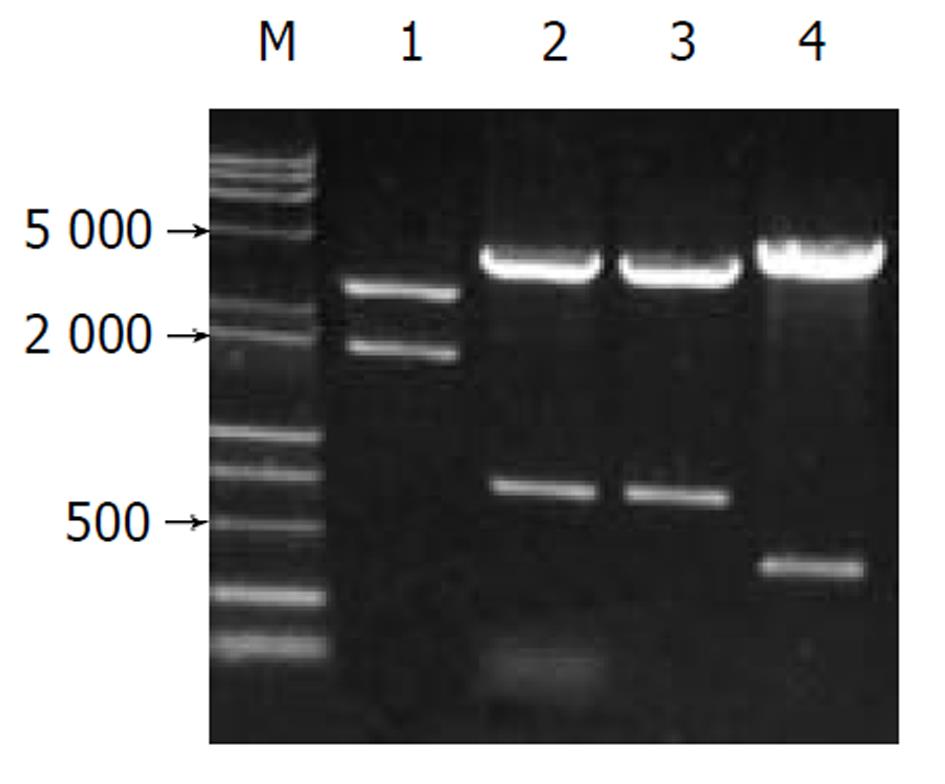
pCAT3- NIPP鉴定电泳图谱如图1所示, 构建的中间载体pT-NIPP以XhoI/ BglII双酶切电泳图谱为两条带: 1851 bp (NIPP基因片段)、3015 bp(pGEM-T空载体); DNA测序证实重组质粒含有1851 bp核苷酸的目的基因, 读码框架正确. 中间载体pT-NIPP以SacI/ BglII双酶切为两条带: 730 bp(NIPP基因片段)、4055 bp(pGEM-T空载体+一部分NIPP基因片段)重组质粒pCAT3-NIPP分别以SacI/BglII双酶切鉴定均显示730 bp正向插入条带. 以Pvu II单酶切可见419 bp和4313 bp两条带, 说明重组质粒pCAT3-NIPP构建正确.
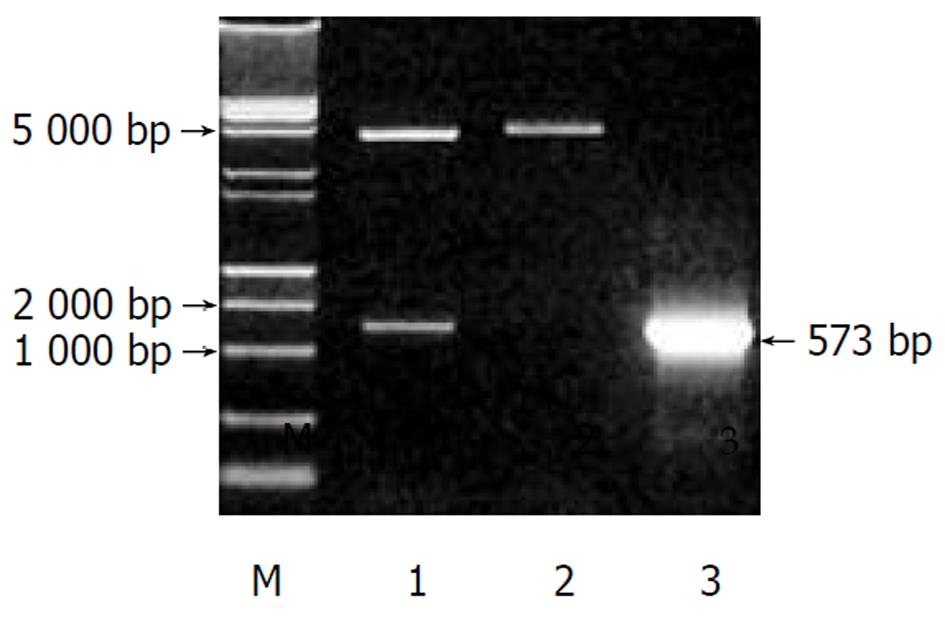
pcDNA3.1(-)-core鉴定电泳图谱如图2所示, 双酶切显示两条带(4900 bp空载体和573 bp HCV core基因片段), 单酶切为约5500 bp一条带(4900 bp+573 bp). 以pcDNA3.1(-)-core质粒作模板, PCR可见573 bp的产物. 测序证实该重组质粒读码框架正确.
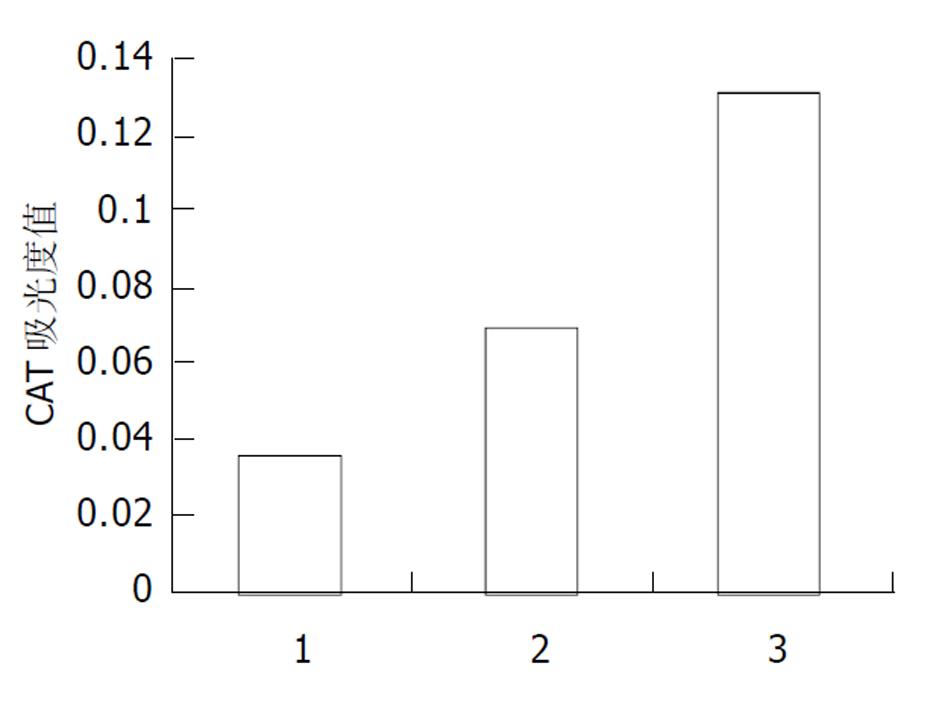
pcDNA3.1(-)-core与pCAT3-NIPP共转染实验结果空载体对照组pCAT3 basic的CAT的吸光度值为0.036, pCAT3-NIPP的CAT的吸光度值为0.069, 共转染pcDNA3.1(-)-core/pCAT3-NIPP的NIH3T3细胞CAT的吸光度值为0.131, 共转染pcDNA3.1(-)-core/ pCAT3-NIPP CAT的表达明显增强, 是CAT3空载体的3.6倍, 是pCAT3-Weep的1.8倍, 说明HCV核心蛋白对NIP3基因启动子有反式激活作用, 转录激活NIP3基因启动子的活性, 使其下游CAT基因的表达增强(图3).
尽管HCV发展为慢性感染的机制还是不很清楚, 感染HCV后较高比例的慢性化提示HCV可能有特定的机制可以绕开宿主的免疫反应. 细胞凋亡被认为是由宿主的CTL和NK细胞清除病毒的通常方式. 许多病毒基因组编码的蛋白可抑制细胞凋亡, 进而使病毒逃避宿主免疫系统的攻击[9], HCV核心蛋白除了作为核壳蛋白具有病毒颗粒组装功能外, 还具有多种调控细胞、病毒基因表达、细胞生长以及免疫调节等功能, 在HCV的致病过程中起重要作用. 关于他在细胞凋亡中的作用, 目前还有争议. 有研究显示HCV核心蛋白既可以抑制Fas-和TNF诱导的细胞凋亡作用, 又可以加强这种作用[10-13].Gross et al[14]应用转基因小鼠研究发现HCV核心蛋白通过Fas介导的细胞凋亡和外周血T细胞的肝浸润引起肝损伤. Chen et al[15]认为HCV核心蛋白可以抑制Fas介导的p38信号途径, 结果是加强了Fas介导的细胞死亡作用. 当然, 也有人认为在体内正常的内源性的TNF应答情况下, HCV核心蛋白既不能加强也不能抑制细胞凋亡作用[16].
细胞凋亡被抗细胞凋亡的Bcl-2家族蛋白和各种前凋亡蛋白的相互作用来调控, 这些前凋亡蛋白中也包括一些Bcl-2家族蛋白[17]. 有证据显示Bcl-2因子中前凋亡因子和抗凋亡因子的比例可以调节细胞在响应凋亡信号时线粒体的完整性的敏感性[18]. Nip3是一种线粒体蛋白, 在细胞内瞬时表达时可以诱导细胞凋亡, 并且可加强其他细胞死亡信号诱导的细胞凋亡[19]. Bcl-2可抑制Nip3的作用, 但作用时间短暂[20-22]. 亦有报道认为Nip3引起细胞坏死的作用较细胞凋亡作用更强[23]. Soguero et al[24]研究发现低氧可激活Nip3编码基因的表达, 进而导致在持续缺氧情况下细胞的程序性死亡. 腺病毒属的E1B19K结合蛋白B5可抑制Nip3基因诱导的细胞凋亡[25]. 近来研究发现HCV核心蛋白在通过加强Bcl-x的表达线粒体水平抑制细胞凋亡作用, 进而抑制胱冬肽酶 3激酶活性[26-28]. 也有人认为HCV核心蛋白是加强还是抑制细胞凋亡取决于凋亡诱导因子的刺激和细胞的环境[29].
本研究采用基因重组技术, 自NIP3基因上游自碱基ATG上推1 851个碱基, 以Hep G2细胞基因组DNA为模板, 设计引物. 在上下游引物的5'端分别引入XhoI和BglII单一酶切位点PCR扩增DNA片段, 与pGEM-T载体连接命名为T-NIPP. 以SacI和BglII酶切可能包含NIP3基因启动子全序列的731bp的DNA片段构建pCAT3-NIPP报告基因载体. 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 与pcDNA3.1(-)-core共转染NIH3T3细胞, 测得共转染pcDNA3.1(-)-core / pCAT3-NIPP CAT的表达明显增强, 是CAT3空载体的3.6倍, 是pCAT3-Weep的1.8倍, 说明HCV核心蛋白对NIP3基因启动子有反式激活作用, 转录激活Wee1基因启动子的活性.证明HCV核心蛋白可上调NIP3启动子活性, 进而上调NIP3基因的表达, 提示HCV核心蛋白可能有加强细胞凋亡的作用, 从而为研究HCV致病的分子生物学机制提供了证据.
| 2. | 姚 杰, 贾 战生. 丙型肝炎病毒E2包膜糖蛋白的研究近况. 国外医学. 流行病学传达室染病学分册. 2002;29:339-342. |
| 4. | 焦 成松, 周 永兴. 丙型肝炎病毒细胞模型研究进展. 国外医学流行病学传达室染病学分册. 2000;27:105-109. |
| 6. | 王 琳, 李 克, 成 军, 陆 荫英, 张 健, 洪 源, 刘 妍, 王 刚, 钟 彦伟, 段 惠娟. 丙型肝炎病毒核心蛋白与载脂蛋白A1结合的研究. 世界华人消化杂志. 2002;10:1018-1021. |
| 7. | 成 军, 任 进余, 李 莉, 陆 志檬, 李 克, 洪 源, 陆 荫英, 王 刚, 刘 妍, 张 玲霞. 丙型肝炎病毒结构基因转基因小鼠引起肝脏脂肪变. 世界华人消化杂志. 2002;10:1022-1026. |
| 10. | Hahn CS, Cho YG, Kang BS, Lester IM, Hahn YS. The HCV core protein acts as a positive regulator of fas-mediated apoptosis in a human lymphoblastoid T cell line. Virology. 2000;276:127-137. [PubMed] [DOI] |
| 11. | Honda A, Hatano M, Kohara M, Arai Y, Hartatik T, Moriyama T, Imawari M, Koike K, Yokosuka O, Shimotohno K. HCV-core protein accelerates recovery from the insensitivity of liver cells to Fas-mediated apoptosis induced by an injection of anti-Fas antibody in mice. J Hepatol. 2000;33:440-447. [DOI] |
| 12. | Rubbia-Brandt L, Taylor S, Gindre P, Quadri R, Abid K, Spahr L, Negro F. J PatholLack of in vivo blockade of Fas-and TNFR1-mediated hepatocyte apoptosis by the hepatitis C virus. J Pathol. 2002;197:617-623. [PubMed] [DOI] |
| 13. | Farooq M, Kim Y, Im S, Chung E, Hwang S, Sohn M, Kim M, Kim J. Cloning of BNIP3h, a member of proapoptotic BNIP3 family genes. Exp Mol Med. 2001;33:169-173. [PubMed] [DOI] |
| 14. | Gross A, McDonnell JM, Korsmeyer SJ. BCL-2 family members and the mitochondria in apoptosis. Genes Dev. 1999;13:1899-1911. [DOI] |
| 15. | Chen G, Cizeau J, Vande Velde C, Park JH, Bozek G, Bolton J, Shi L, Dubik D, Greenberg A. Nix and Nip3 form a subfamily of pro-apoptotic mitochondrial proteins. J Biol Chem. 1999;274:7-10. [PubMed] [DOI] |
| 16. | Chen G, Ray R, Dubik D, Shi L, Cizeau J, Bleackley RC, Saxena S, Gietz RD, Greenberg AH. The E1B 19K/Bcl-2-binding protein Nip3 is a dimeric mitochondrial protein that activates apoptosis. J Exp Med. 1997;186:1975-1983. [PubMed] [DOI] |
| 17. | Yasuda M, Theodorakis P, Subramanian T, Chinnadurai G. Adenovirus E1B-19K/BCL-2 interacting protein BNIP3 contains a BH3 domain and a mitochondrial targeting sequence. J Biol Chem. 1998;273:12415-12421. [PubMed] [DOI] |
| 18. | Sowter HM, Ratcliffe PJ, Watson P, Greenberg AH, Harris AL. HIF-1-dependent regulation of hypoxic induction of the cell death factors BNIP3and NIX in human tumors. Cancer Res. 2001;61:6669-6673. [PubMed] |
| 19. | Matsushima M, Fujiwara T, Takahashi E, Minaguchi T, Eguchi Y, Tsujimoto Y, Suzumori K, Nakamura Y. Isolation, mapping, and functional analysis of a novel human cDNA (BNIP3L) encoding a protein homologous to human NIP3. Genes Chro Cancer. 1998;21:230-235. [DOI] |
| 20. | Bruick RK. Expression of the gene encoding the proapoptotic Nip3 protein is induced by hypoxia. Proc Natl Acad Sci USA. 2000;97:9082-9087. [PubMed] [DOI] |
| 21. | Otsuka M, Kato N, Taniguchi H, Yoshida H, Goto T, Shiratori Y, Omata M. Hepatitis C virus core protein inhibits apoptosis via enhanced Bcl-xLexpression. Virology. 2002;296:84-93. [PubMed] [DOI] |
| 22. | Takamatsu M, Fujita T, Hotta H. Suppression of serum starvation-induced apoptosis by hepatitis C virus core protein. Kobe J Med Sci. 2001;47:97-112. [PubMed] |
| 23. | Zhu N, Khoshnan A, Schneider R, Matsumoto M, Dennert G, Ware C, Lai MM. Hepatitis C virus core protein binds to the cytoplasmic domain of tumor necrosis factor (TNF) receptor 1 and enhances TNF-induced apoptosis. J Virol. 1998;72:3691-3697. [PubMed] |
| 24. | Soguero C, Joo M, Chianese-Bullock KA, Nguyen DT, Tung K, Hahn YS. Hepatitis C virus core protein leads to immune suppression and liver damage in a transgenic murine model. J Virol. 2002;76:9345-9354. [PubMed] [DOI] |
| 25. | Ohi N, Tokunaga A, Tsunoda H, Nakano K, Harag uchi K, Oda K, Motoyama N, Nakajima T. A novel adenovirus E1B19K-binding protein B5 inhibits apoptosis induced by Nip3 by forming a heterodimer through the C-terminal hydrophobic region. Cell Death Differ. 1999;6:314-325. [PubMed] [DOI] |
| 26. | Yang SH, Lee CG, Lee CW, Choi EJ, Yoon SK, Ahn KS, Sung YC. Hepatitis C virus core inhibits the Fas-mediated p38 mitogen activated kinase signaling pathway in hepatocytes. Mol Cells. 2002;13:452-462. [PubMed] |
| 27. | Hahn CS, Cho YG, Kang BS, Lester IM, Hahn YS. The HCV core protein acts as a positive regulator of fas-mediated apoptosis in a human lymphoblastoid T cell line. Virology. 2000;276:127-137. [PubMed] [DOI] |
| 28. | Honda M, Kaneko S, Shimazaki T, Matsushita E, Kobayashi K, Ping LH, Zhang HC, Lemon SM. Hepatitis C virus core protein induces apoptosis and impairs cell-cycle regulation in stably transformed Chinese hamster ovary cells. Hepatology. 2000;31:1351-1359. [PubMed] [DOI] |