修回日期: 2002-01-20
接受日期: 2002-02-07
在线出版日期: 2003-07-15
研究"参臼胶囊"(SJ)诱导人肝癌SMMC-7721细胞凋亡的作用.
采用HE染色、透射电镜观察、原位末端标记技术(TUNEL)等方法, 观察SJ作用于SMMC-7721细胞后细胞形态的改变.
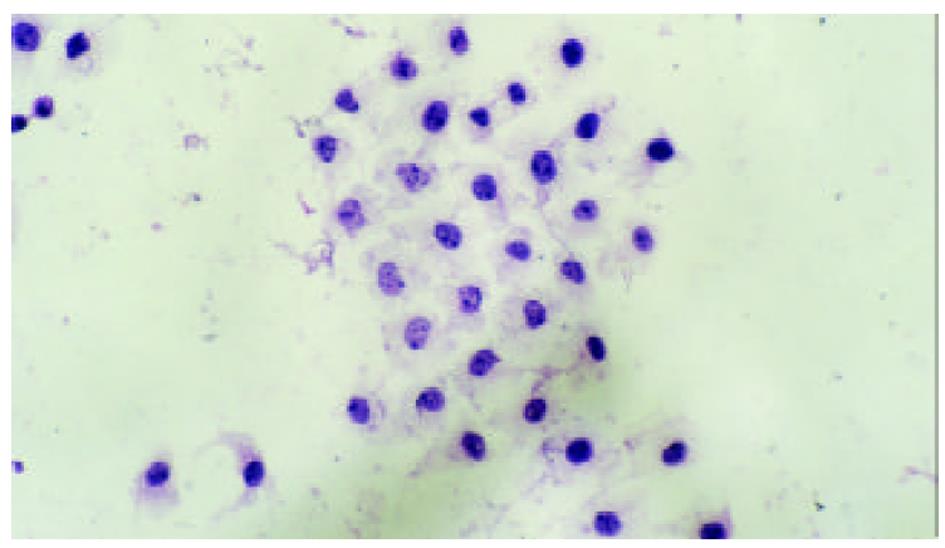
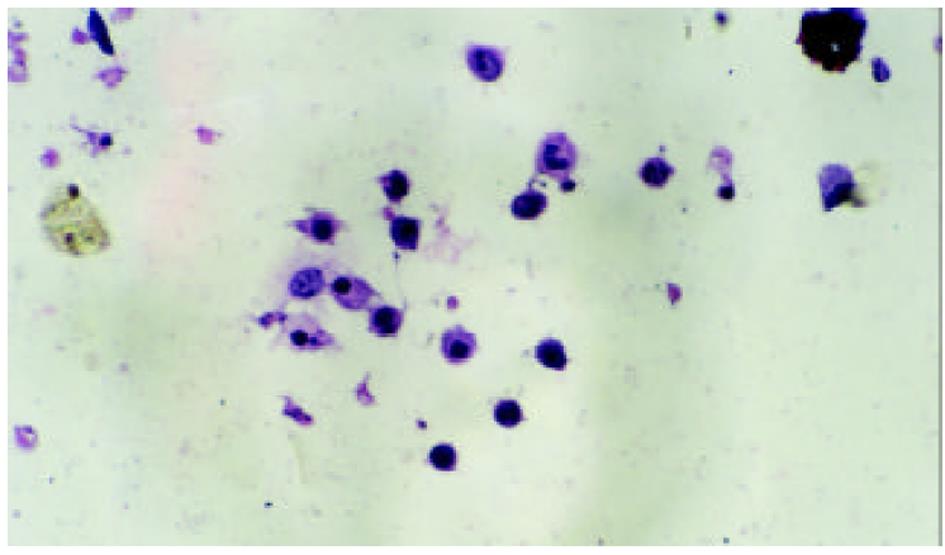
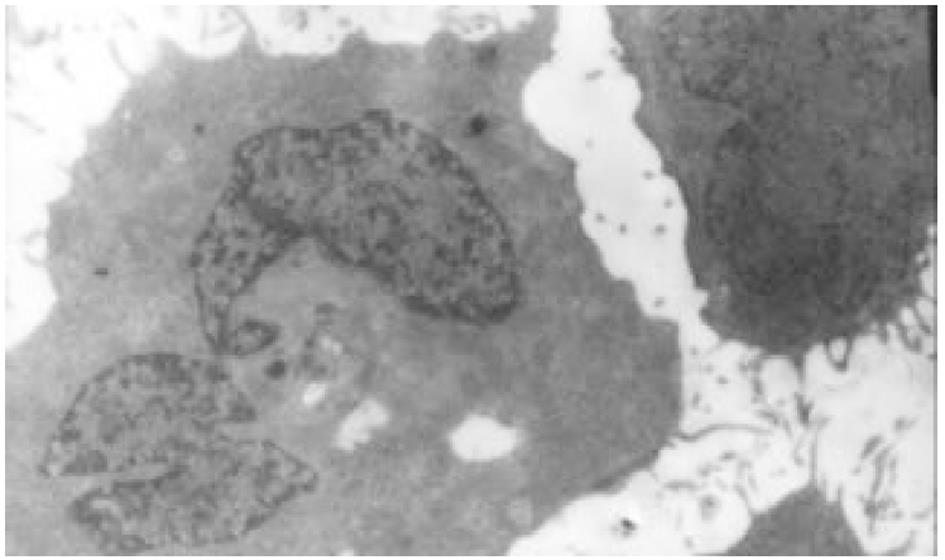
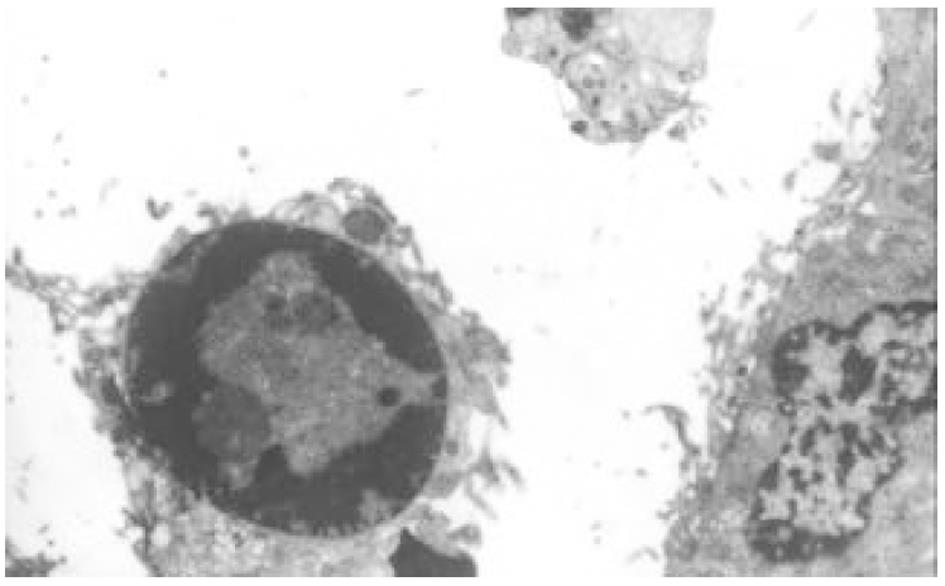
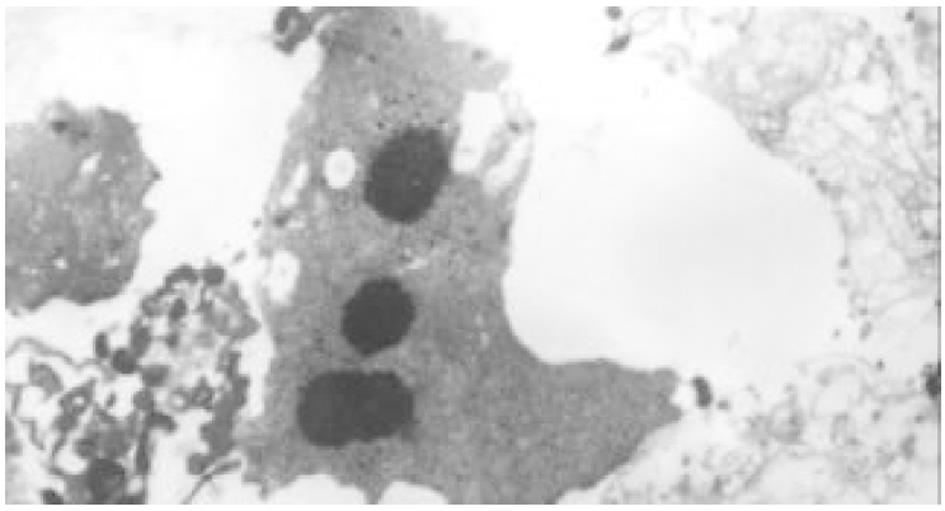
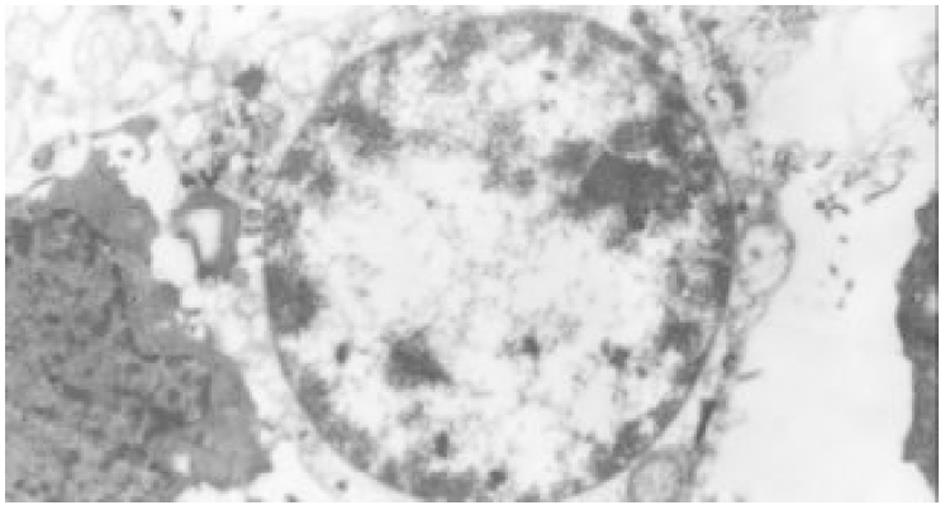
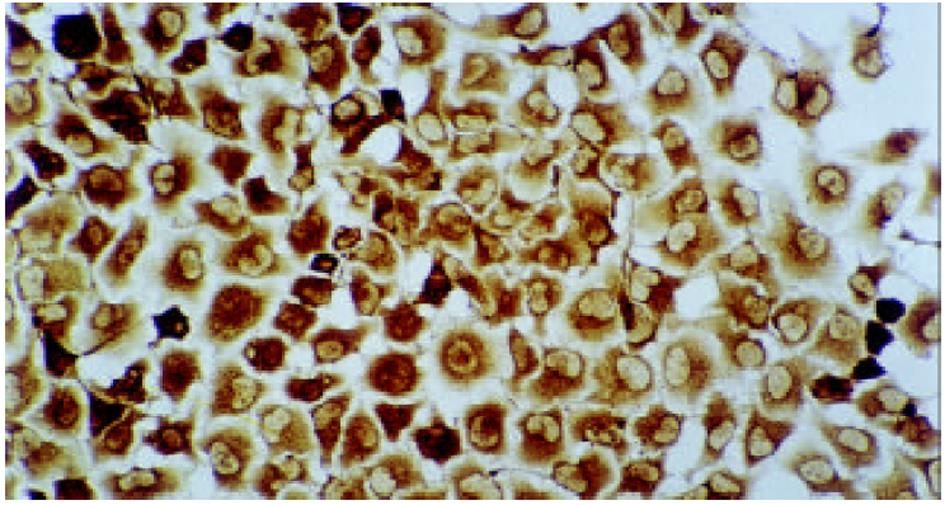
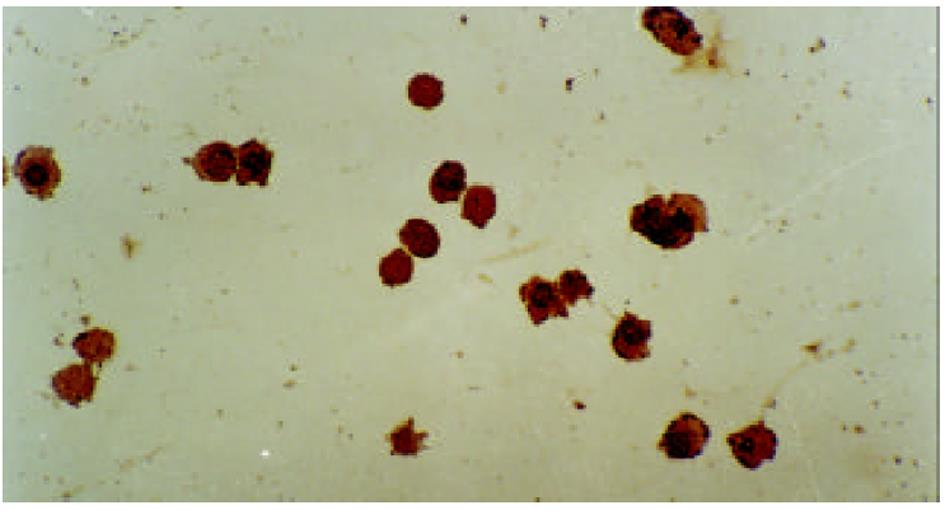
HE染色及透射电镜分别从微观、超微观水平观测肿瘤细胞经SJ作用后的形态学变化: 细胞变圆、缩小, 折光性增强, 细胞破碎, 经HE染色后, 细胞核呈兰黑色, 胞质呈淡红色, 细胞出现凋亡改变, 单个散在分布, 表现为核染色质致密浓缩, 核碎裂或核染色质断裂, 形成大小不等的凋亡小体, 证实10 μg/mL SJ作用SMMC-7721 48 h后细胞出现典型的凋亡征象; TUNEL法检测到发生在各期的凋亡细胞.
SJ可诱导SMMC-7721细胞凋亡, 可望作为一种新的细胞凋亡诱导剂用于肝癌的治疗.
引文著录: 吴苏冬, 刘长利, 王慧川, 鲍德虎. 参臼胶囊诱导肝癌SMMC-7721细胞凋亡. 世界华人消化杂志 2003; 11(7): 908-911
Revised: January 20, 2002
Accepted: February 7, 2002
Published online: July 15, 2003
To study the apoptosis of human liver cancer cell line SMMC-7721 induced by Senjiu Capsule.
Apoptosis was detected by HE staining, electron microscopy(TEM) and TdT-mediated dUTP-biotin nick end labeling(TUNEL).
SJ significantly inhibited the growth of SMMC-7721 cells and the inhibitory effect was positively related to the concentration and exposure time to SJ. And SJ could induce extensive apoptosis of SMMC-7721 cells. After exposure with 10 μg/ml SJ for 48 h, the cells showed classical morphological and biochemistry features of apoptosis under light microscope and electron microscope. Apoptosis cells in different phases were observed by TUNEL.
SJ significantly inhibited the growth of human cancer cells, but also induced extensive apoptosis. The apoptotic effect of SJ on tumor cells might play a key role in its anticancer activities. SJ could be used as a potential natural apoptosis-inducer in liver cancer therapy.
- Citation: Wu SD, Liu CL, Wang HC, Bao DH. Apoptosis of human liver cancer cell line SMMC-7721 induced by Senjiu capsule. Shijie Huaren Xiaohua Zazhi 2003; 11(7): 908-911
- URL: https://www.wjgnet.com/1009-3079/full/v11/i7/908.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i7.908
恶性肿瘤与细胞凋亡调节紊乱、细胞增生分化/死(凋)亡平衡失调等多种因素有关[1-4]. 细胞凋亡在肿瘤形成的不同阶段均具有十分重要的作用, 他可以在基因水平被多种生物和理化因素诱导而启动, 通过自主清除恶变的或者可能恶变的细胞而调控肿瘤的发生发展[5-11]. 近年来, 诱导肿瘤细胞凋亡已成为筛选抗癌药物的一个新的重要指标, 开发低毒并可诱导肿瘤细胞凋亡的新药及设计相应的新疗法已成为肿瘤化疗、放疗、生物治疗、基因治疗、诱导分化治疗研究的新领域. 中药复方参臼胶囊(SJ)在长期临床实践中收到了较为满意和可靠的疗效, 并获陕西省科委基金资助, 对其抗癌作用及其机制进行研究. 初期实验发现该方剂具有诱导肿瘤细胞凋亡的作用, 显示了该药广阔的应用前景与价值. 我们分别从细胞、亚细胞、分子水平研究了SJ诱导肝癌细胞凋亡的机制, 为该药的进一步开发和应用提供了必要的理论依据.
SJ由陕西省中医药研究院附属医院王慧川主任医师提供, 具体药物如下: 人参, 补骨脂, 郁金, 桃耳七, 半枝莲, 水蛭, 甘草. SJ制备: 以上各味中药按一定比例, 制成粉剂, 于冷水中浸泡2 h后, 加热煮沸2 h, 定量, 调整浓度为1 kg/L(相当于生药浓度), 8000 r/min×10 min离心, 上清高压灭菌后, 4 °C冰箱保存. 使用前, 无菌条件下以培养液梯度稀释成所需浓度. 人肝癌细胞株SMMC-7721由第四军医大学口腔医院生物学教研室吴军正教授提供. RPMI1640培养基为Gibco公司产品, 按说明用三蒸水配制, 并添加100 mL/L(V/V)胎牛血清、100 kU/L青霉素和100 kU/L链霉素, 0.22 U滤器除菌, 4 °C冰箱保存; 胎牛血清为浙江省金华市清湖犊牛应用研究站产品; MTT[3-(4, 5)-双甲基-乙-噻唑-(2, 5)-二甲基溴化四氮唑蓝]为美国Sigma公司产品, 以磷酸盐缓冲液(0.01 mol/L, pH7.4, PBS)配成5 g/L的溶液, 过滤除菌, 4 °C冰箱保存; TUNEL原位末端标记试剂盒[terminaldeoxylnucleotidyl transferase(TdT)]为美国Promega公司产品; DIG-dUTP为德国B.M.公司产品; Anti-DIG-Biotin为美国Sigma公司产品; SABC及DAB kit均为武汉博士德公司产品. CO2恒温孵箱: 美国Forma Scientific公司; IMT-2型倒置生物显微镜: 日本Olympus公司; YJ-875型超净工作台: 苏州净化设备厂; 透射电子显微镜: 日本产JEM-2000EX型; 96孔及24孔细胞培养板: 丹麦Costar公司.
人肝癌细胞株SMMC-7721常规培养于RPMI1640完全培养液内, 置37 °C, 50 mL/L CO2孵箱, 2-3 d传代1次. 取指数生长期细胞供实验. 盖玻片泡酸处理, 高压灭菌后, 放入新24孔板内, 每孔1片; 取对数生长期SMMC-7721细胞, 常规消化, 调密度至107/L, 加样, 1 mL/孔; 24 h后, 各孔加入10 mg/L SJ 1 mL, 设无药培养液组为对照; SJ与细胞分别作用4, 8, 12, 24, 32, 48, 60, 72 h后, 在倒置显微镜下观察记录后, 作HE染色: 培养终止, 取出盖玻片, PBS小心冲洗3遍, 放入预冷的950 mL/L酒精中, 4 °C固定, 用透明胶背面粘于载玻片上, 细胞面向上, 37 °C烘干, PBS冲洗, 置苏木精染液中5-10 min, 水浸洗, 置稀盐酸酒精中数秒分色, 水浸洗, 淡氨水中3-5 min, 水浸洗, 伊红染液中浸5-10 min, 水浸洗后, 500, 800, 900 mL/L酒精梯度脱水各1-2 min, 950 mL/L酒精2次各1-2 min, 1 L/L无水酒精3次各2 min, 透明, 二甲苯中3次各2 min, 树胶封片观察.
1.2.1 细胞超微结构改变 取对数生长期7721细胞分别接种于4个100 mL细胞培养瓶内, 24 h后前3瓶细胞分别加入10 mg/L SJ 10 mL, 第4瓶加入培养液10 mL. 分别作用24, 48, 72 h后收集细胞, 置离心管中, PBS洗2遍, 离心2000 r/min×20 min, 使细胞形成团块贴于管底, 加入25 mL/L戊二醛固定液(取250 mL/L戊二醛原液10 mL, 加pH7.2, 0.2 mol/L磷酸缓冲液50 mL, 再加蒸馏水40 mL混匀, 4 °C冰箱保存), 4 °C固定2 h, 0.1 mol/L PBS浸洗后, 10 g/L锇酸(OsO4)固定10 min, 用Epon812常规方法包埋, 制成半薄切片, 甲苯胺兰染色, 光镜下定位, LKB-5型超薄切片, 铀-铅双染色, 透射电镜下观察照相.
1.2.2 原位末端标记法检测细胞凋亡 常规接种SMMC-7721细胞于24孔板中的载玻片上, 每孔1×107/L(载玻片预先用多聚赖氨酸处理), 24 h后加入SJ药液(10 mg/L), 以不加药组为对照, 药物作用24 h或48 h; 将24孔板离心2000 r/min×5 min, 取出载玻片, 40 ml/L多聚甲醛室温固定30 min. 0.1 mol/L pH7.4 PBS洗2 min×2次, 蒸馏水洗涤2 min×2次, 新鲜配制30 ml/L H2O2, 室温处理10 min, 蒸馏水洗涤2 min×3次, 标本片加0.01 mol/L pH7.5 TBS(1L双蒸馏水中加入氯化钠8.5 g, Tris1.2 g和纯乙酸0.45-0.5 mL), 1:200新鲜稀释Proteinase K 37 °C消化5 min, 蒸馏水洗涤2 min×3次, 甩去玻片上多余液体, 加标记缓冲液(laleling buffer)20 μL/样本以保持玻片湿润, 甩片后, 加标记液(TdT1 μL和DIG-d-UTP18 μL混匀), 20 μL/样本, 样本置湿盒内, 4 °C标记过夜后, 37 °C标记2 h, TBS洗2 min×3次, 加封闭液50 μL/样本, 室温30 min, 甩掉封闭液, 加封闭液1:100稀释生物素化抗地高辛抗体, 50 μL/样本, 置湿盒中, 37 °C 30 min, TBS洗2 min×3次, 加TBS 1:100稀释SABC, 37 °C反应30 min, TBS洗5 min×4次, DAB显色15 min, 水洗, 苏木素轻度复染, TBS洗, 蒸馏水洗, 脱水, 透明, 封片. 显微镜观察, 成像.
细胞经SJ作用24 h后, 在倒置显微镜下可见细胞变圆、缩小, 折光性增强, 细胞破碎, 漂浮在培养液中. 经HE染色后, 细胞核呈兰黑色, 胞质呈淡红色, 部分细胞出现凋亡改变, 单个散在分布, 表现为核染色质致密浓缩, 核碎裂或核染色质断裂, 形成大小不等的凋亡小体. 48 h组凋亡细胞进一步增多, 形态学特征更加典型. 72 h组细胞则主要表现为均质红染的无结构物质, 核染色消失, 凋亡小体解体(图1、图2).
肿瘤细胞经SJ作用后, 出现典型的凋亡征象, 说明诱导肿瘤细胞凋亡可能是SJ抗肿瘤作用的重要机制. 过去认为, 化疗药物引起细胞坏死是其抗肿瘤的主要机制, 但多数情况下, 药物有效浓度对肿瘤细胞的杀灭效率不足以解释其实际治疗效应, 随着细胞凋亡机制研究的深入, 发现许多抗肿瘤药物都具有诱导细胞凋亡的作用[12,13]. 我们的观察证实SJ同样具此作用, 分析这可能与SJ的主药鬼臼中内含鬼臼毒素[14-17], 可干扰细胞有丝分裂, 抑制DNA合成而诱发凋亡有关. 凋亡细胞由于内源性核酸内切酶被激活, 细胞自身的染色质或DNA被切割, 出现单链或双链缺口, 并产生与DNA断点数目相同的3'-OH末端. 末端脱氧核糖核酸转移酶(terminal deoxynucleotidyl transterase)可将地高辛标记的dUTP(DIG-dUTP)标记至3'-OH末端, DIG-dUTP结合在DNA断点部位, 加入生物素标记的抗地高辛抗体(anti-DIG-biotin), 再结合链酶亲和素一过氧化物酶(SABC), 最后加入底物DAB显色. 原位末端标记技术(又称TUNEL法)即是依此原理建立起来的, 这是目前公认的且已被各实验室采用的用于检测细胞凋亡的一种较为敏感和特异的检测技术. 我们采用本法检测凋亡细胞. 取片固定前加作一步离心涂片, 再固定、染色, 结果于SJ作用48 h组, 镜下可见大量细胞核着棕黄色的凋亡细胞, 进一步证实了SJ可诱导SMMC-7721细胞凋亡的作用.
近年来, 关于中药抗癌作用及其机制的研究已成为抗肿瘤研究的新热点. 我们之所以研究复方中药SJ抗肿瘤作用及其机制, 主要是基于其长期可靠的临床疗效, 试图从复方整体角度出发, 在细胞和分子水平研究其抑癌作用及其机制, 虽有些以管窥豹之意, 但也可为SJ在临床治疗中的应用提供必要的理论依据, 并力图探索一条从相关性、整体性角度出发进行复方研究的新思路, 使富有哲理的中医理论具有现代科学内涵, 研制出疗效更为确切的抗癌新药.