修回日期: 2002-02-15
接受日期: 2003-03-26
在线出版日期: 2003-06-15
探讨大肠癌细胞和组织中BAI1基因的表达情况及BAI1对血管和肿瘤生长的抑制作用.
提取大肠癌细胞总RNA, 按RT-PCR试剂盒的步骤反转录成cDNA, PCR产物行20 g/L脂糖凝胶电泳分析. BAI1对血管和肿瘤生长的抑制作用应用微血管数量(MVQ)和肿瘤移植实验的方法进行.
大肠癌细胞、癌组织中大多数BAI1不表达或表达下降, 在全部转移的淋巴结中不表达, 在小鼠CC95大肠癌细胞移植肿瘤内注射Ad-hBAI1表达载体可以有效的影响肿瘤的血管生成(P<0.05), 并抑制肿瘤的生长(P<0.01).
BAI1在肠癌细胞、组织及转移的淋巴结中表达降低, 该Ad-hBAI1表达载体可抑制肿瘤新生血管的形成并抑制肿瘤的生长.
引文著录: 王志华, 康熙雄, 张智清, 申宝忠, 李莹. 肠癌细胞BAI1基因表达的检测及其抗肿瘤作用. 世界华人消化杂志 2003; 11(6): 834-836
Revised: February 15, 2002
Accepted: March 26, 2003
Published online: June 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(6): 834-836
- URL: https://www.wjgnet.com/1009-3079/full/v11/i6/834.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i6.834
肿瘤生长与转移过程中发生着持续而失控的血管生成(angiogenesis), 血管生成是肿瘤增生、侵袭、转移的重要环节, 研究发现血管生成是一种复杂的过程, 包括内皮细胞激活、增生、迁移、血管基底膜破坏, 形成新的血管和血管网, 并且与已存在的血管网连接, 原发肿瘤的血管生长使肿瘤细胞脱落易于转移. 基于这一认识, 人们逐渐将注意力集中在研究血管生成的生物学基础上, 探讨减弱血管生成的递质, 评价用抗血管生成物质来阻止肿瘤生长的方案和途径. 最近Nishimri et al [1]首次发现并克隆出一个新的基因, 具有抑制肿瘤血管生成的作用, 命名为脑特异性新生血管抑制因子1(brain-specific angiogenesis inhibitor 1, BAI1), 为了进一步证实其作用, 本研究观察了大肠癌患者BAI1的表达情况, 试图寻找用BAI1治疗肿瘤的新途径.
RPMI1640培养液来自GIBCO公司; 基因重组脑特异性新生血管抑制因子1表达载体(Ad-hBAI1)由日本东京大学医科学研究所馈赠. 肿瘤组织和细胞株: 人直肠癌组织从临床外科手术切除的肿瘤组织中获得, 直肠癌细胞株CC95由本所培养、建立. 实验动物: BALB/C裸鼠, ♀, 5-6周龄, 从中国医学科学院动物部获得, 在无病原微生物的洁净条件下实验、饲养.
1.2.1 人大肠癌细胞BAI-1的表达 采用异硫氰酸胍一步法提取大肠癌细胞总RNA, 按RT-PCR试剂盒的步骤反转录成cDNA. BAI1基因的PCR引物: 5'端引物为5'-ACTCATCCTGCGACGGTGTG-3', 3'端引物为5'-TCCCTCAGGTCCTTCATGCG-3'. PCR参数: 94 °C1 min, 56 °C 1 min, 72 °C 2 min, 30次循环, PCR产物行20 g/L琼脂糖凝胶电泳分析.
1.2.2 Ad-hBAI1对新生血管的抑制作用 裸鼠体内接种1×105 CC95细胞, 2 wk后取出肿瘤组织, 观察微血管数量(microvessel quantity, MVQ), 确定BAI1对肿瘤组织新生血管的抑制情况, 方法(1)微血管染色, 石蜡切片, HE染色和免疫组织化学染色LSAB法(应用Pako公司试剂盒). 方法(2)微血管计数, 低倍镜下观察切片全部视野, 找到肿瘤血管密度最高区域, 在高倍镜下(200×)随机选取5个高倍视野计数微血管, 其均值即为MVQ.
1.2.3 Ad-hBAI1对肿瘤生长的抑制作用 BALB/C裸鼠随机分成3组, 每组5只, 每只背部皮下接种1×105 CC95细胞, 第1、2、3组在第1、3、5、7、9日局部分别注射RPMI1640、腺病毒载体和腺病毒重组表达载体Ad-hBAI1(2 μg/次), 每天观察并记录肿瘤生长情况.
统计学处理 结果采用未配对计量资料的t检验进行统计学分析. P<0.05具有统计学意义.
从大肠癌组织、淋巴结和培养细胞CC95提取mRNA, 反转录成DNA, PCR扩增, 电泳分析. 临床手术切除的20例样品中7例阳性, CC95细胞和其他13例阴性, 转移性淋巴结无表达, 非转移性淋巴结有阳性表达.
按前述方法, 2 wk后经麻醉处死小鼠, 免疫组化染色, 镜下观察, 肿瘤内的血管扭曲、分支紊乱、吻合丰富、管腔不规则, Ad-hBAI1治疗组的肿瘤内血管增生受到明显抑制(表1), MVQ与对照组相比差异显著(P<0.05).
| 组别 | 处理 | 微血管数量(MVQ) |
| 1 | RPMI1640 | 64±16.5 |
| 2 | Ad-LacZ | 59±19.3 |
| 3 | Ad-hBAI1 | 37±17.8 |
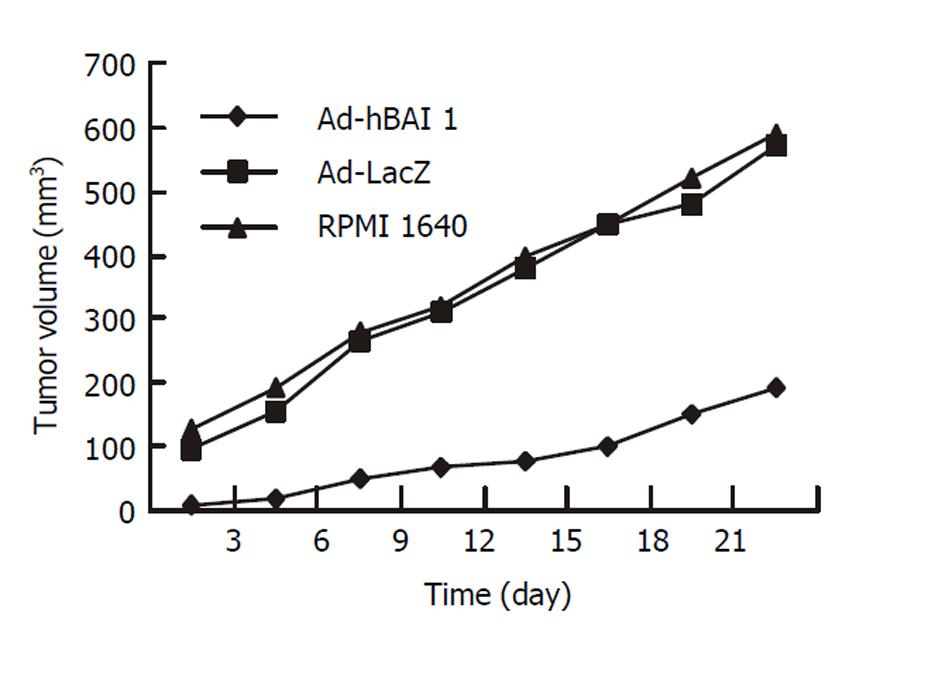
每组动物分别给予局部注射RPMI1640、腺病毒载体和腺病毒重组表达载体, 定期观察肿瘤大小, 进行比较. 给予Ad-hBAI1治疗注射的实验动物的肿瘤生长速度与对照组相比明显减缓(P<0.01, 图1).
肿瘤血管的新生是受众多血管生成因子严密控制的, 正调节因子包括血管内皮生长因子(VEGF), 成纤维细胞生长因子(FGF), 转化生长因子(TGF), 血管生长素(angionenin)等, 负调节因子包括血小板反应蛋白(TBS)、血管抑素(angiostatin)、内皮抑素(endostatin)等, 这些正负因子作为肿瘤血管靶向基因治疗的靶分子受到人们的关注, 有的已进入临床实验阶段[2-16]. BAI1是较晚发现的肿瘤血管抑制因子, 该基因在人脑中特异性表达, 编码由1 584个氨基酸残基组成的细胞膜蛋白, 含有5个血栓海绵蛋白-1(TSP-1)重复序列, 在体外可抑制由基底膜成纤维细胞生长因子(bFGF)诱发的血管新生, 该基因至少有一个功能性的p53结合序列诱导p53活化, 发挥该抑癌基因的作用[1], 有研究者发现在结肠癌和肺癌患者的肿瘤组织中BAI1的表达明显减低[17-19]. 最近证明在胃癌转移灶中BAI1几乎不表达[20].
大肠癌是临床上多见的恶性肿瘤, 其发病的确切机制尚未明了, 大量的研究证明其发生伴有多种癌基因的改变[21-35]. 我们的研究结果证明临床手术切除的20例癌组织中大多数BAI1不表达或表达下降, 在全部转移的淋巴结中不表达, 而向小鼠CC95大肠癌细胞移植肿瘤注射Ad-hBAI1表达载体可以有效的抑制肿瘤的生长, 影响肿瘤的血管生成, BAI1何以有如此的功效尚未可知, 推测可能和其功能性的p53结合序列诱导p53抗癌基因活化有关.
总之, 我们的研究证明BAI1可抑制肿瘤的新生血管并因而抑制肿瘤的生长, 提示BAI1可以作为一个新的目的基因, 在肿瘤血管靶向基因治疗中具有潜在的应用价值.
| 1. | Nishimori H, Shiratsuchi T, Urano T, Kimura Y, Kiyono K, Tatsumi K, Yoshida S, Ono M, Kuwano M, Nakamura Y. A novel brain-specific p53-target gene, BAI1, containing thrombospondin type 1 repeats inhibits experimental angiogenesis. Oncogene. 1997;15:2145-2150. [PubMed] [DOI] |
| 2. | Mulligan-Kehoe MJ, Kleinman HK, Drinane M, Wagner RJ, Wieland C, Powell RJ. A truncated plasminogen activator inhibitor-1 protein blocks the availability of heparin-binding vascular endothelial growth factor a isoforms. J Biol Chem. 2002;277:49077-49089. [PubMed] [DOI] |
| 3. | Nakashima T, Kondoh S, Kitoh H, Ozawa H, Okita S, Harada T, Shiraishi K, Ryozawa S, Okita K. Vascular endothelial growth factor-C expression in human gallbladder cancer and its relationship to lymph node metastasis. Int J Mol Med. 2003;11:33-39. [DOI] |
| 4. | Linder-Stragliotto C, Strander H, Munck-Wikland E, Sten-Linder M. Low levels of endostatin in the urine from patients with malignant disease. Tumour Biol. 2002;23:222-227. [PubMed] [DOI] |
| 5. | Van Moorselaar RJ, Voest EE. Angiogenesis in prostate cancer: its role in disease progression and possible therapeutic approaches. Mol Cell Endocrinol. 2002;197:239-250. [DOI] |
| 6. | Yabushita H, Noguchi M, Kinoshita S, Kishida T, Sawaguchi K, Noguchi M. Angiostatin expression in endometrial cancer. Oncol Rep. 2002;9:1193-1196. [DOI] |
| 7. | Hajitou A, Grignet C, Devy L, Berndt S, Blacher S, Deroanne CF, Bajou K, Fong T, Chiang Y, Foidart JM. The antitumoral effect of endostatin and angiostatin is associated with a down-regulation of vascular endothelial growth factor expression in tumor cells. FASEB J. 2002;16:1802-1804. [PubMed] [DOI] |
| 8. | Te Velde EA, Vogten JM, Gebbink MF, van Gorp JM, Voest EE, Borel Rinkes IH. Enhanced antitumour efficacy by combining conventional chemotherapy with angiostatin or endostatin in a liver metastasis model. Br J Surg. 2002;89:1302-1309. [PubMed] [DOI] |
| 9. | Sacco MG, Soldati S, Mira Cato E, Cattaneo L, Pratesi G, Scanziani E, Vezzoni P. Combined effects on tumor growth and metastasis by anti-estrogenic and antiangiogenic therapies in MMTV-neu mice. Gene Ther. 2002;9:1338-1341. [PubMed] [DOI] |
| 10. | Kuhn H, Riedel A, Eichler W, Aust G, Gessner C, Wirtz H. Influence of adenoviral vector on expression of angiogenesis regulating factors in non-small cell lung cancer cell lines. Cancer Immunol Immunother. 2002;51:461-466. [PubMed] |
| 11. | Conti CJ. Vascular endothelial growth factor: regulation in the mouse skin carcinogenesis model and use in antiangiogenesis cancer therapy. Oncologist. 2002;7:4-11. [PubMed] [DOI] |
| 12. | Ambati BK, Joussen AM, Ambati J, Moromizato Y, Guha C, Javaherian K, Gillies S, O'Reilly MS, Adamis AP. Angiostatin inhibits and regresses corneal neovascularization. Arch Ophthalmol. 2002;120:1063-1068. [DOI] |
| 13. | Kunz M, Hartmann A. Angiogenesis--anti-angiogenesis. Significance for tumor growth and metastasis. Hautarzt. 2002;53:373-384. [PubMed] [DOI] |
| 14. | Indraccolo S, Gola E, Rosato A, Minuzzo S, Habeler W, Tisato V, Roni V, Esposito G, Morini M, Albini A. Differential effects of angiostatin, endostatin and interferon-alpha(1) gene transfer on in vivo growth of human breast cancer cells. Gene Ther. 2002;9:867-878. [PubMed] [DOI] |
| 15. | Kim ES, Herbst RS. Angiogenesis inhibitors in lung cancer. Curr Oncol Rep. 2002;4:325-333. [PubMed] [DOI] |
| 16. | Ma HI, Lin SZ, Chiang YH, Li J, Chen SL, Tsao YP, Xiao X. Intratumoral gene therapy of malignant brain tumor in a rat model with angiostatin delivered by adeno-associated viral (AAV) vector. Gene Ther. 2002;9:2-11. [PubMed] [DOI] |
| 17. | Yoshida Y, Oshika Y, Fukushima Y, Tokunaga T, Hatanaka H, Kijima H, Yamazaki H, Ueyama Y, Tamaoki N, Miura S. Expression of angiostatic factors in colorectal cancer. Int J Oncol. 1999;15:1221-1225. [DOI] |
| 18. | Fukushima Y, Oshika Y, Tsuchida T, Tokunaga T, Hatanaka H, Kijima H, Yamazaki H, Ueyama Y, Tamaoki N, Nakamura M. Brain-specific angiogenesis inhibitor 1 expression is inversely correlated with vascularity and distant metastasis of colorectal cancer. Int J Oncol. 1998;13:967-970. [DOI] |
| 19. | Hatanaka H, Oshika Y, Abe Y, Yoshida Y, Hashimoto T, Handa A, Kijima H, Yamazaki H, Inoue H, Ueyama Y. Vascularization is decreased in pulmonary adenocarcinoma expressing brain-specific angiogenesis inhibitor 1 (BAI1). Int J Mol Med. 2000;5:181-183. [DOI] |
| 20. | Lee JH, Koh JT, Shin BA, Ahn KY, Roh JH, Kim YJ, Kim KK. Comparative study of angiostatic and anti-invasive gene expressions as prognostic factors in gastric cancer. Int J Oncol. 2001;18:355-361. [DOI] |