Copyright
©The Author(s) 2003. Published by Baishideng Publishing Group Inc. All rights reserved.
大鼠肝纤维化中细胞外信号调节激酶的作用
梁增文, 张国, 王天才
梁增文, 张国, 广西壮族自治区人民医院消化内科 广西壮族自治区南宁市 530021
梁增文, 男, 1968-06-06生, 广西壮族自治区天等县人, 壮族. 1992年广西医科大学本科毕业, 2000年广西医科大学硕士研究生毕业, 主治医师. 主要从事肝纤维化的研究.
王天才, 华中科技大学同济医学院附属同济医院肝病研究所湖北省武汉市 430030
ORCID number: $[AuthorORCIDs]
基金项目: 广西壮族自治区自然科学基金资助项目, No. 0135035.
电话: 771-2808513-2627
收稿日期: 2002-10-07
修回日期: 2002-10-20
接受日期: 2002-10-22
在线出版日期: 2003-06-15
目的
通过研究大鼠肝纤维化模型肝组织中细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)的表达和分布规律, 初步探讨ERK信号传导通路在肝纤维化发病机制中的作用.
方法
♂SD大鼠32只, 质量250-300 g, 皮下注射CCl4制备大鼠肝纤维化模型, 分别于注射CCl4后1, 4, 8 wk处理动物, 采用免疫组织化学方法检测肝组织中ERK1的表达及分布.
结果
ERK1主要表达于肝星状细胞中. CCl4注射诱导后, 大鼠肝组织中ERK1的表达较正常对照明显增强(P<0.05). 且CCl4注射1, 4, 8 wk组肝组织中ERK1的表达强度呈明显的逐级递增的趋势(P<0.05).
结论
ERK信号传导通路的激活促进肝星状细胞的活化增生, 可能与大鼠肝纤维化的发生发展有关.
关键词: N/A
引文著录: 梁增文, 张国, 王天才. 大鼠肝纤维化中细胞外信号调节激酶的作用. 世界华人消化杂志 2003; 11(6): 730-732
Extracellular signal-regulated kinase in liver fibrogenesis of rat
Zeng-Wen Liang, Guo Zhang, Tian-Cai Wang
Zeng-Wen Liang, Guo Zhang, Department of Digestive Diseases, People`S Hospital, Nanning 530021, Guangxi Zhuang Nationality Autonomous Region, China
Tian-Cai Wang, Hepatic Institute, Tongji Medical College, Huazhong Univensity of Sciense and Technology, Wuhan 430030, Hubei Province, China
Supported by: the Natural Scientific Foundation of Guangxi Zhuang Nationality Autonomous Region, No. 0135035.
Correspondence to: Dr. Guo Zhang , Department of Digestive Diseases, People's Hospital, 6 Taoyuan Road, Nanning 530021, Guangxi Zhuang Nationality Automous Region, China. phdoctorzhang@163.net
Received: October 7, 2002
Revised: October 20, 2002
Accepted: October 22, 2002
Published online: June 15, 2003
AIM
To explore the role of ERK signal transduction pathway in the pathogenesis of liver fibrosis via investigating the expression and distribution of ERK1 in rats with liver fibrosis.
METHODS
Liver fibrosis model of rats were made by subcutaneously injecting with CCl4. Thirty-two male SD rats (weight 250-300 g) were randomly scarified at 1, 4 and 8 weeks after injection of CCl4 respectively, and their liver were used to detect ERK1 expression by immunohistochemical staining.
RESULTS
The expression of ERK1 in rats after injection with CCl4 were found chiefly in hepatic stellate cells(HSC)and all significantly higher than those in normal rats(P<0.05). Moreover, it presented with a progressive tendency for the expression of ERK1 in rats respectively at 1st, 4th and 8th week after injection with CCl4 (P<0.05).
CONCLUSION
The activation of ERK signal transduction pathway enhances HSC proliferation, and it may play an important role in liver fibrogenesis in rat.
Key Words: N/A
0 引言
细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)可能与器官纤维化的发生有关[1-4]. 但ERK通路是否参与肝纤维化过程尚无明确报道. 我们应用免疫组织化学方法对CCl4诱导的肝纤维化大鼠肝组织进行检测, 初步探讨该信号转导通路在肝纤维化发生中的作用如下.
1 材料和方法
1.1 材料
健康♂SD大鼠(由华中科技大学实验动物中心提供)32只, 质量200-300 g, 随机均分为1, 4, 8 wk及正常对照4组. 主要试剂: 兔抗人ERK1抗体和ABC二抗试剂盒购自北京中山生物技术有限公司, 内源性生物素封闭液(ABB液)购自武汉博士德公司.
1.2 方法
肝纤维化模型制备及标本处理: 按0.3 ml/100 g体重的剂量, 皮下注射40 ml/L CCl4油剂, 2次/wk. 分别在注射CCl4第1, 4, 8周分批处死动物, 留取肝脏组织, PBS(PH7.4)清洗后100 ml/L甲醛固定, 常规石蜡包埋, 连续5 μm切片. 免疫组织化学染色: 采用SABC法, 石蜡切片常规脱蜡, 30 ml/L H2O2甲醇溶液室温孵育15 min, PBS洗涤5 min×2遍后, 用0.01 mol/L的柠檬酸缓冲液(pH6.0)加热至92-96 °C修复抗原15 min, 冷却后依次滴加ABB液和正常兔血清封闭各10 min, 而后用ERK1一抗4 °C孵育过夜; 次日取出切片以PBS冲洗后, 再依次滴加生物素化羊抗兔二抗、链酶卵白素; 最后DAB显色, 苏木素复染. 常规乙醇脱水、二甲苯透明、中性树胶封片保存. 光镜下观察并分析ERK1表达情况. ERK1抗体稀释度为1:200. 用PBS代替一抗作阴性对照. 图像分析和数据统计: 用HPIAS-1000型全自动医学图像彩色分析系统(由华中科技大学同济医学院病理教研室提纲)进行图像半定量分析, 每张切片随机选取5个视野, 测定肝组织中 ERK1的棕黄色阳性表达颗粒的平均吸光度A值.
统计学处理 应用SPSS统计软件对四组数据进行ANOVA检验, 结果以均数±标准差(mean±SD)表示, P<0.05为有显著性差异.
2 结果
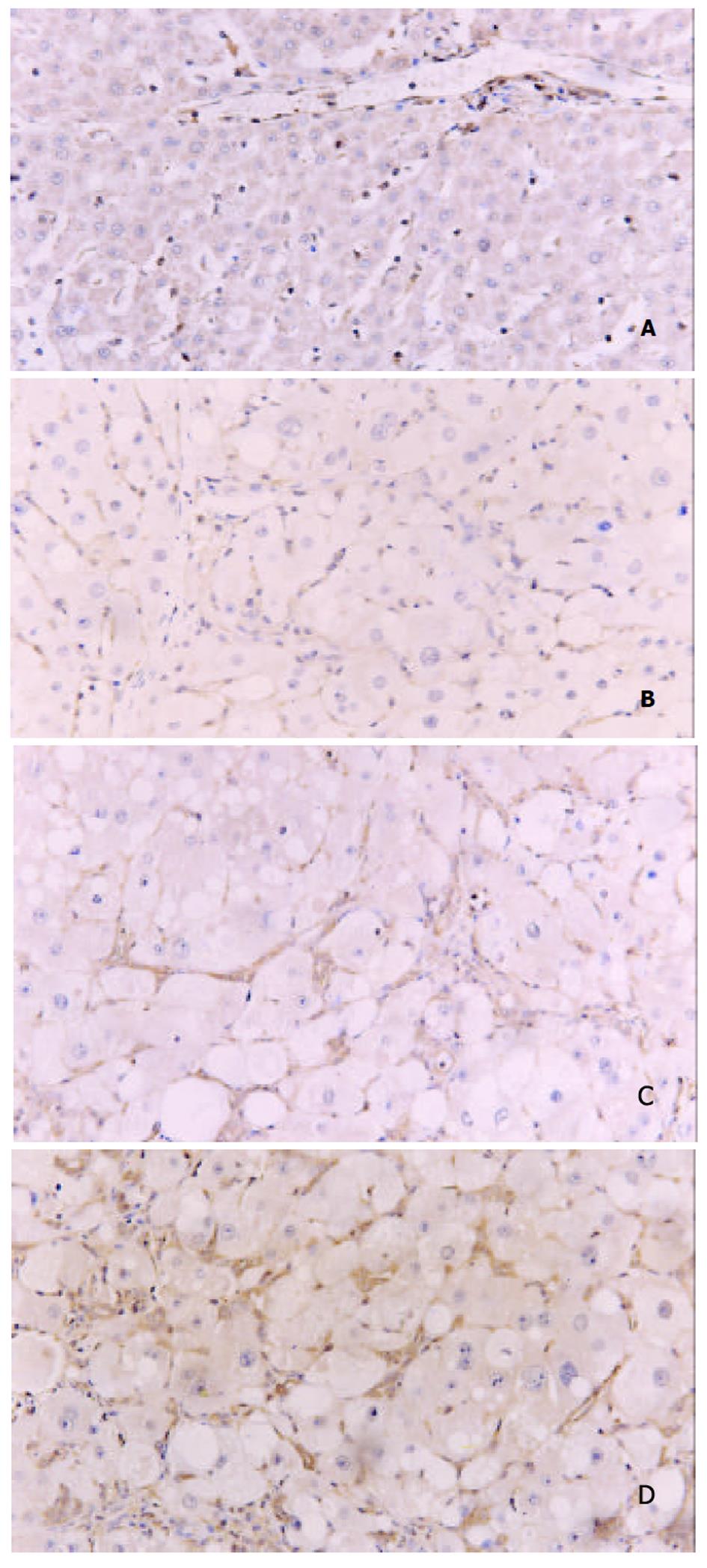
在正常肝组织中, ERK1呈针尖状棕黄色弱阳性表达, 主要见于汇管区、小叶中央静脉周围及肝索Disse腔间隙中. 高倍镜下, ERK1分布于Disse间隙的HSC胞质中, 肝细胞未见表达(图1A). 在CCl4注射1, 4, 8 wk组肝组织中, ERK1的表达明显增多、增强, 低倍镜下可见小叶中央静脉周围、汇管区以及肝小叶内均有大量条索状、星芒状的ERK1阳性表达. 高倍镜下, ERK1阳性表达主要分布于HSC胞质、胞核中. 在8 wk组肝纤维化组织中, 除HSC表达外, 亦有零星肝细胞胞质、胞核呈ERK1阳性(图1B, C, D). 随CCl4诱导时间的延长, ERK1在正常对照组及CCl4注射1, 4, 8 wk组肝组织中的表达强度呈明显的逐级递增的趋势(0.3597±0.0140, 0.3849±0.0199, 0.7876±0.0316, 0.9125±0.0158, P<0.01或P<0.05).
图1 大鼠肝组织中ERK1的表达SABC×200.
A: 正常. B: CCl4 注射1 wk. C: CCl4 注射4 wk. D: CCl4 注射8 wk.
3 讨论
肝纤维化是大多数慢性肝病向肝硬化发展的共同病理过程 [5-7]. 研究证实, 肝星状细胞(haptic stellate cell, HSC)增生、活化及分泌细胞外基质(extracellular matric, ECM)是肝纤维化形成的重要机制[8-12]. 近年资料表明, 肝慢性损伤及炎症反应时, HSC最强的促分裂剂血小板衍化生长因子(platelet-derived growth factor, PDGF)及其受体的表达明显增强[13-16]. 而PDGF活化信号可能是通过Ras/raf/ERK级联通路进行转导的[17-20]. 为此, 我们对ERK1在大鼠肝纤维化发生、发展中的表达及分布进行了研究, 结果显示: CCl4注射诱导后, 大鼠肝组织中ERK1的表达较正常对照明显增多、增强; 在正常大鼠肝组织中, ERK1呈肝间质细胞胞质分布, 正常肝细胞内则未见表达; 在CCl4诱导各阶段, ERK1在HSC胞质、胞核均有表达, 呈核浆型分布; 随着CCl4注射诱导时间的延长, 肝组织ERK1表达呈逐渐增强趋势.
Ras/raf/ERK信号通路是MAPK众多途径中不可缺少的组成之一, 能将多种细胞外信号通过磷酸化的活化方式逐级传递至细胞核, 激活多种转录因子, 参与细胞增生、分化以及细胞恶性转化等多种生理、病理过程[21-23]. ERK(包括ERK1、 ERK2两种亚型)即是此通路中极为关键的一员, 负责将胞质内的活化信号传递入胞核内[24-26]. ERK为丝氨酸/苏氨酸激酶, 激活后可催化c-jun、c-fos、c-myc以及核糖体S6蛋白激酶(RSK)的磷酸化, 后者诱导靶基因的转录, 促使细胞由G0期进入到G1期, 继而调节细胞增生[27-30]. 我们的结果显示, 在各肝纤维化组中, ERK1的表达强度随着肝纤维化程度的加重而明显增强, 而且由单纯性胞质分布转变为核质型分布, 提示ERK携带信号的核转入明显增多, 与HSC的增生密切相关. 而HSC作为肝纤维化形成过程中起关键作用的细胞, 他的激活是整个事件发生的开端, 由此推测, ERK介导的信号通路促进肝星状细胞的增生、活化, 参与了肝纤维化发生、发展过程.