修回日期: 2002-07-30
接受日期: 2002-08-09
在线出版日期: 2003-06-15
探讨氩氦刀冷冻治疗肝脏恶性肿瘤的适应证、疗效及临床意义.
2001-07/2002-01肝癌患者31例在B超引导下行经皮穿刺氩氦刀冷冻治疗肝脏肿瘤术. 术后患者定期复查血清肿瘤标记物、B超检查及CT或MRI.
患者肝功能Child A级26例, Child B级4例, Child C级1例. 原发性肝癌21例, 转移性肝癌10例. 小肝癌(肿瘤直径≤5 cm)甲胎蛋白阳性者治疗后转阴占80%(8/10), 甲胎蛋白阴性者治疗后CT或MRI复查病灶完全坏死达66.7%(2/3). 转移性肝癌治疗后瘤标降至正常或CT、MRI提示病灶完全坏死者占50%(5/10).
氩氦刀冷冻治疗肝癌是一种微创、安全、疗效可靠的新方法. 对于不适宜行手术治疗的肝癌患者是一种有效的治疗方法.
引文著录: 钱国军, 陈汉, 吴孟超. 经皮穿刺氩氦刀冷冻治疗肝癌31例. 世界华人消化杂志 2003; 11(6): 712-715
Revised: July 30, 2002
Accepted: August 9, 2002
Published online: June 15, 2003
To describe the indication, efficacy and clinical significance of percutaneous cryoablation in the treatment of liver malignancy.
Total 31 patients with histologically or clinically confirmed primary or metastatic malignancies were treated pucutaneously under ultrasound guidance using the cryocare surgical system from July 2001 to January 2002. All patients were followed up to determine the serum tumor marker, and reveal CT scans, MRI images or utra-sound images.
This therapy was performed in 31 patients including 26 cases with Child A liver reserve, 4 cases with Child B and 1 cases with Child C. There were 21 cases of primary liver cancer and 10 metastastic liver cancer. AFP positive small liver cancer became AFP negative in 80% patients. The rate of completely concreted necrosis in small hepatic cancer with negative AFP was 66.7%, shown by CT or MRI. The curative rate for metastasis liver cancer was 50% at CT, MRI or tumor marker level.
Percutaneous cryoablation is a kind of new palliative treatment for liver carcinoma. It is minimally invasive, safe and effective especially for patients with unresectable liver cancer.
- Citation: Qian GJ, Chen H, Wu MC. Percutaneous cryoablation in treatment of liver cancer: a report of 31 cases. Shijie Huaren Xiaohua Zazhi 2003; 11(6): 712-715
- URL: https://www.wjgnet.com/1009-3079/full/v11/i6/712.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i6.712
超低温冷冻损毁肿瘤组织是近年开展的外科治疗新技术[1-13], 是用局部冷冻的方法损毁肿瘤组织, 氩氦刀靶向冷冻损毁术(trargeted cryoablation therapy)不会导致过量肝组织被切除, 因而使一些无法耐受肝脏手术的肿瘤患者可以接受该治疗[14,15]. 我们通过对经皮穿刺氩氦刀冷冻治疗肝癌的临床总结, 探讨了此疗法治疗肝癌的适应证、疗效及安全性和临床意义.
2001-07/2002-01肝癌患者31例行B超引导下经皮穿刺氩氦刀冷冻治疗肝癌术, 其中男性24例, 女性7例, 年龄29-80(平均年龄56.5). 原发性肝癌21例, 其中甲胎蛋白阳性15例, 阴性6例. 转移性肝癌10例, 来自胃肠道9例、乳腺1例. 肝功能Child A 26例, Child B 4例, Child C 1例, 根据B超确定肿瘤最大径为肿瘤大小值, 范围为1.6-10.5 cm. 小肝癌17例, 大肝癌14例. 行单次氩氦刀治疗25例, 两次5例, 三次1例. 所有患者均采取连续硬膜外麻醉, 同时实时监测血压、脉搏、血氧饱和度、呼吸、心电图等.
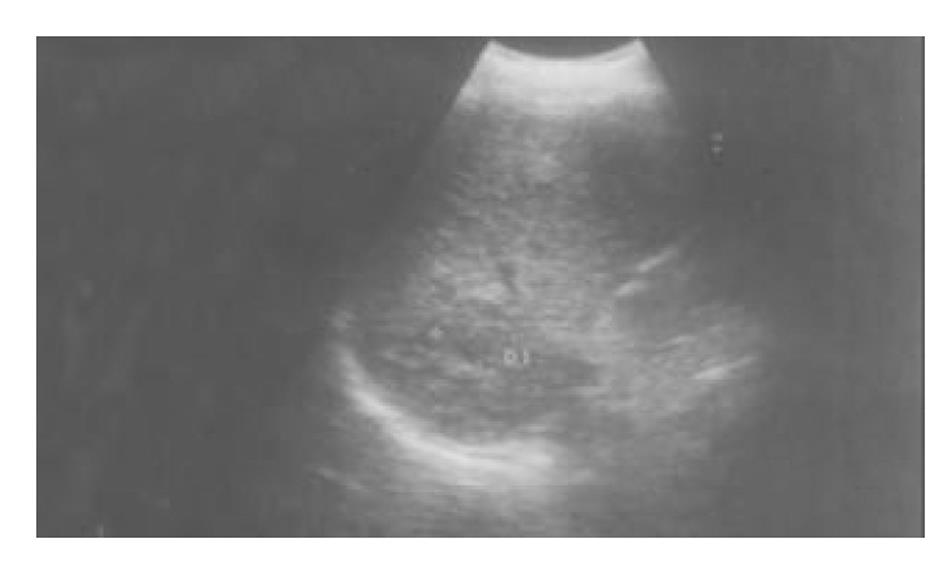
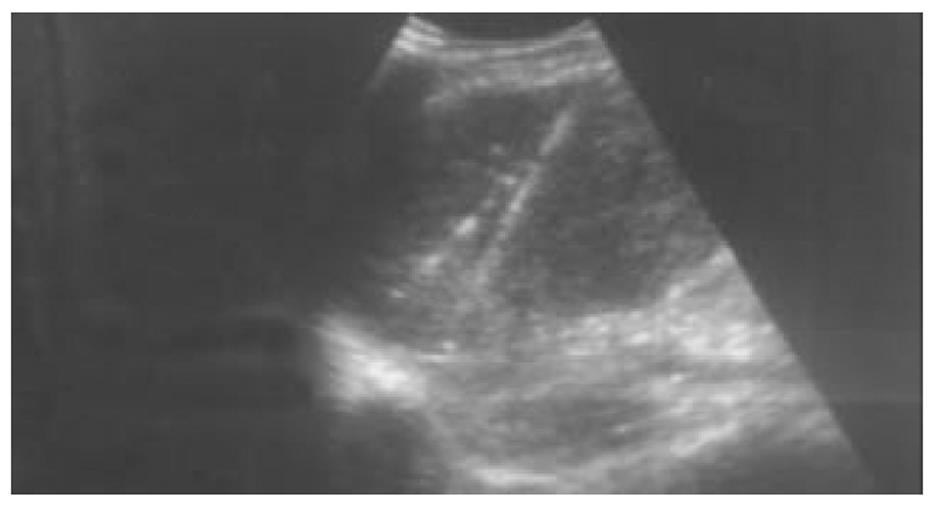
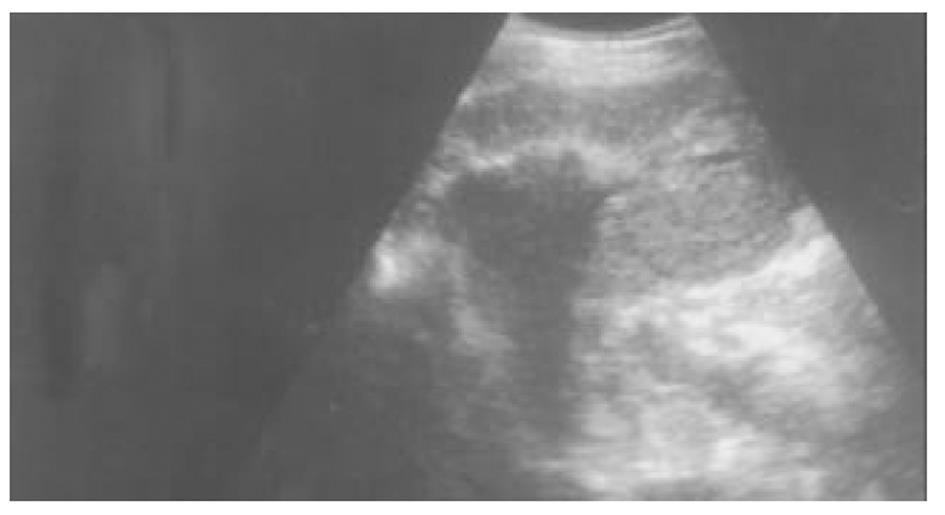
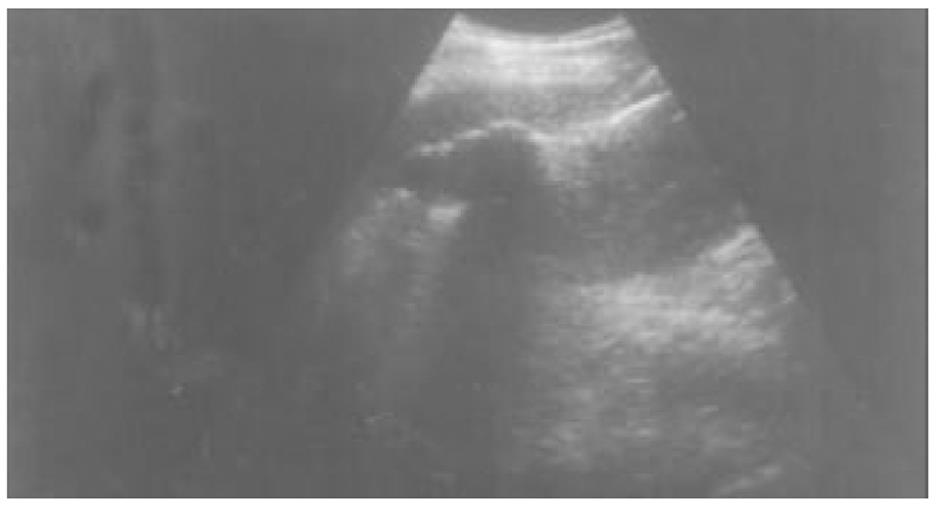
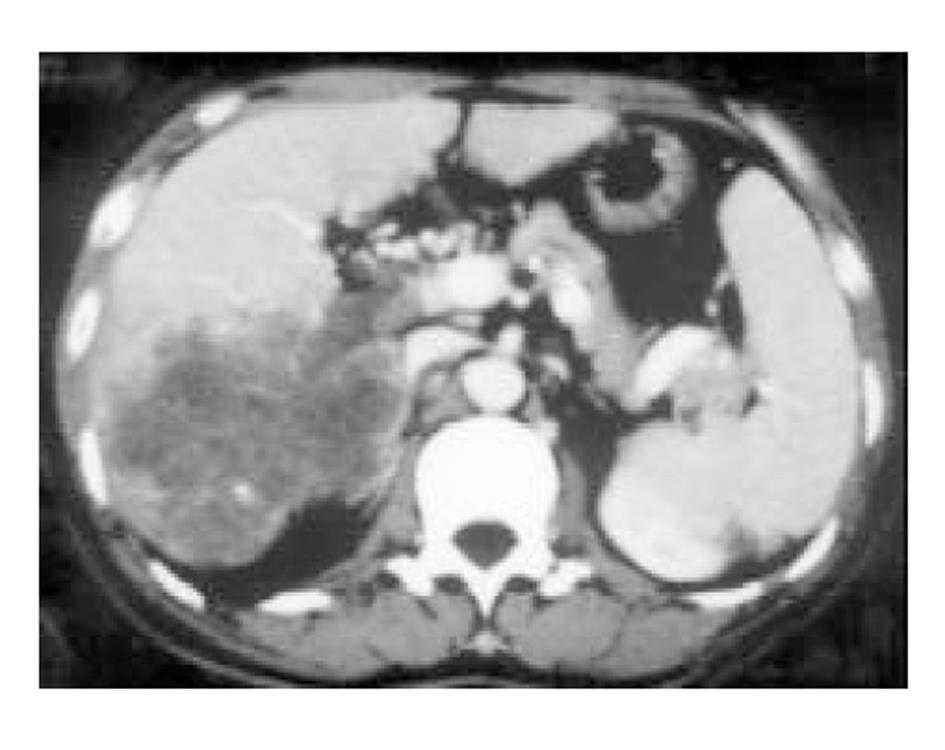
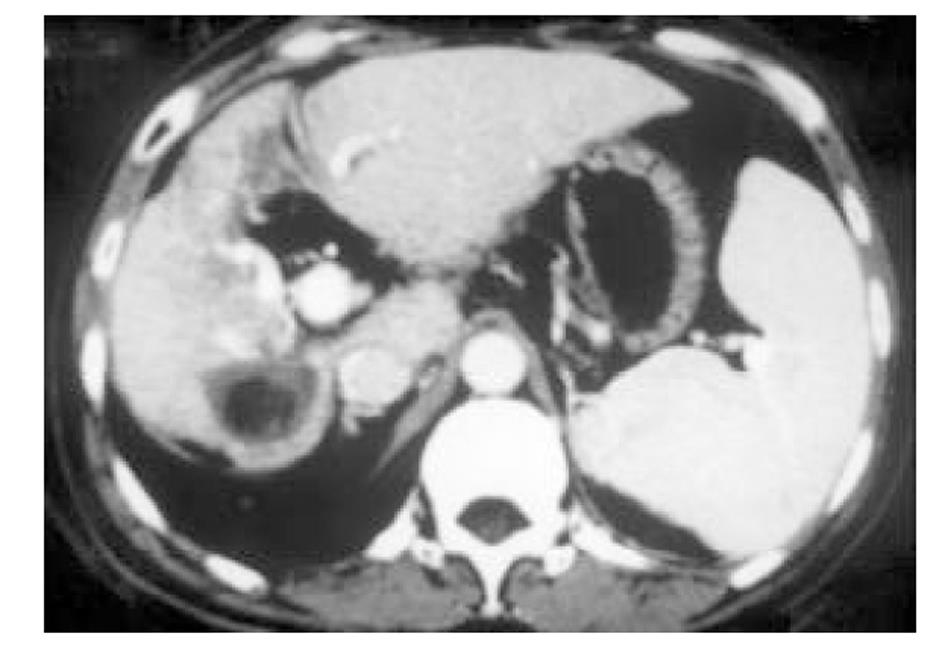
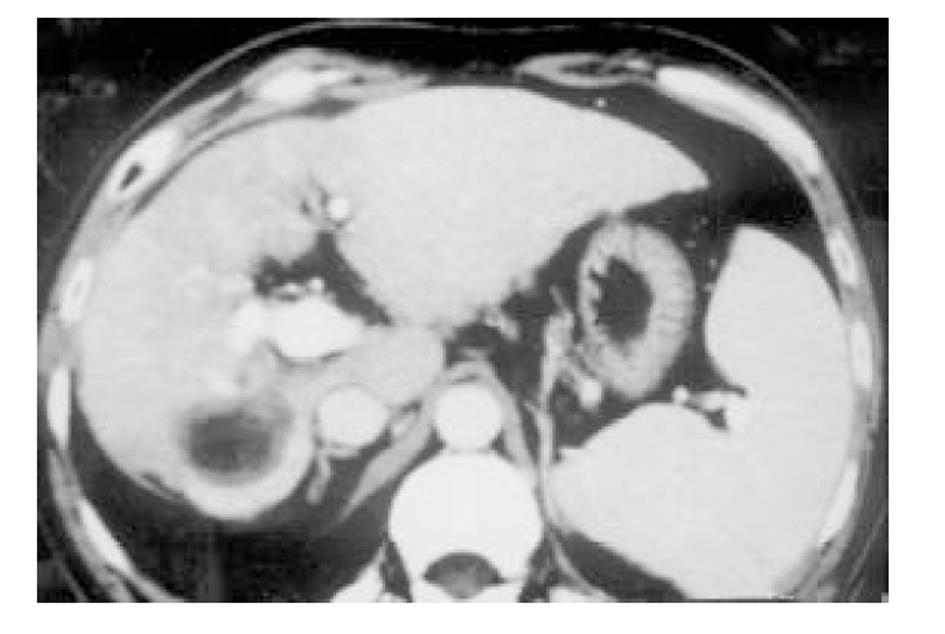
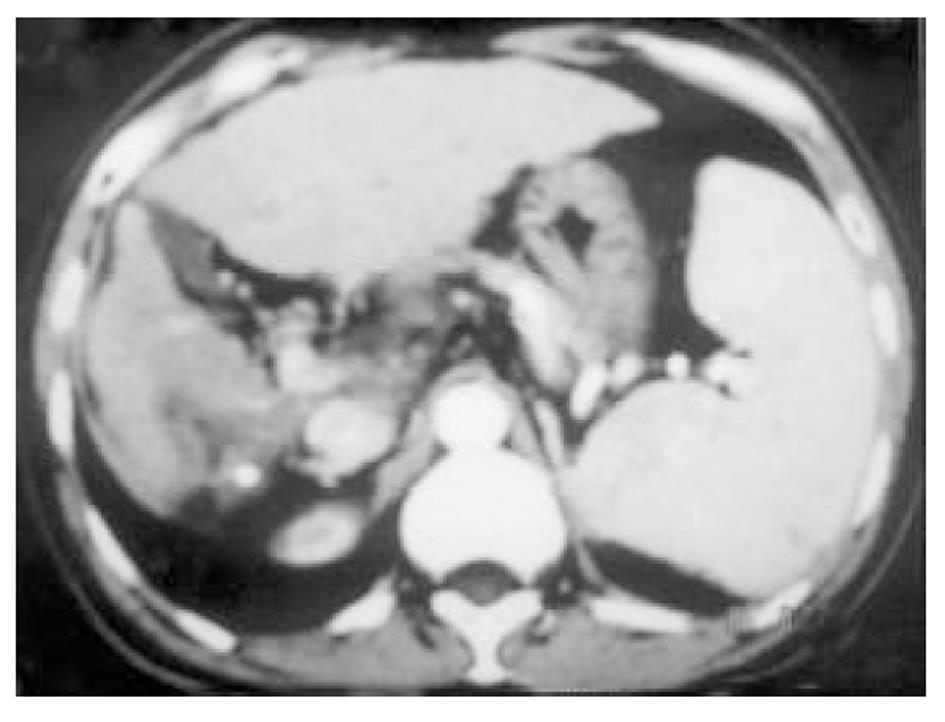
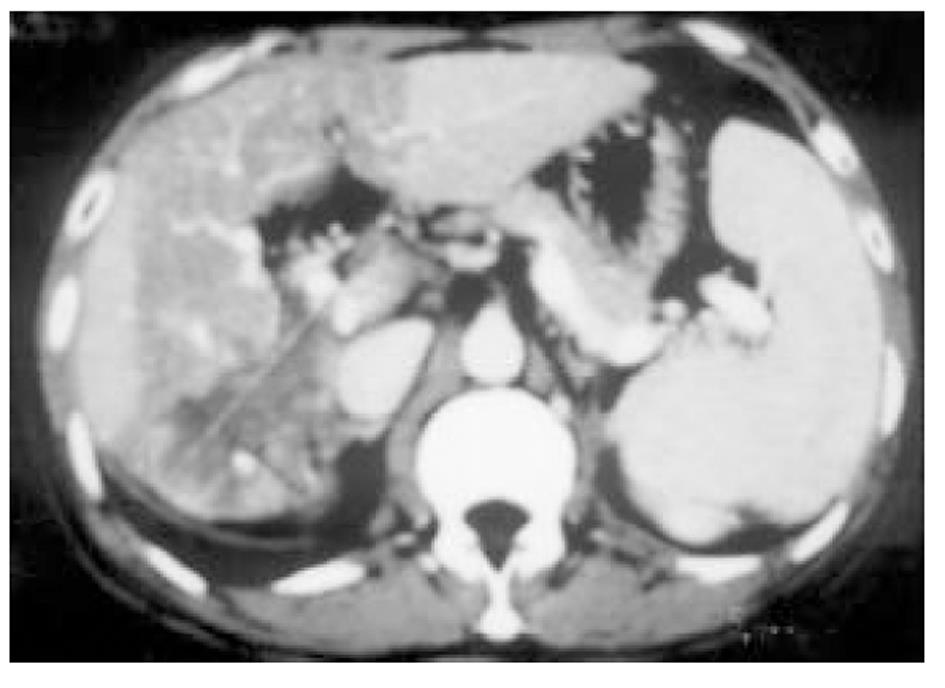
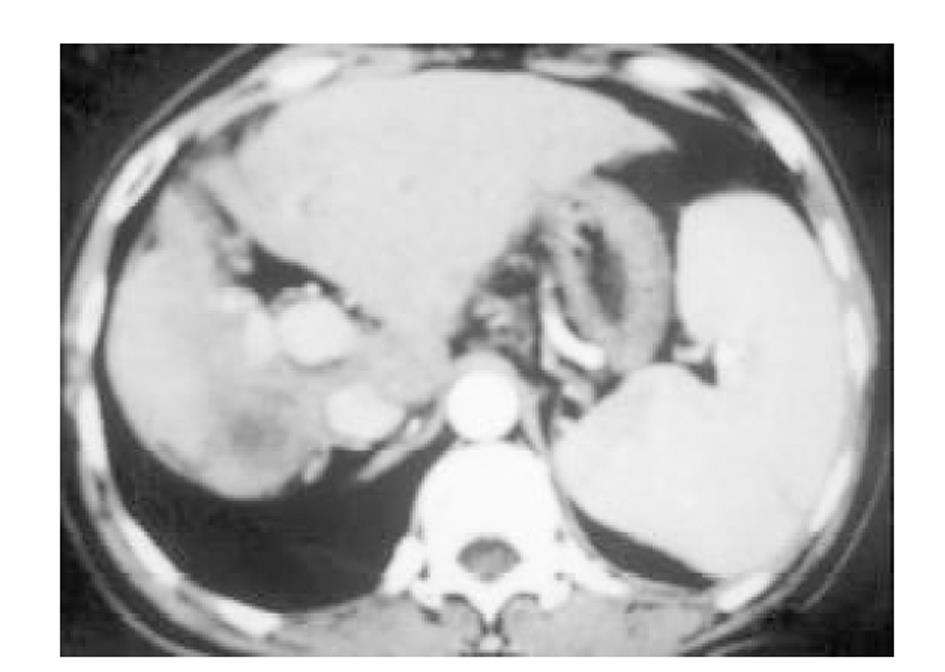
使用CRYOCARE SURGICAL SYSTEM(CRYO-20型)冷冻外科系统. 治疗刀直径分别为2、3、5、8 mm, 依据瘤体大小、形状、部位等分别予单独或组合使用. 一般认为2、3、5 mm的冷冻刀在活体肝脏实质内持续冷冻15-20 min可产生2.5×4.5 cm、3.5×6 cm、6×7 cm冷冻坏死区[3]. 术前基础麻醉为0.5 mg阿托品或10 mg 654-2和吗啡10 mg或度冷丁100 mg皮下或肌肉注射. 首先以B超探头行肿瘤术前定位, 按需要摆体位, 选择进针点及进针方向, 按常规消毒铺无菌巾单, B超引导下于肋间或肋缘下进带芯穿刺针, 将针尖穿刺进入肿瘤底部后拔除内芯, 引入金属导丝后再拔除穿刺针, 通过导丝经皮引入鞘管套后抽出内芯, 将氩氦刀顺着穿刺鞘插入肿瘤固定, 根据肿瘤区域将穿刺鞘外拔3-5 cm, 不同角度的进针均依以上顺序操作, 开启氩氦刀冷冻系统电脑主机, 刀尖区域应在1 min内降至-120 °C以下, 持续冷冻15-20 min, 将冰球范围超过肿瘤边缘1 cm以上, 开启氦气加热系统直至将温度加热至30 °C以上再重复一次冷-热循环, 结束后B超引导下以明胶海绵及止血生物胶填塞穿刺道止血(图1-4). 冷冻手术成功的关键是多刀组合使得冷冻产生的冰球完整覆盖肿瘤组织并超过其边缘1 cm, 防止术后并发症的关键是良好的止血技巧. 所有患者定期随访, 随访时间为3 mo-1 a, 影像学观察肿瘤有无复发及大小变化、血清肿瘤标志物监测及近期和远期并发症和副作用. 肿瘤根治标准: 血清肿瘤标记物阳性者术后(1-2 mo)转阴; MRI或CT等影像资料提示肿瘤坏死、无明确存活病灶(图5-10).
小肝癌(≤5 cm)共计13例, 包括2例系术后复发病灶. AFP阳性(10例)治疗后转阴性8例, 转阴率为80%. AFP阴性小肝癌共3例, 治疗后CT、MRI提示未见明确存活病灶的2例, 占66.7%, 大肝癌(>5 cm)共8例, 治疗后AFP转阴性或CT、MRI提示肿瘤完全坏死2例, 占25%. 转移性肝癌共10例, 治疗后肿瘤标志物降至正常或CT、MRI提示完全坏死5例, 占50%. 随访3-12 mo, 期间5例患者死亡, 其中3例系肿瘤未控制、广泛播散所致, 1例因肝功能衰竭死亡, 1例因突发心脏病死亡. 全组未发现术中、术后严重并发症; 较常出现的问题包括: (1)由于多刀组合冷冻范围过大导致术中全身体温下降而致寒颤及心率减慢6例. (2)术中皮肤表面由于接触冷冻刀杆而致皮肤冻伤8例. (3)25例术后局部疼痛、呕吐、轻度发热不适, 但并不严重. (4)31例术后肝功能均有轻度损伤如血清酶谱异常等, 经常规保肝治疗均可恢复. 未发现术后穿刺道出血、胆瘘、血管损伤、感染等严重并发症. (5)胸腔积液, 本组6例出现术后右侧胸腔积液, 均为中等量以下, 未影响呼吸, 未行胸腔穿刺抽液.
肝癌在我国是常见肿瘤疾病, 就诊时多已属晚期, 治疗仍有困难[16-24]. 氩氦刀(cryocare surgical system)有4或8个能单独或组合应用的热绝缘超导刀, 超导刀中空, 可输出高压氩气, 并籍高压氩气在刀尖的快速膨胀作用而使病变组织快速降温, 而当输出高压氦气时, 又使冰球在数分钟内解冻及迅速升温. 由于氩氦刀制冷或加热均局限于超导刀尖端一定区域内, 刀杆有良好的冷热绝缘性, 因此不会对穿刺路径上的组织产生严重损伤. 氩氦刀的温差电偶直接安装于刀尖, 可连续监测刀尖温度. 另有4-8个独立测温探针可实时监测冷冻区域边缘的温度以便于控制冷冻速度及范围, 使冷冻治疗即使在大血管周边也是安全有效[27]. AFP阳性小肝癌治疗后转阴率为80%, AFP阴性小肝癌治疗后CT、MRI检查坏死率达66.7%, 大肝癌治疗后AFP转阴或CT, MRI提示肿瘤完全坏死的亦达25%. 国外报道转移性肝癌行冷冻治疗较多[26,28,29], 本组转移性肝癌治疗后瘤标降至正常或CT, MRI复查肿瘤完全坏死未见明确复发病灶的达50%. 说明经皮穿刺氩氦刀冷冻治疗对于不适合行手术治疗的小肝癌具有良好的治疗效果, 对于>5 cm的大肝癌, 配合TACE治疗等[30], 仍具有相当的治愈率并能明显延长患者生存期. 氩氦刀冷冻治疗肝脏恶性肿瘤具有创伤小, 恢复快, 疗效好等特点. 但由于肿瘤三维形状及氩氦刀经皮穿刺治疗所能达到区域的匹配等问题, 并非所有肝癌患者都适合. 适应证: 肝脏恶性肿瘤直径≤5 cm, 数目不超过3个, 肝功能分级为Child A或B; 肿瘤直径>5 cm的大肝癌多刀组合冷冻与TACE或局部放疗相结合仍能取得良好效果甚至根治; (3)肿瘤位于大血管边上或肝门部位, 直径≤5 cm, 手术有困难或风险较大者. 可能出现的副作用和并发症有: (1)肝癌病灶在肝表面时, 冷冻可能会引起肝包膜破裂造成术中术后出血, 如冷冻范围较大, 最好采用术中直视下操作以便于止血. (2)术后出血是一个严重并发症, 据报道发生率为1%, 根据我们的操作经验, 只要掌握经皮肝内穿刺道填塞止血法, 可以避免该并发症; 我们曾以5 mm直径冷冻刀配以15F外鞘行多例经皮穿刺冷冻治疗, 未发生术后出血. (3)大范围冷冻术后出现的肌红蛋白尿是常见的, 但只要予输液、利尿剂、碱化尿液等治疗, 均未发生严重肾功能受损情况. (4)胆管损伤、胆瘘. 冷冻肝门部肿瘤时可能致胆管损伤, 但由于胆管位于Glisson鞘内, 鞘内有门脉, 肝动脉的血液快速流动而导致带走"冷冻量", 因此胆管损伤并不常见. (5)皮肤冻伤及肝功能轻度损害 由于快速致冷常使氩氦刀杆温度亦快速降低, 如与皮肤表面接触易致轻度冻伤, 常表现为皮肤水泡, 予局部消毒包扎保持干燥等常很快痊愈. 肝功能损害一般均较轻, 常表现为血清谷丙转氨酶和谷草转氨酶升高, 予输液、保肝药物应用后均很快恢复正常. (6)胸腔积液, 本组6例出现术后右侧胸腔积液, 均为中等量以下, 未影响呼吸, 未行胸腔穿刺抽液. (7)国外有报道肝冷冻术后出现肝脓肿及肺部损伤[1,25], 本组未发生此类并发症.
总之, 根据我们的临床治疗经验, 对于肿瘤直径在5 cm以下的、数目在3个以内未能行手术切除的肝脏恶性肿瘤, 经皮穿刺氩氦刀冷冻治疗术是一种疗效确实、安全的微创治疗方法, 而对于直径在5 cm以上的大肿瘤, 行多刀组合冷冻治疗, 配合TACE介入治疗和放射治疗等亦可取得良好的疗效.
| 1. | Chapman WC, Debelak JP, Wright Pinson C, Washington MK, Atkinson JB, Venkatakrishnan A, Blackwell TS, Christman JW. Hepatic cryoablation, but not radiofrequency ablation, results in lung inflammation. Ann Surg. 2000;231:752-761. [PubMed] [DOI] |
| 2. | Bilchik AJ, Wood TF, Allegra D, Tsioulias GJ, Chung M, Rose DM, Ramming KP, Morton DL. Cryosurgical ablation and radiofrequency ablation for unresectable hepatic malignant neoplasms: a proposed algorithm. Arch Surg. 2000;135:657-662. [DOI] |
| 3. | Popken F, Seifert JK, Engelmann R, Dutkowski P, Nassir F, Junginger T. Comparison of iceball diameter and temperature distribution achieved with 3-mm accuprobe cryoprobes in porcine and human liver tissue and human colorectal liver metastases in vitro. Cryobiology. 2000;40:302-310. [PubMed] [DOI] |
| 4. | Siperstein AE, Berber E. Cryoablation, percutaneous alcohol injection, and radiofrequency ablation for treatment of neuroendocrine liver metastases. World J Surg. 2001;25:693-696. [PubMed] [DOI] |
| 5. | Ruers TJ, Joosten J, Jager GJ, Wobbes T. Long-term results of treating hepatic colorectal metastases with cryosurgery. Br J Surg. 2001;88:844-849. [PubMed] [DOI] |
| 6. | Gignoux BM, Ducerf C, Mabrut JY, Rivoire M, Rode A, Baulieux J. Cryosurgery of primary and metastatic cancers of the liver. Ann Chir. 2001;126:950-959. [DOI] |
| 7. | Mala T, Edwin B, Samset E, Gladhaug I, Hol PK, Fosse E, Mathisen O, Bergan A, Soreide O. Magnetic-resonance-guided percutaneous cryoablation of hepatic tumours. Eur J Surg. 2001;167:610-617. [PubMed] [DOI] |
| 8. | Nakazaki H, Watanabe M, Hasebe Y, Takita W, Ooshiro M, Seo A, Kurihara A, Kobayashi K, Teramoto T, Hirano K. Percutaneous cryosurgery for liver tumors. Gan To Kagaku Ryoho. 2001;28:1599-1602. [PubMed] |
| 9. | Bischof JC. Quantitative measurement and prediction of biophysical response during freezing in tissues. Annu Rev Biomed Eng. 2000;2:257-288. [PubMed] [DOI] |
| 10. | Berger WK, Poledna J. New strategies for the placement of cryoprobes in malignant tumors of the liver for reducing the probability of recurrences after hepatic cryosurgery. Int J Colorectal Dis. 2001;16:331-339. [PubMed] [DOI] |
| 11. | Samset E, Mala T, Edwin B, Gladhaug I, Soreide O, Fosse E. Validation of estimated 3D temperature maps during hepatic cryosurgery. Magn Reson Imaging. 2001;19:715-721. [DOI] |
| 12. | Barnett CC Jr, Curley SA. Ablative techniques for hepatocellular carcinoma. Semin Oncol. 2001;28:487-496. [DOI] |
| 13. | Mala T, Frich L, Edwin B, Samset E, Hol PK, Fosse E, Mathisen O, Bergan A, Soreide O, Gladhaug I. Cryoablation-a treatment option for inoperable liver tumors? Tidsskr Nor Laegeforen. 2001;121:2510-2515. [PubMed] |
| 21. | Chen MS, Li JQ, Zhang YQ, Lu LX, Zhang WZ, Yuan YF, Guo YP, Lin XJ, Li GH. High-dose iodized oil transcatheter arterial chemoembolization for patients with large hepatocellular carcinoma. World J Gastroenterol. 2002;8:74-78. [DOI] |
| 22. | Zhao WH, Ma ZM, Zhou XR, Feng YZ, Fang BS. Prediction of recurrence and prognosis in patients with hepatocellular carcinoma after resection by use of CLIP score. World J Gastroenterol. 2002;8:237-242. [DOI] |
| 23. | Qin LX, Tang ZY. The prognostic significance of clinical and pathological features in hepatocellular carcinoma. World J Gastroenterol. 2002;8:193-199. [PubMed] [DOI] |
| 24. | Tang ZY. Hepatocellular carcinoma-cause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [DOI] |
| 25. | Riley DK, Babinchak TJ, Zemel R, Weaver ML, Rotheram EB. Infectious complications of hepatic cryosurgery. Clin Infect Dis. 1997;24:1001-1003. [DOI] |
| 26. | Rivoire M, Voiglio EJ, Kaemmerlen P, Molina G, Michot JP, Finzy J, Delay E. Cryosurgery of liver neoplasms. Ann Chir. 1997;51:54-59. [PubMed] |
| 27. | Weber SM, Lee FT Jr, Chinn DO, Warner T, Chosy SG, Mahvi DM. Perivascular and intralesional tissue necrosis after hepatic cryoablation: results in a porcine model. Surgery. 1997;122:742-747. [DOI] |
| 28. | Junginger T, Seifert JK, Weigel TF, Heintz A, Kreitner KF, Gerharz CD. Cryotherapy of liver metastases Initial results. Med Klin. 1998;93:517-523. [DOI] |
| 29. | Pearson AS, Izzo F, Fleming RY, Ellis LM, Delrio P, Roh MS, Granchi J, Curley SA. Intraoperative radiofrequency ablation or cryoablation for hepatic malignancies. Am J Surg. 1999;178:592-599. [DOI] |
| 30. | Clavien PA, Kang KJ, Selzner N, Morse MA, Suhocki PV. Cryosurgery after chemoembolization for hepatocellular carcinoma in patients with cirrhosis. J Gastrointest Surg. 2002;6:95-101. [DOI] |