修回日期: 2002-10-20
接受日期: 2002-11-29
在线出版日期: 2003-06-15
胶原含量多少可以直接反映肝脏纤维化程度之轻重, 胶原蛋白含量测定在肝纤维化机制与药理研究中极其重要, 往往是结果分析的"终点指标". 综述肝脏胶原蛋白的生化与病理检测方法, 结合个人实践体会, 分析其各种不同方法的特点及适应范围. 认为肝组织胶原蛋白以羟脯氨酸含量检测可靠, 培养细胞总胶原分泌宜采用同位素掺入与胶原酶消化的方法, 各型胶原分泌量可采用ELISA法, 各型胶原沉积量可采用Western blot法. 肝组织与培养细胞胶原病理染色, 主要用于胶原蛋白定性分析与表达位置检测, 正确应用图像分析可半定量.
引文著录: 刘成海. 肝脏胶原蛋白检测进展与评析. 世界华人消化杂志 2003; 11(6): 689-692
Revised: October 20, 2002
Accepted: November 29, 2002
Published online: June 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(6): 689-692
- URL: https://www.wjgnet.com/1009-3079/full/v11/i6/689.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i6.689
胶原是细胞外基质(extracellular matrix, ECM)的主要蛋白质成分, 约占机体总蛋白的25%[1]. 多细胞器官中的多数细胞均与ECM大分子密切联系, ECM不仅为细胞提供结构支架, 而且也是重要的信号调节分子, 能调控细胞的生长、代谢与分化. 肝脏中胶原含量丰富, 对肝细胞的分化、肝小叶结构与功能的维持等有重要影响. 慢性肝炎、肝硬化等慢性肝病均存在着以胶原为主的ECM增生沉积的病理变化, 即肝纤维化. 研究表明[2], 肝星状细胞(hepatic stellate cell, HSC)在肝损伤后, 活化为"肌成纤维样细胞(myofibroblast like cell, MFB)", 大量合成与分泌间质性胶原等ECM, 是肝纤维化的细胞学基础. 肝纤维化时, 胶原等ECM成分的数量与分布位置均发生改变, 表现为数量增加3-5倍, 内皮下间隙(狄氏间隙)胞外基质成分从正常的低密度基底膜样基质向以纤维胶原为主的间质性胶原转变. 这种胶原的数量与分布的改变, 明显影响肝脏的结构与功能. 因此, 准确、合理分析肝脏胶原的含量变化, 在肝纤维化机制研究与抗肝纤维化药物评价中均有重要意义. 但是, 胶原类型较多, 结构稳定, 多难溶于水, 一般化学方法不易区分, 迄今国内外尚未见稳定的试剂盒. 本文就常用的肝脏胶原分析方法简要归纳, 并就各自特点与优缺点评述于下.
迄今已确定了19种不同基因的胶原类型[1,2], 以发现先后的时间顺序、冠以罗马字母命名. 胶原的分子结构特征是由3条左手螺旋α肽链绞合成右手旋转的超三螺旋. 胶原既可由相同的3条α链组成, 如III型胶原由3条α1(III)链组成[α1(III)], 也可由不同的α链组成, 如I型胶原由2条α1(I)21条α2(I)]链组成[α1(I)2α2(I)]. 尽管不同类型胶原的α链是特定基因的表达产物, 但其一级结构均为"Gly-X-Y"(X多为Pro, Y多为Hyp). "羟化"是胶原蛋白转录后的修饰特点, 通过脯氨酸或赖氨酸羟化酶使脯氨酸或赖氨酸残基加上羟基. 羟脯氨酸羟基通过分子间氢键起稳定胶原螺旋结构的作用; 羟赖氨酸羟基则提供糖类分子的附着位点, 并在胶原分泌至胞外后, 通过赖氨酸氧化酶在羟赖氨酸、赖氨酸之间醛基缩合, 发挥稳定胶原分子间交连的作用. 间质性胶原成纤维索状, 具有弹性与韧性, 多起维持组织结构作用; 基底膜胶原多为筛状, 具有过滤功能.
肝脏中主要有5类胶原[3], 间质性胶原包括I, III, V, VI等, 基底膜胶原有IV型胶原. 正常人肝脏胶原约占肝重的2%, 肝硬化时上升至8-10%. 正常人肝脏胶原中I, III, IV, V, VI型胶原含量分别为42.5%、39.5%、6.9%、10.6%与0.6%, 肝硬化时分别为56.5%、28.0%、5.5%、9.6%与0.5%, 以I型胶原显著增加为特征. 位置分布上, I、III型等间质胶原多分布于汇管区与大血管区, IV型胶原主要分布于肝窦狄氏间隙. 肝脏慢性损伤时, I型胶原显著增多, 使正常肝内I/III型胶原比例倒置, 取代狄氏间隙的IV胶原, 导致肝窦毛细血管化与肝纤维化.
羟脯氨酸是肝脏胶原蛋白所特有的氨基酸, 因此测定羟脯氨酸含量, 可明确胶原总体水平. 该方法是分析组织胶原水平的标准方法, 有水解、衍生与检测等3个过程. 水解, 即在组织蛋白质样品中加入浓盐酸(6 mol/L), 真空状态下高温(105 °C左右)反应18-24 h, 将胶原的一级结构破坏, 使蛋白质分解为氨基酸, 而后将水解液烘干, 蒸发掉盐酸. 水解的完全与否, 对羟脯氨酸测定结果影响很大. 但该方法较为烦琐, 且酸雾对烘箱等设备有腐蚀影响. 1982年Stein提出气相水解法[4], 而后Waters公司推出了商品化仪器-气相水解工作台, 其基本过程是将100-500 pM的蛋白质或多肽样品置于水解试管中冷冻抽干, 在水解反应器中加入200 μl浓盐酸与2%苯酚, 然后将反应试管转移到反应器中抽真空110 °C反应22 h. 该改进方法无需烘干, 并可减轻腐蚀与提高工作效率.
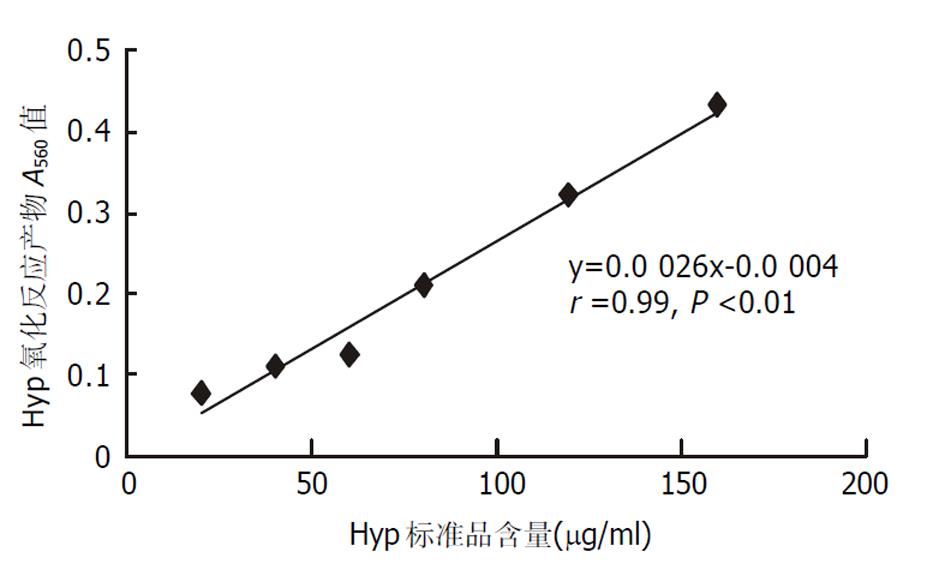
衍生, 即水解液与同其他化合物反应生产有颜色的化合物. 其原理是基于酸性水解液中4-羟脯氨酸经氯铵T氧化, 而后与欧氏溶液[25%(w/v)对二甲基氨基甲苯、27.3%(v/v)高氯酸的异丙醇溶液]反应生成吡咯样物质. 通过高效液相色谱(high performance liquid chromatography)或分光光度计比色, 可检测其水解液中羟脯氨酸的含量. 检测主要是化学比色法, 除分光光度计外, 无需其他特殊设备与技术, 简单易行. 1950年代建立, 后在1980年代经Jamall et al [5]改良, 更为简便可靠, 是常用的方法. 羟脯氨酸与反应产物吡咯正相关, 通过测定反应液中吡咯在最大吸收峰(λmax560)处的吸光度(A)值, 并通过羟脯氨酸标准品建立外标准, 即羟脯氨酸与最终反应产物吸光度值的直线回归方程, 可计算出样品的4-羟脯氨酸含量. 外标准中羟脯氨酸与吡咯吸光度呈良好的线性关系, 显著正相关, 我们多次实验均得到很好的重复性结果, 图1.
Jamall要求羟脯氨酸标准品新鲜配置, 但我们发现50%异丙醇溶解的标准品溶液4 °C放置过夜后溶解性与灵敏性更好, 而且相当稳定, 超过半年仍可很好的重复使用. 我们采用化学比色法检测正常肝脏组织羟脯氨酸含量大致为 (20360) μg/g肝组织, 二甲基亚硝胺纤维化大鼠中含量为 (37066) μg/g肝组织[6,7], 四氯化碳纤维化大鼠中含量为 (24148) μg/g肝组织[8]. 但是化学比色法灵敏度较低, 只可检测到1 μg(7.6 nmol)以上的4-羟脯氨酸, 多适用于胶原丰富的肝组织大样品, 不宜于细胞培养小样品. 此外, 不能区分测定羟脯氨酸的同源异构体-3-羟脯氨酸. 而后发展改进的高效液相色谱法则弥补了这些缺点[9], 可较好区分测定3-羟脯氨酸与4-羟脯氨酸, 并将测量水平提高到pmol级. 但是其需要特殊的HPLC设备与技术. 此外, 虽然两种脯氨酸含量测定方法, 无需同位素标记, 可方便较好的检测肝组织胶原总体水平, 但是均需水解反应, 其强酸条件较为苛刻, 时间较长; 也无法区别不同类型的胶原含量.
胶原蛋白的翻译需要大量脯氨酸, 部分脯氨酸成为前胶原肽链的组成成分, 并经羟化修饰为羟脯氨酸. 因此, 通过脯氨酸掺入可了解胶原生成情况. 脯氨酸广泛存在于许多蛋白质中, 非为胶原蛋白所特有, 仅仅脯氨酸掺入并不能代表细胞的胶原生成[10]. 纯化的胶原酶可特异性切割胶原蛋白(-Pro-X↓-Gly-pro-, 箭头所指为酶切部位), 使之降解为小片断. 因此, 可首先通过同位素标记的脯氨酸掺入, 获得新生成的脯氨酸标记的总蛋白量(同位素掺入量); 而后通过胶原酶的特异降解, 区分胶原与非胶原蛋白. 通过计算胶原酶敏感蛋白即胶原蛋白在总蛋白的百分比, 即可测出细胞内的胶原合成率与细胞外胶原分泌率. 大致步骤与方法如下.
前胶原α肽链在胞内翻译后, 有一系列翻译后修饰, 其中之一是在脯氨酸-4-羟化酶(prolyl-4-hydroxylase, P4H)催化下, 在Pro残基的4位C原子上进行羟化. 该羟化酶有2个α亚基与2个α亚基组成, 其活性需Fe2+, α-酮戊二酸与抗坏血酸等参与. 常规的掺入反应为: 含1-5%胎牛血清的Dublecco改良培养液(dublecco's modified eagle's medium, DMEM), 5-20 mCi[2,3-3H]-Pro, 50 μg/ml的抗坏血酸, 温育细胞24 h. 其中抗坏血酸有抗氧化作用, 保持Fe2+在还原状态; 3H较35S半衰期长, 处理容易, 故多采用. 此外, 为防止非同位素标记Pro的竞争掺入, 提高[3H]Pro掺入效率, 细胞培养液采用缺乏Pro的DMEM.
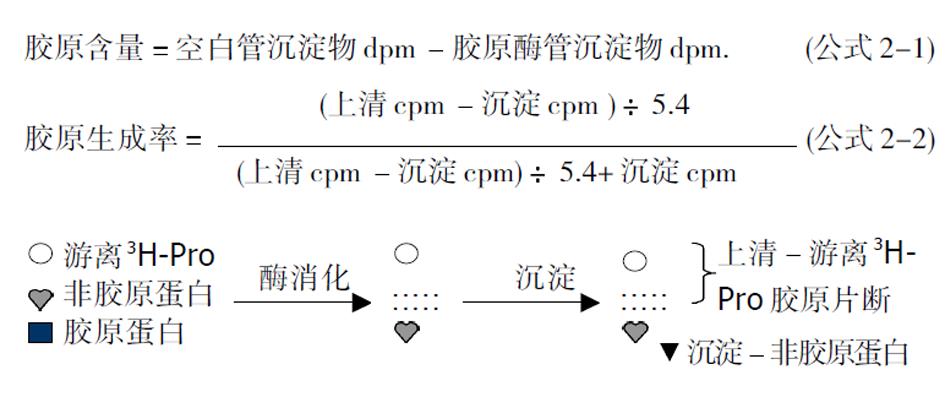
掺入后, 所收集的样本-无论培养上清还是细胞层蛋白, 均包括未掺入细胞的游离[3H]Pro与[3H]Pro掺入的总蛋白, 而该掺入总蛋白包括非胶原蛋白与胶原蛋白. 因此, 去除游离[3H]Pro的影响与区分非胶原蛋白, 是测定胶原生成率的关键. 非胶原蛋白可通过胶原酶消化而区分, 而去除游离[3H]Pro大致有以下2种方法. (1)透析后消化法: 透析去除游离[3H]Pro, 而后将样本进行消化[5](图2). 透析一般是将样本置于透析袋, 经25 mM Tris-HCl pH 7.4与50 mM乙酰马来醛透析液, 4 °C下透析3-4 d, 每天更换透析液, 直至透析液中放射性降至本底水平. 乙酰马来醛为蛋白酶抑制剂, 可防止样本蛋白的非特异降解. 透析后, 蛋白样本等分为3:1份不消化, 直接测定总蛋白含量; 1份加入胶原酶、CaCl2(胶原酶激活剂)与乙酰马来醛等, 37 °C下反应2 h, 以裂解胶原蛋白; 1份为空白对照, 消化反应中时不加胶原酶. 后2份经三氯醋酸沉淀与离心, 分离未被酶消化的非胶原蛋白, 离心上清即为胶原蛋白. 分别计数总蛋白的每分钟脉冲数(counts per minute, cpmt)、胶原蛋白(cpmc)与空白对照(cpmb)的放射性, 即可算出胶原生成率(公式1). 我们采用此法测定传一代培养肝星状细胞的胶原生成率, 分别为细胞内0.8-1.2%、细胞外2.5-4%. 而总蛋白中胶原蛋白的[3H]Pro掺入量分别为细胞内7.9%、细胞外12.8%左右[11]. 该方法无需对消化后沉淀的非胶原蛋白溶解与测定, 但是消化前的透析较烦琐, 时间较长, 重复性欠佳.
(2)直接消化法[12]: 不透析, 将样本等份为2:1份不加胶原酶, 为空白对照; 另一份加胶原酶消化. 而后经三氯醋酸沉淀, 离心, 分别取上清与溶解的沉淀物, 测定每分钟衰变率(disintegration, dpm)图3. 胶原绝对含量以空白管与胶原酶消化管沉淀物的数值计算. 胶原的生成率以胶原酶消化管的上清与沉淀物放射活性计算, 公式2. 该方法无需透析, 简易方便, 费时较短, 但是需要溶解沉淀的非胶原蛋白, 一般溶剂难以溶解, 可采用Packard公司的Soluene 350溶剂. 两种方法均不受接种细胞数量的影响, 可较好的反映细胞胶原生成情况, 但不适于整体动物体内与临床患者的胶原生成量分析.
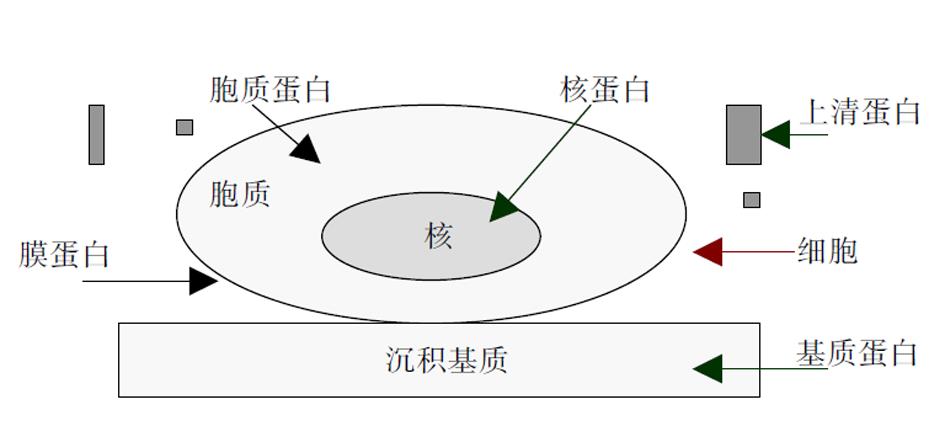
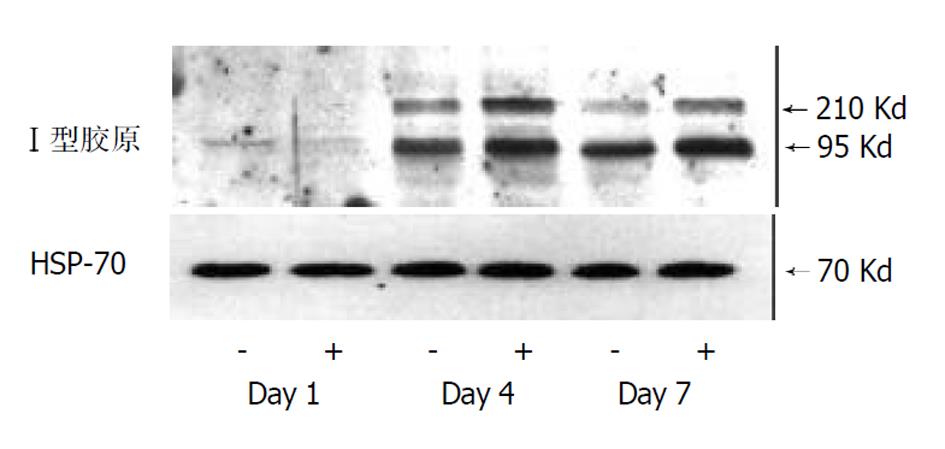
于培养细胞, 蛋白可分为上清蛋白、细胞蛋白(包括胞膜蛋白、胞质蛋白与核蛋白)、基质蛋白等多种, 图4. 因此根据蛋白样品的来源不同, 可以分别分析胶原分泌、细胞内胶原合成或细胞外胶原沉积量等. 即若采用培养上清, 则为分泌量; 若采用细胞粗提物, 则为细胞内生成量; 若采用培养器皿上沉积蛋白, 则为胶原沉积量. 蛋白样品制备后, 进行SDS-PAGE凝胶电泳, 使蛋白质因分子量大小而区分; 将凝胶转移到硝酸纤维素等膜上, 脱脂奶粉或牛血清蛋白封闭后, 经特异性胶原抗体(如I型胶原抗体)孵育结合, 洗涤未结合的抗体, 而后与偶联HRP或AKP酶的抗抗体结合, 经化学显色, X片曝光. 通过分子量位置可确定胶片上胶原蛋白表达条带. 此法定性与定量相结合, 特异性高, 灵敏度好, 结果直观明了. 且可通过标准分子量蛋白比较定位, 区分胶原蛋白的不同亚型. 蛋白表达量既可肉眼直观判断, 也可计算机图像分析扫描, 由于图片为黑白方式, 条带较规则, 无需二值分割, 采用图像分析软件即可较好分析蛋白表达量. 并且可设立严格的内参照, 排除样本上样量与转移效率等因素的影响, 即洗脱该膜胶原抗体后, 用"看家蛋白"抗体(如β-actin, β-tubulin, HSP-70等)在同一张膜上连续免疫结合呈色. 图5为用该法检测原代培养肝星状细胞的细胞内I型胶原蛋白表达. 但western blot方法需要一定的设备与技术.
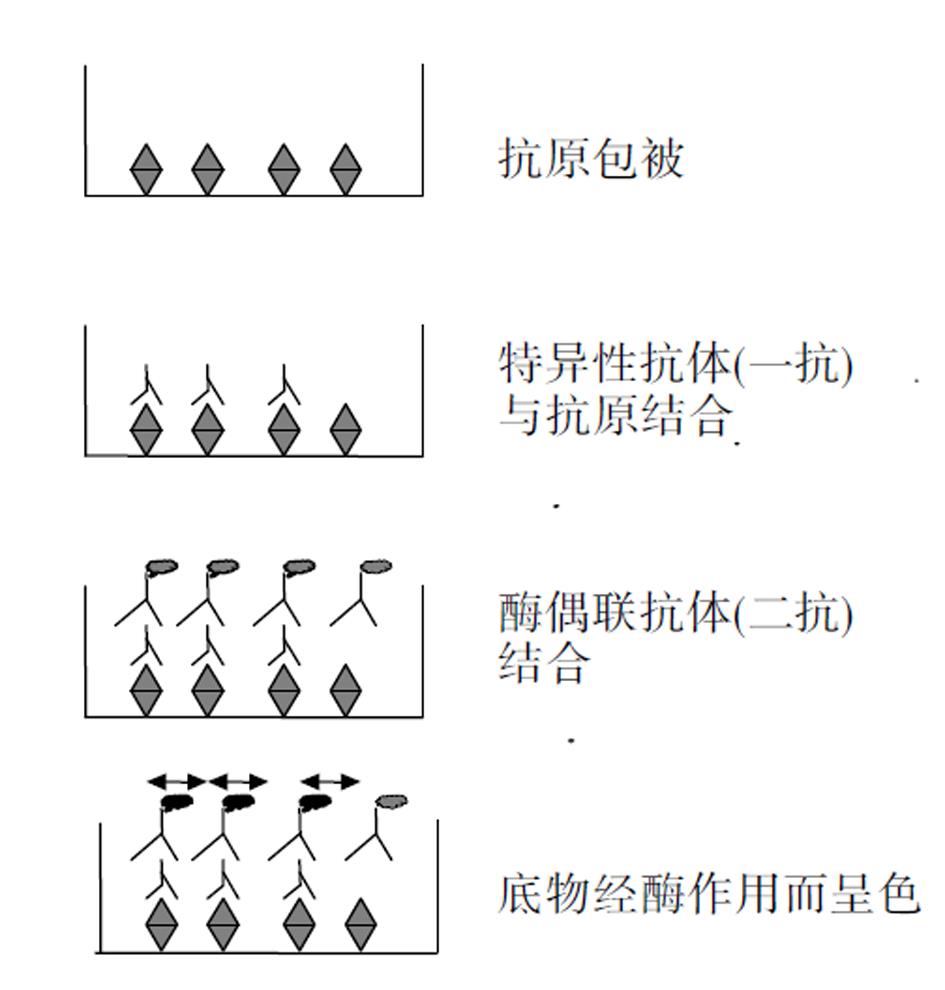
此法原理亦为免疫结合. 将目的胶原样本作为抗原包被于96孔板上, 与抗体结合, 再与HRP或AKP酶偶联的抗体结合, 经化学显色反应, 酶标仪读取吸光度值. 由于抗体-抗原抗体复合物-酶-底物显色之间有正相关关系, 故检测显色底物的吸光度值, 即可测知抗原(胶原)的相对含量[13]图6. 通过一定浓度梯度稀释胶原标准品建立外标准, 计算出胶原含量与最终显色产物之间的直线回归方程, 以此方程及样本反应的吸光度值, 即可计算出样本胶原的浓度. 该方法适合于体外细胞实验, 同样具有灵敏、特异的优点, 可以分析细胞上清或细胞内各型胶原的分泌量或合成量, 并且经细胞总蛋白或DNA浓度效正, 可以排除细胞数量的影响[14]. 缺点是每一步都需洗涤, 过程较长; 不适于组织标本; 样本的包被主要是物理结合, 不同材料间重复性较差.
既往病理组织化学与免疫组织化学观察多应用于定性研究, 随着形态定量方法的发展和计算机技术的普及, 图像分析仪器的广泛应用, 生物形态学向定量研究发展. 图像分析方法大致为: 首先将显微镜下的组织染色图像通过摄像头与图像采集卡录入计算机. 其次是在计算上选取所要分析的目标, 因免疫组化染色蛋白呈一定颜色, 且因背景染色或衬染, 周围组织有不同颜色着色, 因此需要设定色彩的上下限阈值, 二值分割, 将目标蛋白质"伪彩色", 使之为计算机识别. 而后自动计算所识别对象的面积、灰度等参数值, 从而半定量组织目标蛋白的含量. 该方法简便易行、自动化程度高, 非常适合于临床肝组织等难以进行生化分析的小样组织标本, 随胶原染色方法的不同, 可以分别分析总胶原或各种不同类型的胶原含量. 目前用于图像分析的常见胶原病理染色方法有: (1)丽春红总胶原染色, 常规显微镜镜头下观察总胶原的变化; (2)天狼猩红染色, 偏振光下分别观察I、III型胶原的变化, 一般I型胶原呈黄红色, III型胶原呈绿色 ; (3)通过各种特异胶原抗体进行肝脏组织免疫组化染色, 分别观察各种不同型别胶原的变化.
这三种方法共同存在着随机取样时的抽样误差与二值分割时的背景干扰. 抽样误差包括组织取材部位, 图像采集视野等[15]. 而图像二值分割时, 目标染色蛋白区域的选取往往较大程度上受组织片背景的亮度强弱与颜色深浅, 组织片本身染色的深浅, 及其设定选取颜色范围的上限与下限等等多种因素影响, 所测光密度值也往往随之有较大范围波动. 此外需要指出的是, 天狼猩红染色+偏振光观察以区分I、III型胶原的方法目前有许多争议. Junqueira et al [16]于1978年采用该方法, 发现I型胶原呈黄色、桔黄或红色, III型胶原呈绿色. Nicoletti et al [17]证实了该发现, 我国也有学者采用该方法以鉴别I、III型胶原[18,19]. 但是Junqueira et al [20]在其后的文章强调了该方法对于胶原染色特异性, 没再提及鉴别胶原性质; 而Pierard et al发现该方法主要反应总胶原含量, 而不能区分胶原型别[21,22]. 然而, 无论何种病理染色方法, 主要在于反应胶原的分布位置与性质; 图像分析的干扰因素较多, 严格控制条件排除干扰, 可进行半定量, 可靠的定量分析仍需采用生化方法.
总之, 胶原含量多少可以直接反映肝纤维化程度之轻重, 其蛋白含量测定在肝纤维化研究中极其重要, 往往是"终点指标"(endpoint). 在实际应用中, 应根据具体情况与目标, 选择合适的方法.
承蒙上海中医药大学肝病研究所徐列明研究员与顾宏图助理研究员提供部分材料与宝贵意见, 特此致谢!
| 1. | 查 锡良, 胶 原, 陈 惠黎. 生物大分子的结构和功能. 上海: 上海医科大学出版社 1999; 113123. |
| 2. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [DOI] |
| 3. | Aycock RS, Seyer JM. Collagens of normal and cirrhotic human liver. Conn Tis R. 1989;23:19-31. [DOI] |
| 4. | Meltzer NM, Tous GI, Gruber S, Stein S. Gas-phase hydrolysis of proteins and peptides. Anal Biochem. 1987;160:356-361. [DOI] |
| 5. | Jamall IS, Fiinelli VN, Que Hee SS. A simple method to determine nanogram levels of 4-hydroxyproline in biological tissues. Anal Biochen. 1981;112:70-75. [DOI] |
| 9. | Lindblad W, Diegelmann RF. Quantitation of hydroxyproline isomers in acid hydrolysates by high-performance liquid chromatography. Anal Biochem. 1984;138:390-395. [DOI] |
| 12. | Eicklberg O, Kohler E, Reichenberger F, Bertschin S, Woodtli T, Erne P, Perruchoud AP, Roth M. Extracellular matrix deposition by primary human lung fibroblasts in response to TGF1 and TGF3. Am J Phisiol. 1999;276:L814-824. |
| 13. | Rennard SI, Berg R, Martin GR, Foidart JM, Robey PG. Enzyme linked immunoassay (ELISA) for connective tissue components. Anal Biochem. 1980;104:205-214. [DOI] |
| 16. | Junqueira LC, Cossermelli W, Brentani R. Differebtial staining of collagen type I, II and III by sirus red and polarization microscopy. Arch Histol Jpn. 1978;41:267-274. [DOI] |
| 17. | Nicoletti A, Heudes D, Hinglais N, Appay MD, Philippe M, Sassy-Prigen C, Bariety J, Michel JB. Left ventricular fibrosis in renovascular hypertension rats. Hypertension. 1995;26:101-111. [DOI] |
| 20. | Junqueira LC, Bionolas G, Brentani R. Picosirus staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J. 1979;11:447-455. [DOI] |
| 21. | Pierard GE. Sirus red polarization method is usedful to visualize the organization of connective tissue but not the molecular composition of their fibrous polymers. Matrix. 1989;9:68-71. [DOI] |
| 22. | James J, Bosch KS, Zuyderhoudt FM, Houtkooper JM, VanGool J. Histophotometric estomation of volume density of collagen as an indication of fibrosis in rat liver. Histochemistry. 1986;85:129-1. [DOI] |