修回日期: 2002-05-20
接受日期: 2002-06-14
在线出版日期: 2003-05-15
探讨mu、kappa阿片受体在泻剂结肠大鼠结肠中的变化.
以泻剂复制大鼠泻剂结肠模型, 观察泻剂结肠的mu、kappa阿片受体活性.
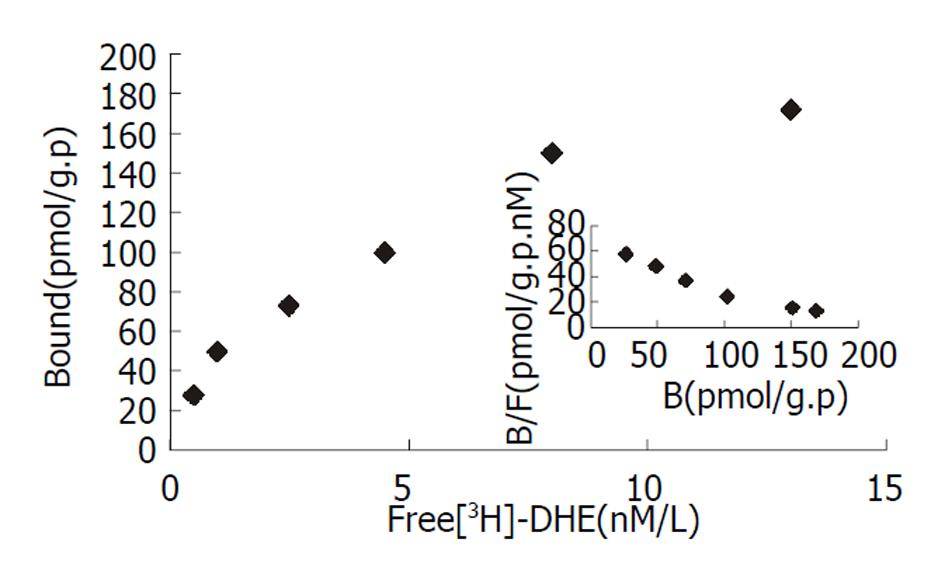
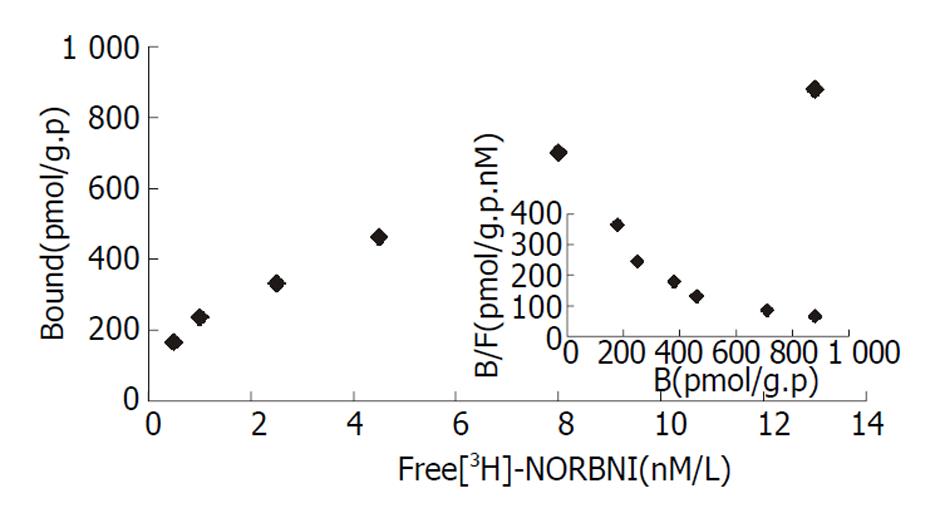
泻剂结肠的mu阿片受体的最大结合数和解离常数明显高于对照组(207.00±22.9 vs 82.00±4.23 fmol/mg.p, P<0.01; 3.30±0.45 vs 2.40±0.57 mmol/L, P<0.05). 与对照组相比, 泻剂结肠的kappa阿片受体最大结合数明显增高(957.00±102.41 vs 459.00±52.41 fmol/mg.p, P<0.01), 解离常数无明显的差异.
Mu, kappa阿片受体可能参与了泻剂结肠的功能紊乱, mu阿片受体较重要.
引文著录: 刘宝华, 莫平, 张胜本. 泻剂结肠大鼠结肠中的mu、kappa阿片受体变化. 世界华人消化杂志 2003; 11(5): 569-570
Revised: May 20, 2002
Accepted: June 14, 2002
Published online: May 15, 2003
To study the changes of mu and kappa opioid receptors in cathartic colon of rats.
An experimental rat model of cathartic colon was reconstructed by contact laxatives mixed with the feed. The activity of mu, kappa opioid receptors in cathartic colon of rats was determined.
The maximal binding capacity (Bmax) and affinity (Kd) of mu opioid receptor in cathartic colon of rats were significantly increased as compared with the control group(207.00±22.9 vs 82.00±14.23 fmol/mg.P, P<0.01; 3.300.45 vs 2.40±0.57 mmol/L, P<0.05). As compared with the control group, the maximal binding capacity of kappa opioid receptor was significantly increased (957.00±102.41 vs 459.00±52.41 fmol/mg.P, P<0.01), and no remarkable change of affinity was found in cathartic colon of rats.
The data indicates that mu and kappa opioid receptors may be involved in the disorder of cathartic colon, but the mu opioid receptor may be more important.
- Citation: Liu BH, Mo P, Zhang SB. Changes of mu and kappa opioid receptors in cathartic colon of rats. Shijie Huaren Xiaohua Zazhi 2003; 11(5): 569-570
- URL: https://www.wjgnet.com/1009-3079/full/v11/i5/569.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i5.569
慢传输性便秘(slow transit constipation, STC)是一类以结肠传输减慢为特点的顽固性便秘, 病因不明[1]. 以往发现长期接触性泻剂, 并导致结肠形态学发生明显的改变[2], 结肠肌间神经丛有明显的病理学改变[3]; 复制出的泻剂结肠的病理改变与慢传输便秘结肠壁相似. 我们采用泻剂结肠模型, 探讨mu、kappa阿片受体在大鼠泻剂结肠的变化, 以便明确内源性阿片肽在慢传输便秘发生中的作用.
大黄粉由重庆市中药厂提供.埃托啡(etoprihine)、mu阿片受体拮抗剂DHE、激动剂Damgo; kappa阿片受体拮抗剂Norbni、激动剂U50488H购自美国Sigma公司. mu阿片受体拮抗剂3H-DHE、kappa阿片受体拮抗剂3H-Norbni由中国北京原子能研究所标记. Wistar大鼠20只, 雌雄各半, 体质量23070 g. 分为对照组和泻剂结肠组, 泻剂结肠组为服用接触性泻剂大黄组. 对照组和"泻剂结肠"组各10只, 雌雄各半, 分组后各组间体质量无显著性差异.
各组的雌雄大鼠分笼喂养, 饲养环境温度18-28 ℃, 相对湿度40-80%. 对照组饲以普通软饲料.泻剂结肠组添加大黄粉, 起始剂量每日200 mg/Kg, 递增至每日1000 mg/Kg时约半数动物出现稀便. 维持此剂量直到稀便消失, 再按每日200 mg/Kg递增, 如此保持半数动物有下泻作用饲养3 mo. 大黄的终剂量为每日2400 mg/Kg. 动物饲养3 mo后约40%出现脱肛、血便. 动物停药5 d, 禁食24 h, 自由饮水. 分为正常对照组和泻剂结肠组, 每组6只动物. 大鼠击头处死, 取距回盲部5 cm的结肠, 放于冰冷的0.05 mol/L的Tris缓冲溶液中, 用Tris缓冲溶液冲洗掉肠内容物, 然后将肠管套在一玻璃棒上, 用湿棉球沿肠管纵轴擦破浆膜, 用湿棉球轻轻向两侧剥离, 将分离得到的肠肌条, 用滤纸吸干、称重, 加10倍量冰冷的0.05 mol/L Tris 缓冲溶液匀浆, 4 ℃, 1000 g离心10 min, 取上清液以20000 g离心20 min, 0.05 mol/L Tris 缓冲溶冲洗一遍后, 第2次离心, 取第2次离心的沉淀悬于0.05 mol/L Tris缓冲溶中, 用双缩脲法测定蛋白的含量, 再以该缓冲液稀释至5 g/L, -20 ℃储存备用. 每管含肌蛋白5 mg, 于肌蛋白中加入不同浓度的放射性配体, 放射性配体用0.01 mol/L HCl配制, mu阿片受体3H-DHE(比放1739 TBq/mol), kappa阿片受体加3H-NORBNI(比放888 TBq/mol), 浓度均为0.5-13 nmol/L. 并于非特异管中加入埃托啡1 mmol(etoprihine), 各管以缓冲溶液补足至总体积500 μl, 摇匀、温浴30 min, 立即置于冰浴中终止反应. 用49号玻璃纤维滤膜真空抽滤, 用冷缓冲液冲洗3次, 滤膜自然干后置于二甲苯闪烁液(5 g/L PPO, 3 g/L POPOP, 二甲苯)中, 测定放射性计数. 统计学处理根据Scatchard作图, 利用直线回归方程, 求出每克肌匀浆受体的最大结合数(Bmax)和反映受体的亲和力的解离常数(Kd).
统计学处理 所有的数据均以, 表示, 组间比较用Student's t 检验统计分析.
根据Scatchard作图, 正常大鼠结肠mu阿片受体的最大结合数(Bmax)为82.00±14.23 fmol/mg.p, 解离常数(Kd)为2.40±0.57 nmol/L. 泻剂结肠的mu阿片受体的Bmax为207.00±22.9 fmol/mg.p, Kd值为3.30±0.45 nmol/L(图1). 与对照组相比, 泻剂结肠组大鼠结肠mu阿片受体的最大结合数增加2.5倍, 亲和力增加1.4倍, 二者均明显增加(P<0.05, P<0.01).
根据Scatchard作图, 正常大鼠结肠Kappa阿片受体的Bmax为459.00±52.41pmol/g.p, Kd值为3.10±0.12 nmol/L. 泻剂结肠的kappa阿片受体的Bmax为957.00±102.53 pmol/g.p, Kd值为2.70±0.54 nmol/L (图2). 泻剂结肠组大鼠结肠Kappa阿片受体的最大结合数比对照组增加2.0倍, 差异非常显著(P<0.01); 与对照组相比, Kappa阿片受体的亲和力无明显的变化.
机体内源性阿片物质, 如脑肠肽、β-内啡肽和强啡肽等, 主要分布在肠系膜神经丛、肠肌层神经纤维及肠黏膜内分泌细胞. 此外大量分布在中枢神经系统中. 目前研究表明, 阿片肽对胃肠动力的影响主要通过mu, kappa, delta受体发挥作用.目前研究的证据有: 胃肠道含有mu, kappa, delta受体; 内源性阿片肽能抑制电场刺激引起的结肠肌条的收缩; 外周注射阿片肽受体激动剂抑制胃肠推动性, 降低结肠蠕动的频率; Su et al[5]报道阿片肽受体激动剂能使支配结肠的盆神经传入纤维对热和机械性刺激的敏感性降低. 阿片肽可能介导参与了抑制性非肾上腺能非胆碱能神经纤维递质的释放调控.
本结果表明, 与正常组相比, 泻剂结肠大鼠结肠的mu, kappa阿片受体最大结合数分别增加了2.5和2.0倍; mu阿片受体的亲和力也增加了1.4倍. 说明内源性阿片肽与mu, kappa阿片受体结合的位点增多, mu亲和力增强.结果导致内源性阿片肽对胆碱能神经、非肾上腺能非胆碱能神经产生抑制, 抑制结肠的神经肌肉的传动推动性蠕动减弱, 引起便秘. 阿片肽活性的变化是慢传输便秘的发病的一个重要因素, Kreek等用mu阿片受体拮抗剂纳洛酮治疗2例慢传输性便秘获得成功.本结果也说明用阿片受体拮抗剂是治疗慢传输性便秘的新途径. 进一步研究阿片受体的亚型、结合位点和全面的临床研究, 有可能突破慢传输便秘的难治性, 也可能较全面的阐明慢传输便秘的发病机制.
| 2. | Joo JS, Ehrenpreis ED, Gonzalez L, Kaye M, Breno S, Wexner SD, Zaitman D, Secrest K. Alterations in colonic anatomy induced by chronic stimulant laxatives: the cathartic colon revisited. J Clin Gastroenterol. 1998;26:283-286. [PubMed] [DOI] |
| 4. | Liu BH, Chen HS, Zhou JH, Xiao N. Effects of endotoxin on endothelin receptor in hepatic and intestinal tissues after endotoxemia in rats. World J Gastroenterol. 2000;6:298-300. [PubMed] |
| 5. | Su X, Julia V, Gebhart GF. Effects of intracolonic opioid receptor agonists on polymodal pelvic nerve afferent fibers in the rat. J Neurophysiol. 2000;83:963-970. [PubMed] [DOI] |