修回日期: 2002-11-09
接受日期: 2002-11-16
在线出版日期: 2003-05-15
用腺病毒为载体, 来研究p27kip1基因对食管癌的体内抑制作用.
用人食管癌细胞Eca109接种于裸鼠皮下, 原代生长后在鼠间传代, 再用组织块移植法构建食管癌裸鼠模型, 应用直接注射法, 将成功构建的携带人p27kip1基因的重组腺病毒及LacZ重组腺病毒导入裸鼠食管癌瘤体中, 与对照组比较, 绘制肿瘤生长曲线, 并计算肿瘤生长抑制率.
p27kip1基因治疗组肿瘤生长明显受到抑制, 与对照组比较, 有显著性差异(P<0.001), 肿瘤生长抑制率达64.1%.
腺病毒介导的p27kip1基因对食管癌具有较显著的体内抑制作用.
引文著录: 张卫国, 吴清明, 童强, 于皆平. 腺病毒介导的p27kip1对食管癌裸鼠模型抑制的作用. 世界华人消化杂志 2003; 11(5): 512-516
Revised: November 9, 2002
Accepted: November 16, 2002
Published online: May 15, 2003
To investigate the inhibitory effect of p27kip1 mediated by adenovirus vector on esophageal carcinoma in vivo.
Eca109 cells were injected into the subcutaneous tissue of nude mice to establish tumors. The transplanted tumors were reproduced among the nude mice contionually after original grafts grew well. The model of esophageal carcinoma in nude mice was established by transplanting the tumor tissue mass into the subcutaneous tissue of nude mice .The successful constructed recombinant adenoviral vector carrying p27kip1 gene and LacZ recombinant adenovirus were directly injected into the esophageal tumors in nude mice respectively. Compared with control group, the growth curves of tumor were drawed and the growth inhibition rates of tumor were calculated.
The growth of tumors in gene therapy group with p27kip1 was obviously suppressed, which had a significant difference compared with control group (P < 0.001). The growth inhibition rate of tumor reached 64.1%.
p27kip1 gene therapy mediated by adenovirus vector has significant inhibitory effect on esophageal carcinoma in vivo.
- Citation: Zhang WG, Wu QM, Tong Q, Yu JP. Inhibitory effect of p27kip1 mediated by adenovirus on model of esophageal carcinoma in nude mice. Shijie Huaren Xiaohua Zazhi 2003; 11(5): 512-516
- URL: https://www.wjgnet.com/1009-3079/full/v11/i5/512.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i5.512
食管癌常见, 其发生、发展涉及多个基因及分子水平的变化[1-12], 目前无论是传统的手术、化疗及放疗, 还是所进行实验研究的基因治疗, 都未能取得满意的疗效, 而针对细胞周期调控, 这一分子基因水平上癌变过程共同通道的治疗可能是食管癌防治的有效途径. p27kip1蛋白是新近发现[13]的一种重要的具有细胞周期负调控的因子, 使细胞停滞于G1期, 不能完成G1/S期转换, 增生受抑制. 我们以腺病毒为载体, 将p27kip1基因导入人食管癌裸鼠模型瘤体中, 来研究以p27kip1为目的基因, 恢复细胞正常的负性周期调控来治疗食管癌, 以探求一种有效的基因治疗新途径.
SPF级Balb/C裸小鼠、人食管癌细胞株Eca109均由中国医学科学院肿瘤研究所提供, 裸小鼠雌雄兼用, 4周龄. 293细胞购自中国科学院上海细胞库. pCMV5p27kip1由北京大学第一医院泌尿外科研究所王刚博士惠赠. pACCMVPLPA和PJM17由军事医学科学院二所吴祖泽院士惠赠. 大肠杆菌DH5a由北京大学第一医院心内科彭旭博士惠赠. Ad-LacZ由我院生命科学研究所提供. p27kip1cDNA及腺病毒PCR引物由赛百胜生物公司设计、合成. 内切酶KpnΙ, BamHΙ及T4DNA ligase购自华美生物工程公司, Lipofectamine, DMEM购自Gibco公司. CsCl购自Sigma公司. 特级新生小牛血清购自杭州四季青生物工程有限公司.
1.2.1 重组腺病毒载体的构建及扩增 将pCMV5p27kip1, pACCMVPLPA分别用KpnΙ, BamHΙ双酶切, 获得p27kip1cDNA及腺病毒片段, 以定向克隆方式用T4 DNA ligase连接, 连接产物为穿梭质粒pAd-p27kip1, Lipofectamine介导pAd-p27kip1与PJM17共转染293细胞, 制备出携带p27kip1基因的重组腺病毒载体Ad-p27kip1[14]. 将Ad-p27kip1直接感染293细胞, 293细胞为腺病毒E1区转化的人胚肾细胞, 培养条件为100 mL/L新生小牛血清的DMEM培养基, 在37 ℃, 50 mL/L CO2培养箱中培养, 用倒置相差显微镜观察细胞病变, 当90-100%细胞出现病变, 10-20%细胞脱落时, 收集细胞及病毒上清, 将病毒上清反复感染293细胞, 收集细胞. 取病毒上清200 μL, 加入等体积裂解液, 混匀, 煮沸20 min, 加入10 g/L蛋白酶K10 μL, 37 ℃水浴3 h, 加等体积酚/氯仿, 彻底混匀, 12000 r/min离心10 min, 吸取上清, 加1/10体积NH4AC, 2.5体积无水乙醇, 等体积异丙醇温放置沉淀DNA, 12000 r/min离心5 min, 去上清, 保留沉淀, 加1 mL 750 mL/L乙醇洗涤, 12000 r/min离心5 min, 去上清, 自然干燥, 加入三蒸水20 μL, 以此为DNA模板进行扩增鉴定. p27kip1引物上游: 5'-CCTAGAGGGCAAGTACGAGTG-3', 下游: 5'-GAAGAATCGTCGGTTGCAGGTCGCT-3'. 腺病毒引物上游: 5'-TCGTTTCTCAGCAGCTGTTG-3', 下游: 5'-CATCTGAACTCAAAGCGTGG-3'. PCR反应体系: 病毒DNA 10 μL, 引物各5 μL, 2 mmol/LdNTP 5 μL, Taq酶1 μL, MgCl2 2 μL, 10×PCR buffer 5 μL, 加水至反应终体积为50 μL, 用矿物油覆盖, 94 ℃变性5min, 然后94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 60 s, 循环30次, 最后72 ℃延伸10 min, 在8 g/L琼脂糖凝胶中将扩增产物进行电泳, 对病毒进行鉴定. 将细胞在-80 ℃与37 ℃之间反复冻融3次以释放出病毒, 用CsCl超速密度梯度离心2次提取病毒, 装入透析袋, 置入透析液(10 mmol/L Tris-HCl, 1mmol/LMgCl2, 100 mL/L甘油), 应用磁力搅拌器4 ℃透析2次进行纯化. 对纯化后的重组腺病毒用有限稀释法, 紫外分光光度计测定其滴度. Ad-LacZ为带有LacZ报告基因的重组腺病毒, 其扩增、纯化及滴度测定同上, 将含LacZ重组腺病毒的上清感染293细胞, 48 h后固定细胞, X-gal染色, 显微镜下蓝染的细胞, 即LacZ基因表达阳性的细胞.
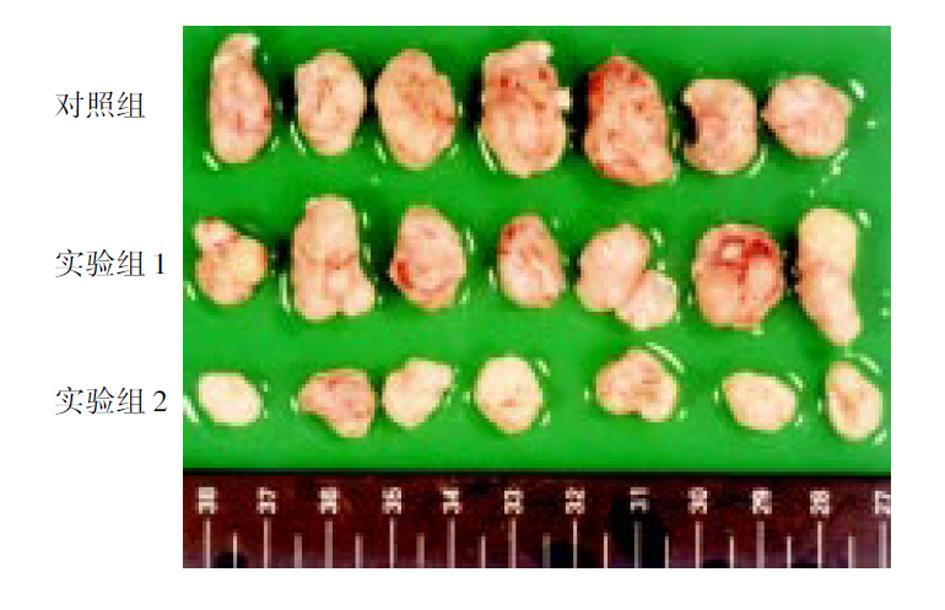
1.2.2 腺病毒介导的p27kip1对食管癌裸鼠模型抑制作用 人食管癌裸鼠模型的构建: 取对数生长期的人食管癌细胞Eca109, PBS清洗后制成每升含1×1010细胞悬液, 每只按0.1 mL接种于4周龄Balb/C裸小鼠皮下, 原代生长后在鼠间传代, 再取出瘤体, 将肿瘤制成0.3×0.3 cm的小块, 采用组织块移植法置入4周龄Balb/C裸小鼠右背侧皮下, 共36只, 动物饲养于中国医学科学院实验动物研究所, 清洁级动物室内, 裸鼠所用饲料、水及用具均经灭菌处理. 待肿瘤长至0.7 cm左右时, 取其中21只肿瘤体积较为均一的裸鼠, 随机分为3组, 每组7只, 采用肿瘤局部直接注射法, 对照组中每只裸鼠瘤体内注射PBS 0.1 mL, 实验组1中每只注射Ad-LacZ(病毒含量1010pfu)0.1 mL, 实验组2中每只注射Ad-p27kip1(病毒含量1010pfu)0.1 mL, 隔日注射1次, 共4次, 连续观察4 wk. 每3 d测量各组肿瘤体积1次, 绘制肿瘤生长曲线, 肿瘤近似体积按公式V = π/6[(A+B)/2]3计算(A, B分别为肿瘤的最长径、最短径). 4 wk后处死动物, 剥离肿瘤, 称质量, 按公式肿瘤生长抑制率(%) = (对照组肿瘤质量-实验组肿瘤质量)/对照组肿瘤质量×100%, 求出肿瘤生长抑制率.
统计学处理 采用t检验.
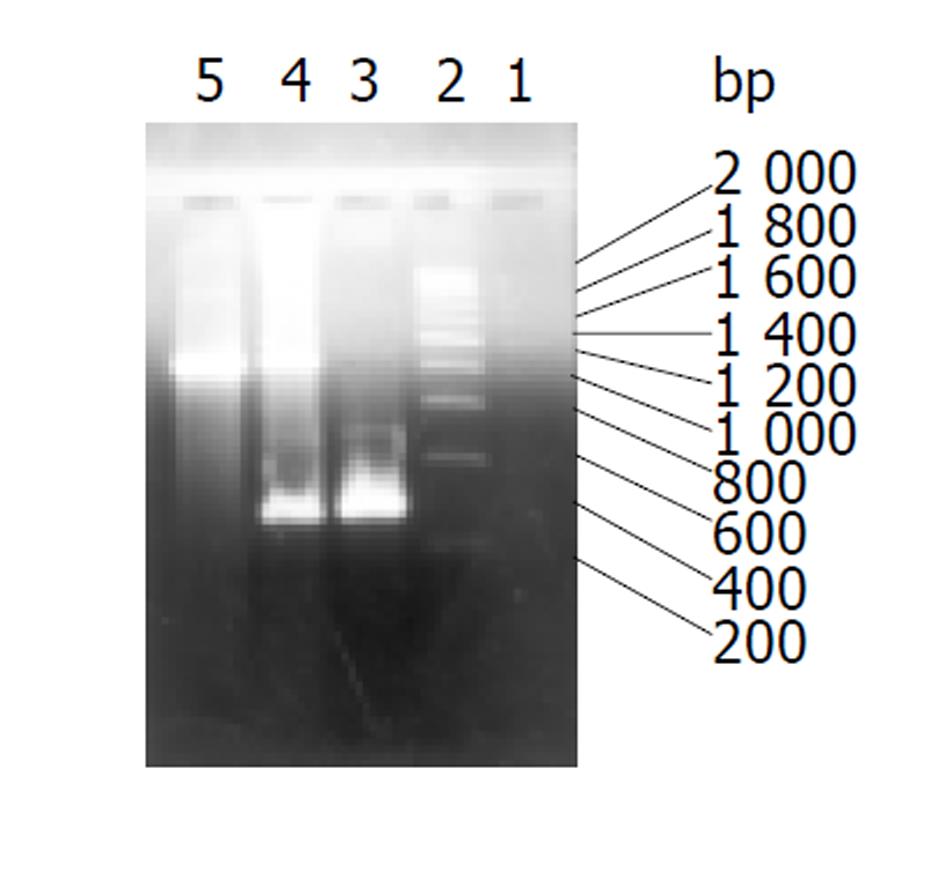
两种重组腺病毒感染293细胞后, 显微镜下均可见细胞变圆、聚集成团、呈葡萄串样病变改变(图1、图2), Ad-p27kip1 PCR鉴定结果见图3, 以pCMV5p27kip1为模板, 扩增出275 bp的p27kip1cDNA片段, 以pACCMVPLPA为模板, 扩增出860 bp的腺病毒基因片段, 以提取的病毒DNA为模板, 则同时扩增出275 bp的p27kip1cDNA片段和860 bp的腺病毒基因片段, 阴性对照组无PCR产物. Ad-p27kip1纯化后经测定, 其滴度为1.60×1015pfu/L, A260/A280>1.3. Ad-LacZ感染293细胞后, 经固定, X-gal染色, 显微镜下可见较多蓝染的细胞, Ad-LacZ纯化后经测定, 其滴度为1.48×1015pfu/L, A260/A280>1.3, 表明两种腺病毒均为实验所需重组腺病毒, 且滴度、纯度较高, 能满足基因治疗的需要.
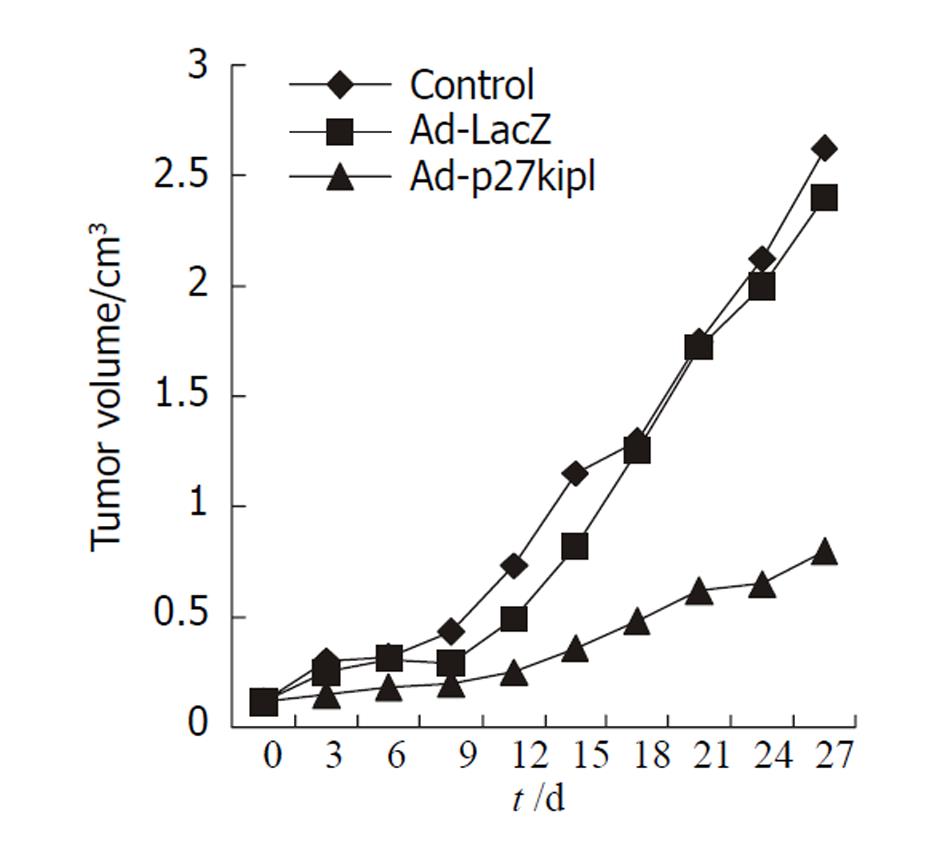
采用组织块移植法接种12 d后, 裸小鼠右背侧皮下均可见0.7 cm左右的肿瘤, 成瘤率达100%, 且动物生长状态良好. 治疗实验裸鼠连续观测4 wk, 动物生长状态较好, 无死亡. Ad-p27kip1组肿瘤生长显著慢于对照组, Ad-LacZ组则与对照组差异不明显(图4). 4 wk后处死动物, 剥离肿瘤, 称质量, Ad-p27kip1组瘤体质量显著低于对照组(0.42±0.08 g vs 1.17±0.30 g, P<0.001), 而Ad-LacZ组瘤体质量与对照组无明显差异(1.00±0.23 g vs 1.17±0.30 g, P>0.05), 肿瘤生长抑制率达64.1%(图5).
近年来, 基因治疗为肿瘤的防治带来了新的契机. p53基因治疗已从离体细胞实验过度到动物模型基因治疗, 并已步入临床实验阶段, 国内外学者对食管癌的体外、体内基因治疗的实验研究中, 将p53, p21, p16, Egr-1, FHIT, Cox-2, IL-2, VEGF, E2F-1, N116Y作为目的基因, 取得了一定的疗效[15-25], Shimada et al[26]报道以腺病毒为载体的p53治疗4例食管癌患者, 尚未发现不良反应. 但总体疗效尚不令人满意, 目前正积极寻求一种或几种能打断细胞癌变共同通道的组织特异性基因作为食管癌基因治疗的突破. p27kip1是一种抑癌基因, 其编码的蛋白属细胞周期蛋白依赖性激酶抑制蛋白(cyclin depentent kinase inhibitors, CDKI)Cip/Kip类, 主要作用于G1期, 抑制cyclin E-CDK2和cyclin D-CDK4等G1期激酶复合物, 使细胞不能通过G1期. 研究表明在食管癌中p27kip1表达下降, 与肿瘤细胞的分化程度正相关, 是食管癌的一个独立预后指标, 并认为p27表达下降是食管癌发生的早期事件[27-31]. 由于p27kip1的研究起步较晚, 以其作为目的基因的体外、体内治疗的研究不多见, 用于治疗食管癌几近未见报道, 实验表明以腺病毒为载体将p27kip1转染肺癌、肾癌、前列腺癌细胞后, p27kip1在肿瘤细胞内高表达, 细胞停滞于G1期, 凋亡增加, 细胞增生受阻, 导入裸鼠移植瘤内, 瘤体生长明显减慢[32-36], 其中Park et al [34]研究发现经治疗后有20%的肺癌裸鼠移植瘤完全消失, 国内学者将外源性p27kip1导入肝癌细胞中, 也发现细胞停滞于G1期, 生长明显受阻[37,38], 我们曾研究以腺病毒介导的p27kip1转染胃癌细胞株SGC-7901, 同样表明p27kip1能显著抑制细胞增生[39]. 以上表明P27kip1可以作为目的基因用于肿瘤的基因治疗.
我们以p27kip1为目的基因, 以腺病毒为载体, 采用直接注射, 体内治疗食管癌. 我们所选用的腺病毒载体缺少基因E1区, 而在他们的位置上加入了治疗基因, 由于病毒其他早期基因的表达需要E1区基因产物的协助, 所以病毒载体是不能自我复制的, 其装配细胞293细胞基因组内嵌有E1区基因片段, 并可持续表达E1蛋白, 为E1区置换的载体提供反式补偿, 这类载体能定位于细胞核DNA, 高水平表达外源性基因, 且病毒复制缺陷, 不整合入宿主基因组而极少致突变危险, 无野生型病毒污染, 较为安全. 我们的研究表明, 该治疗能有效抑制食管癌肿瘤的生长, 单基因治疗的抑瘤率达64.1%, 从肿瘤生长曲线上提示, 瘤体的生长后期较前期加快, 可能与p27kip1蛋白的本身的生物学特性有关, p27kip1蛋白被称为"短寿命蛋白", 其半衰期较, 而肿瘤细胞中泛素-蛋白酶体活性的增强, 更加速了p27kip1蛋白的降解[40], 另外蛋白激酶B在p27kip1胞核定位基序T157位置使其磷酸化, 使p27kip1潴留于胞质, 不能进入胞核而发挥其作用[41,42], 这些因素加上治疗后基因表达的快速衰退, 使得该治疗的肿瘤抑制效应受到一定的限制.
本研究表明, 腺病毒介导的p27kip1基因对食管癌具有较显著的体内抑制作用, 提示p27kip1可能是一种治疗食管癌较特异性的目的基因, 为基因治疗食管癌提供了一个新的方法, 相信随着对p27kip1研究的不断深入, p27kip1的基因治疗特别是联合多项基因治疗有望步入临床, 在食管癌的治疗上成为新的突破口.
感谢中国医学科学院陈志高、代金文、孙淑华、王艳荣、华克非、方金玉; 军事医学科学院吴祖泽; 北京大学王刚、彭旭的帮助.
| 1. | Wang LD, Zhou Q, Wei JP, Yang WC, Zhao X, Wang LX, Zou JX, Gao SS, Li YX, Yang C. Apoptosis and its relationship with cell proliferation, p53, Waf1p21, bcl-2 and c-myc in esophageal carcinogenesis studied with a high-risk population in northern China. World J Gastroenterol. 1998;4:287-293. [DOI] |
| 2. | Zhang LJ, Chen KN, Xu GW, Xing HP, Shi XT. Congenital expression of mdr-1 gene in tissues of carcinoma and its relation with pathomorphology and prognosis. World J Gastroenterol. 1999;5:53-56. [PubMed] [DOI] |
| 3. | Lin J, Deng CS, Sun J, Zhou Y, Xiong P, Wang YP. Study on the genetic susceptibility of HLA-DQB1 alleles in esophageal cancer of Hubei Chinese Hans. Shijie Huaren Xiaohua Zazhi. 2000;8:965-968. |
| 4. | Liu J, Chen SL, Zhang W, Su Q. P21WAF1 gene expression with P53 mutation in esophageal carcinoma. Shijie Huaren Xiaohua Zazhi. 2000;8:1350-1353. |
| 5. | Gu HP, Shang PZ, Su H, Li ZG. Association of CD15 antigen expression with cathepsin D in esophageal carcinoma tissues. Shijie Huaren Xiaohua Zazhi. 2000;8:259-261. |
| 6. | Qin HY, Shu Q, Wang D, Ma QF. Study on genetic polymorphisms of DCC gene VNTR in esophageal cancer. Shijie Huaren Xiaohua Zazhi. 2000;8:782-785. |
| 7. | Wu QM, Li SB, Wang Q, Wang DH, Li XB, Liu CZ. The expression of COX-2 in esophageal carcinoma and its relation to clinicopathologic characteristics. Shijie Huaren Xiaohua Zazhi. 2001;9:11-14. |
| 8. | Tan LJ, Jiang W, Zhang N, Zhang XR, Qiu DH. Fas/FasL expression of esophageal squamous cell carcinoma, dysplasia tissues and normal mucosa. Shijie Huaren Xiaohua Zazhi. 2001;9:15-19. |
| 10. | Hao MW, Liang YR, Liu YF, Liu L, Wu MY, Yang HX. Transcription factor EGR-1 inhibits growth of hepatocellular carcinoma and esophageal carcinoma cells lines. World J Gastroenterol. 2002;8:203-207. [DOI] |
| 11. | Xu M, Jin YL, Fu J, Huang H, Chen SZ, Qu P, Tian HM, Liu ZY, Zhang W. The abnormal expression of retinoic acid receptor-beta, p53 and Ki67 protein in normal, premalignant and malignant esophageal tissues. World J Gastroenterol. 2002;8:200-202. [DOI] |
| 12. | Wang AH, Sun CS, Li LS, Huang JY, Chen QS. Relationship of tobacco smoking CYP1A1 GSTM1 gene polymorphism and esophageal cancer in Xi'an. World J Gastroenterol. 2002;8:49-53. [PubMed] [DOI] |
| 13. | Polyak K, Kato JY, Solomon MJ, Sherr CJ, Massague J, Roberts JM, Koff A. p27kip1 , a cyclin-CdK inhibitor, links transforming growth factor-beta and contact inhibition to cell cycle arrest. Genes Dev. 1994;8:9-22. [DOI] |
| 14. | Tong Q, Wu QM, Huang YZ, Wang JN, Wang WM, Yu JP. Construction and assessment of replication deficient adenoviral vector containing the cDNA for human p27kip1. Med J Wuhan Univer. 2002;23:9-12. |
| 15. | Schrump DS, Chen GA, Consuli U, Jin X, Roth JA. Inhibition of esophageal cancer proliferation by adenovirally mediated delivery of p16INK4. Cancer Gene Ther. 1996;3:357-364. [PubMed] |
| 16. | Matsubara H, Koide Y, Sugaya M, Gunji Y, Asano T, Ochiai T, Takegana K, Sakiyama S, Tagawa M. Antitumor response of genetically engineered IL-2 expression to human esophageal carcinoma cells in mature T cell-defective condition. Int J Oncol. 1998;13:1217-1222. [DOI] |
| 17. | Gu ZP, Wang YJ, Li JG, Zhou YA. VEGF165 antisense RNA suppresses oncogenic properties of human esophageal squamous cell carcinoma. World J Gastroenterol. 2002;8:44-48. [DOI] |
| 18. | Wu MY, Chen MH, Liang YR, Meng GZ, Yang HX, Zhuang CX. Experimental and clinicopathologic study on the relationship between transcription factor Egr-1 and esophageal carcinoma. World J Gastroenterol. 2001;7:490-495. [DOI] |
| 19. | Ishii H, Dumon KR, Vecchione A, Trapasso F, Mimori K, Alder H, Mori M, Sozzi G, Baffa R, Huebner K. Effect of adenoviral transduction of the fragile histidine triad gene into esophageal cancer cells. Cancer Res. 2001;61:1578-1584. [PubMed] |
| 20. | Matsubara H, Maeda T, Gunji Y, Koide Y, Asano T, Ochiai T, Sakiyama S, Tagawa M. Combinatory anti-tumor effects of electroporation-mediated chemotherapy and wild-type p53 gene transfer to human esophageal cancer cells. Int J Oncol. 2001;18:825-829. [DOI] |
| 21. | Yang HL, Dong YB, Elliott MJ, Liu TJ, McMasters KM. Caspase activation and changes in Bcl-2 family member protein expression associated with E2F-1-mediated apoptosis in human esophageal cancer cells. Clin Cancer Res. 2000;6:1579-1589. [PubMed] |
| 22. | Senmaru N, Shichinohe T, Takeuchi M, Miyamoto M, Sazawa A, Ogiso Y, Takahashi T, Okushiba S, Takimoto M, Kato H. Suppression of Erk activation and in vivo growth in esophageal cancer cells by the dominant negative Ras mutant, N116Y. Int J Cancer. 1998;78:366-371. [DOI] |
| 23. | Fujii T, Tanaka Y, Tanaka T, Matono S, Sueyoshi S, Fujita H, Shirouzu K, Kato S, Yamana H. Experimental gene therapy using p21/WAF1 gene in esophageal squamous cell carcinoma denovirus infection and gene gun technology. Gan To Kagaku Ryoho. 2001;28:1651-1654. [PubMed] |
| 24. | Shimada H, Shimizu T, Ochiai T, Liu TL, Sashiyama H, Nakamura A, Matsubara H, Gunji Y, Kobayashi S, Tagawa M. Preclinical study of adenoviral p53 gene therapy for esophageal cancer. Surg Today. 2001;31:597-604. [PubMed] [DOI] |
| 25. | Guo WZ, Ran YL, Liu J, Yu L, Sun LX, Yang ZH. Enhancement by hypoxia of antisense VEGF(165) gene expression in esophageal cancer cells. Shengwu Huaxue Yu Shengwu Wuli Xuebao. 2002;34:625-629. |
| 26. | Shimada H, Matsubara H, Ochiai T. Gene therapy for esophageal cancer. Nippon Geka Gakkai Zasshi. 2002;103:371-375. [DOI] |
| 27. | Singh SP, Lipman J, Goldman H, Ellis FH Jr, Aizenman L, Cangi MG, Signoretti S, Chiaur DS, Pagano M, Loda M. Loss or altered subcellular localization of p27 in Barrett's associated adenocarcinoma. Cancer Res. 1998;58:1730-1735. [PubMed] |
| 28. | Yasunaga M, Tabira Y, Nakano K, Iida S, Ichimaru N, Nagamoto N, Sakaguchi T. Accelerated growth signals and low tumor-infiltrating lymphocyte levels predict poor outcome in T4 esophageal squamous cell carcinoma. Ann Thorac Surg. 2000;70:1634-1640. [DOI] |
| 29. | Shamma A, Doki Y, Tsujinaka T, Shiozaki H, Inoue M, Yano M, Kawanishi K, Monden M. Loss of p27(KIP1) expression predicts poor prognosis in patients with esophageal squamous cell carcinoma. Oncology. 2000;58:152-158. [PubMed] [DOI] |
| 30. | Shibata H, Matsubara O, Wakiyama H, Tanaka S. The role of cyclin-dependent kinase inhibitor p27 in squamous cell carcinoma of the esophagus. Pathol Res Pract. 2001;197:157-164. [PubMed] [DOI] |
| 31. | Taniere P, Martel-Planche G, Saurin JC, Lombard-Bohas C, Berger F, Scoazec JY, Hainaut P. TP53 mutations, amplification of P63 and expression of cell cycle proteins in squamous cell carcinoma of the oesophagus from a low incidence area in western Europe. Br J Cancer. 2001;85:721-726. [PubMed] [DOI] |
| 32. | Craig C, Wersto R, Kim M, Ohri E, Li Z, Katayose D, Lee SJ, Trepel J, Cowan K, Seth P. A recombinant adenovirus expressing p27Kip1 induces cell cycle arrest and loss of cyclin-Cdk activity in human breast cancer cells. Oncogene. 1997;14:2283-2289. [PubMed] [DOI] |
| 33. | Naruse I, Hoshino H, Dobashi K, Minato K, Saito R, Mori M. Over-expression of p27kip1 induces growth arrest and apoptosis mediated by changes of pRb expression in lung cancer cell lines. Int J Cancer. 2000;88:377-383. [DOI] |
| 34. | Park KH, Seol JY, Yoo CG, Kim YW, Han SK, Lee EH, Kim CM, Shim YS, Lee CT. Adenovirus expressing p27(Kip1) induces growth arrest of lung cancer cell lines and suppresses the growth of established lung cancer xenografts. Lung Cancer. 2001;31:149-155. [DOI] |
| 35. | Katner AL, Gootam P, Hoang QB, Gnarra JR, Rayford W. A recombinant adenovirus expressing p27(Kip1) induces cell cycle arrest and apoptosis in human 786-0 renal carcinoma cells. J Urol. 2002;168:766-773. [DOI] |
| 36. | Katner AL, Hoang QB, Gootam P, Jaruga E, Ma Q, Gnarra J, Rayford W. Induction of cell cycle arrest and apoptosis in human prostate carcinoma cells by a recombinant adenovirus expressing p27(Kip1). Prostate. 2002;53:77-78. [PubMed] [DOI] |
| 37. | Li J, Yang XK, Yu XX, Ge ML, Wang WL, Zhang J, Hou YD. Overexpression of p27 (KIP1) induced cell cycle arrest in G1 phase and subsequent apoptosis in HCC-9204 cell line. World J Gastroenterol. 2000;6:513-521. [PubMed] |
| 38. | Li J, Wang W, Yu X, Yang X, Hou Y. Overexpression of p27(KIP1) induced by Bak gene leads to the arrest in G(1) phase of HCC-9204 cell line. Zhonghua Ganzangbing Zazhi. 2001;9:27-29. [PubMed] |
| 39. | Tong Q, Wu QM, Liu CZ, Yu JP. Effect of adenovirus mediated human p27kip1 antioncogene on the proliferation in gastric cancer cell lines SGC-7901. Zhongliu Fangzhi Yanjiu. 2002;29:96-98. |
| 40. | Lim MS, Adamson A, Lin Z, Perez-Ordonez B, Jordan RC, Tripp S, Perkins SL, Elenitoba-Johnson KS. Expression of Skp2, a p27(Kip1) ubiquitin ligase, in malignant lymphoma: correlation with p27(Kip1) and proliferation index. Blood. 2002;100:2950-2956. [PubMed] |
| 41. | Liang J, Zubovitz J, Petrocelli T, Kotchetkov R, Connor MK, Han K, Lee JH, Ciarallo S, Catzavelos C, Beniston R. PKB/Akt phosphorylates p27, impairs nuclear import of p27 and opposes p27-mediated G1 arrest. Nat Med. 2002;8:1153-1160. [PubMed] [DOI] |
| 42. | Viglietto G, Motti ML, Bruni P, Melillo RM, D'Alessio , Califano D, Vinci F, Chiappetta G, Tsichlis P, Bellacosa A. Cytoplasmic relocalization and inhibition of the cyclin-dependent kinase inhibitor p27(Kip1) by PKB/Akt-mediated phosphorylation in breast cancer. Nat Med. 2002;8:1136-1144. [PubMed] [DOI] |