修回日期: 2002-11-15
接受日期: 2002-11-18
在线出版日期: 2003-04-15
构建表达乙肝病毒表面抗原(HBsAg)和e抗原(HBeAg)的非复制型重组腺病毒载体, 并检测他能否在真核细胞中有效表达目的基因.
扩增乙肝病毒(HBV)前S2/S基因和前C/C基因片段, 分别亚克隆到腺病毒穿梭质粒pAdTrack-CMV上, 与5型腺病毒骨架质粒pAdeasy-1共转染BJ5183细菌, 经细菌内同源重组产生分别携带HBV S 区和C区基因的重组腺病毒载体pAd-HBs和pAd-HBe, 经脂质体法转化293细胞包装产生重组腺病毒Ad-HBs和Ad-HBe; 体外转染293和Vero细胞, RT-PCR和ELISA法检测目的基因的表达.
构建了表达HBsAg和HBeAg基因的重组腺病毒, 病毒滴度可达5×1012 pfu/L, 并能在真核细胞中有效表达目的基因.
成功构建表达HBsAg和HBeAg的重组腺病毒载体, 为进一步开展HBV基因治疗研究提供实验基础.
引文著录: 黄呈辉, 欧阳玲, 马会慧, 汤正好, 李刚, 姚集鲁. 细菌内同源重组法构建HBV S区和C区基因非复制型腺病毒载体及其体外表达. 世界华人消化杂志 2003; 11(4): 438-441
Revised: November 15, 2002
Accepted: November 18, 2002
Published online: April 15, 2003
To construct recombinant adenoviral vector carrying HBV S and C region gene by homologous recombination in bacteria and to detect its expression in vitro.
HBV pre-S2/S genes and pre-C/C genes were amplified by PCR and were cloned to adenoviral shuttle plasmid pAdTrack-CMV, respectively. Then the resultant pAd Track-CMV-HBs or pAdTrack-CMV-HBe was cotransfected into BJ5183 bacteria with the plasmid pAdeasy-1. The adenoviral plasmid carrying HBV S and C gene (pAd-HBs and pAd-HBe) was generated with homologous recombination in bacteria and the adenoviruses were produced in 293 cells. Both 293 and Vero cells were infected with adenoviruses and the expression of HBsAg and HBeAg was detected by RT-PCR and ELISA in vitro.
The titer of Ad-HBs and Ad-HBe adenoviruses was up to 5×1012 pfu/L after proliferation in 293 cells. HBsAg and HBeAg were expressed efficiently in 293 and Vero cells after infection.
The recombinant adenoviruses expressing HBsAg or HBeAg were constructed successfully and can be used further in gene therapy of HBV.
- Citation: Huang CH, Ou-Yang L, Ma HH, Tang ZH, Li G, Yao JL. Construction of replication-deficient recombinant adenoviral vector carrying HBV S and C region gene by homologous recombination in bacteria and its expression in vitro. Shijie Huaren Xiaohua Zazhi 2003; 11(4): 438-441
- URL: https://www.wjgnet.com/1009-3079/full/v11/i4/438.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i4.438
重组非复制型腺病毒作为基因治疗和蛋白表达载体, 已经成为基因治疗研究中应用最为广泛的载体之一[1-4]. 我们采用一种新的细菌内同源重组系统[5], 构建携带增强型绿色荧光蛋白(enhanced GFP, EGFP)基因和乙型肝炎病毒(HBV)S和C区基因的重组腺病毒, 并检测他在真核细胞中的表达, 为开展乙肝的基因免疫治疗提供实验基础.
携带EGFP基因的腺病毒穿梭质粒pAdTrack-CMV, E1区和E3区缺失的复制缺陷5型腺病毒骨架质粒pAdeasy-1, 大肠杆菌XL1-Blue, BJ 5 183和DH10B由北京协和医院许志勤博士惠赠; 携带HBV adw亚型全基因的PBR322质粒由本实验室保存; 限制性内切酶PmeⅠ和PacⅠ购自NEB公司, NotⅠ, KpnⅠ, BglⅡ 和DNaseⅠ购自TaKaRa公司; 人胚肾293 细胞和绿猴肾细胞(Vero)购自武汉大学典型培养物保藏中心; 低血清培养基Opti-MEM Ⅰ, DMEM, 胎牛血清(FBS)和DNA转染试剂盒lipofectamine 2 000购自Life Tech公司; HBsAg ELISA检测试剂购于荷兰欧嘉隆公司, HBeAg ELISA检测试剂购于厦门新创公司.
1.2.1 腺病毒穿梭载体pAdTrack-CMV-HBs和pAdTrack-CMV-HBe的构建 根据HBV S和C区开放读码框序列, 设计合成2对引物, 由上海生工生物公司合成, 引物序列如下: PS1: 5'-TTACAGATCTATGCAGTGGAACTCCAC-3'; PS2: 5'-TTCGCGGCCGCTAGGGTTTAAATGTATACC-3'; PE1: 5'-TACGGTACCATGCAACTTTTTCACCTCTGCCTAATC-3'; PE2: 5'-TTGCGGCCGCTAACATTGAGATTCCCGAGA-3'; 其中引物PS1和PS2 用于扩增HBV pre-S2/S基因片段, 在引物的5'端分别加上BglⅡ和NotⅠ限制性酶切位点; 引物PE1和PE2用于扩增HBV pre-C/C基因, 在引物的5'端分别加上KpnⅠ和NotⅠ限制性酶切位点. 以插入HBV adr亚型全基因的PBR322质粒为模板进行PCR扩增, 条件为: 94 ℃, 180 s预变性; 94 ℃, 40 s; 55 ℃, 50 s; 72 ℃, 90 s, 扩增35个循环, 最后72 ℃延伸10 min. 扩增片段用10 g/L的琼脂糖凝胶电泳, 目的片段切胶回收纯化后, 连接到pBluscript KS(+)-T载体上, 转化XL1-Blue宿主菌, 挑选阳性质粒, 经测序序列正确后, 用相应的内切酶BglⅡ和NotⅠ、KpnⅠ和NotⅠ双酶切后, 定向亚克隆到pAdTrack-CMV质粒上, 电转化DH10B细菌后, 筛选重组pAdTrack-CMV-HBs和pAdTrack-CMV-HBe质粒.
1.2.2 E.coli内同源重组构建pAd-HBs和pAd-HBe腺病毒载体 取0.1-0.5 μg的pAdTrack-CMV-HBs或pAdTrack-CMV-HBe质粒, PmeⅠ酶切线性化后溶解于6 mL无菌水中, 与1 μL(0.1 μg)pAdEasy-1 质粒一起加入到20 μL电穿孔感受态大肠杆菌BJ 5 183中, 混匀后加入预冷的2.0 mm电转化杯中, 冰浴5 min, 在2.5 kV/200Ω/25μf条件下电转化, 菌液在SOC培养液1 mL中37 ℃孵育10-20min, 涂4个25 mg/L卡那霉素LB平板, 37 ℃过夜培养16-20 h, 挑选10-24个小菌落, 碱裂解法小提质粒, 7 g/L琼脂糖凝胶电泳, 挑选质粒大小大于pAdEasy-1的质粒, 并用PacⅠ酶切鉴定, 取阳性质粒1 mL电转化DH10B菌, 用Promega提取试剂盒进行质粒的提取和纯化.
1.2.3 重组腺病毒Ad-HBs和Ad-HBe的包装 转染前1 d, 在T-25培养瓶中接种2×106 293细胞, 至转染时细胞约为50-70 %汇合度. 取质粒pAd-HBS或pAd-HBe各4 μg分别用PacⅠ酶切, 酚/氯仿抽提, 乙醇沉淀, 溶于无菌去离子水20 μL中, 再加lipofectamine 2 000 20 μL一起混合于500 μL Opti-MEMⅠ, 室温孵育10-30 min后, lipofectamine-DNA混合物加入培养瓶, 放回37 ℃ 50 mL/L CO2孵箱孵育4 h, 弃去含lipofectamine-DNA混合物的培养液上清, 换成含100 mL/L FBS的完全DMEM培养液. 培养18 h后通过荧光显微镜观察EGFP的表达, 转染后7-10 d后离心收集细胞, 弃上清, 细胞沉淀悬浮于2 mL磷酸盐缓冲液(PBS)中, 37 ℃/-70 ℃反复冻溶4次, 离心留上清. 取病毒上清1.0 mL再转染T-25瓶 50-70 %汇合的293细胞, 转染后3-5 d, 当大约1/3-1/2的293细胞脱落时, 离心收集细胞, 按上述方法收集病毒, 再重复扩增培养1次, 收集第3代病毒进行滴度(pfu/L)测定[3].
1.2.4 目的基因HBsAg 和HBeAg在真核细胞中的表达 取病毒上清, 按MOI为10转染293和Vero细胞, 荧光显微镜下观察EGFP的表达, 转染第3-5天, 95 %以上细胞出现EGFP的表达, 吸取上清进行ELISA测定; 用细胞刮子刮下细胞, PBS洗3次, 用TRIZOL试剂提取细胞中总RNA, 用DNaseⅠ消化污染的DNA后, 分别用引物PS1/PS2和PE1/PE2进行RT-PCR检测.
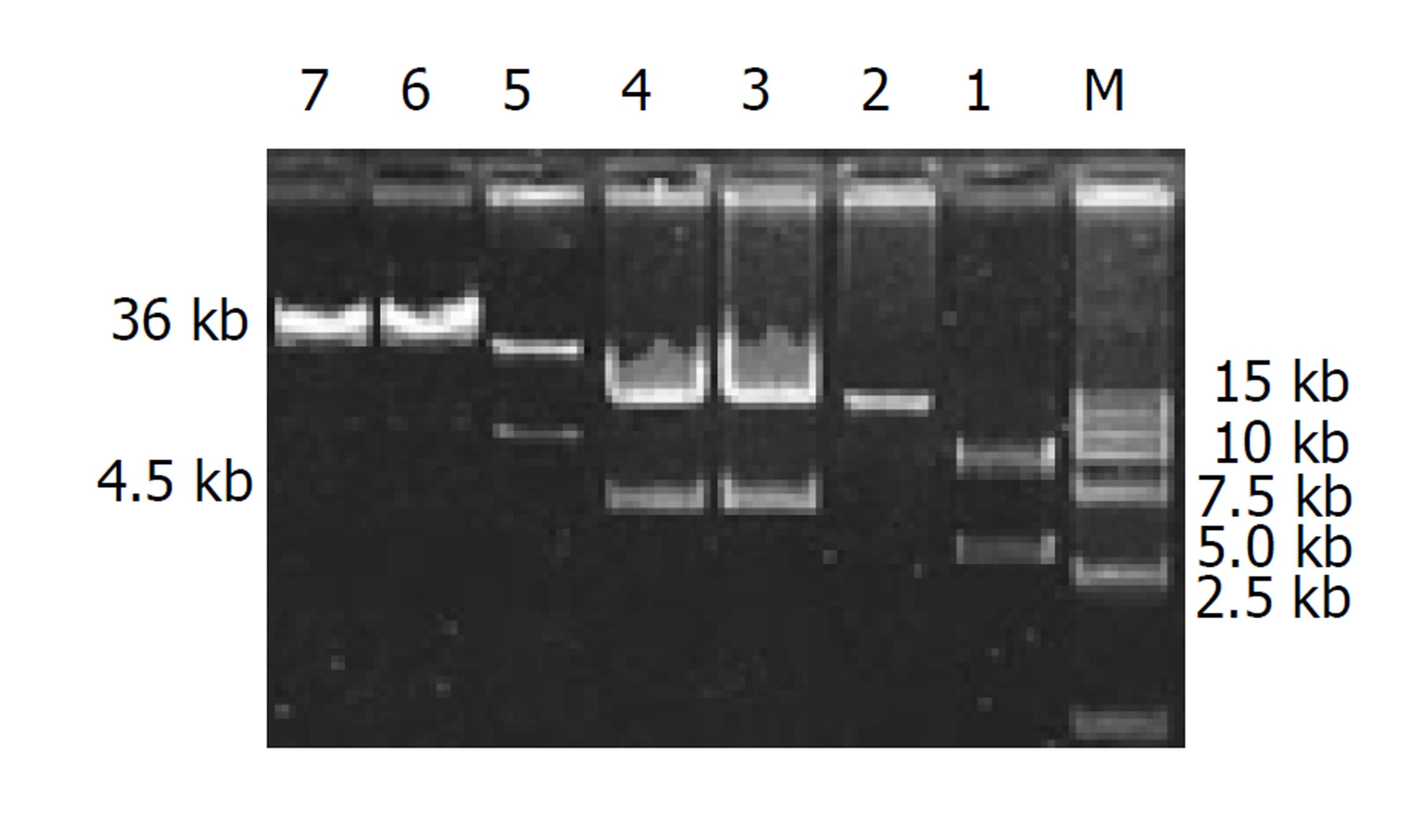
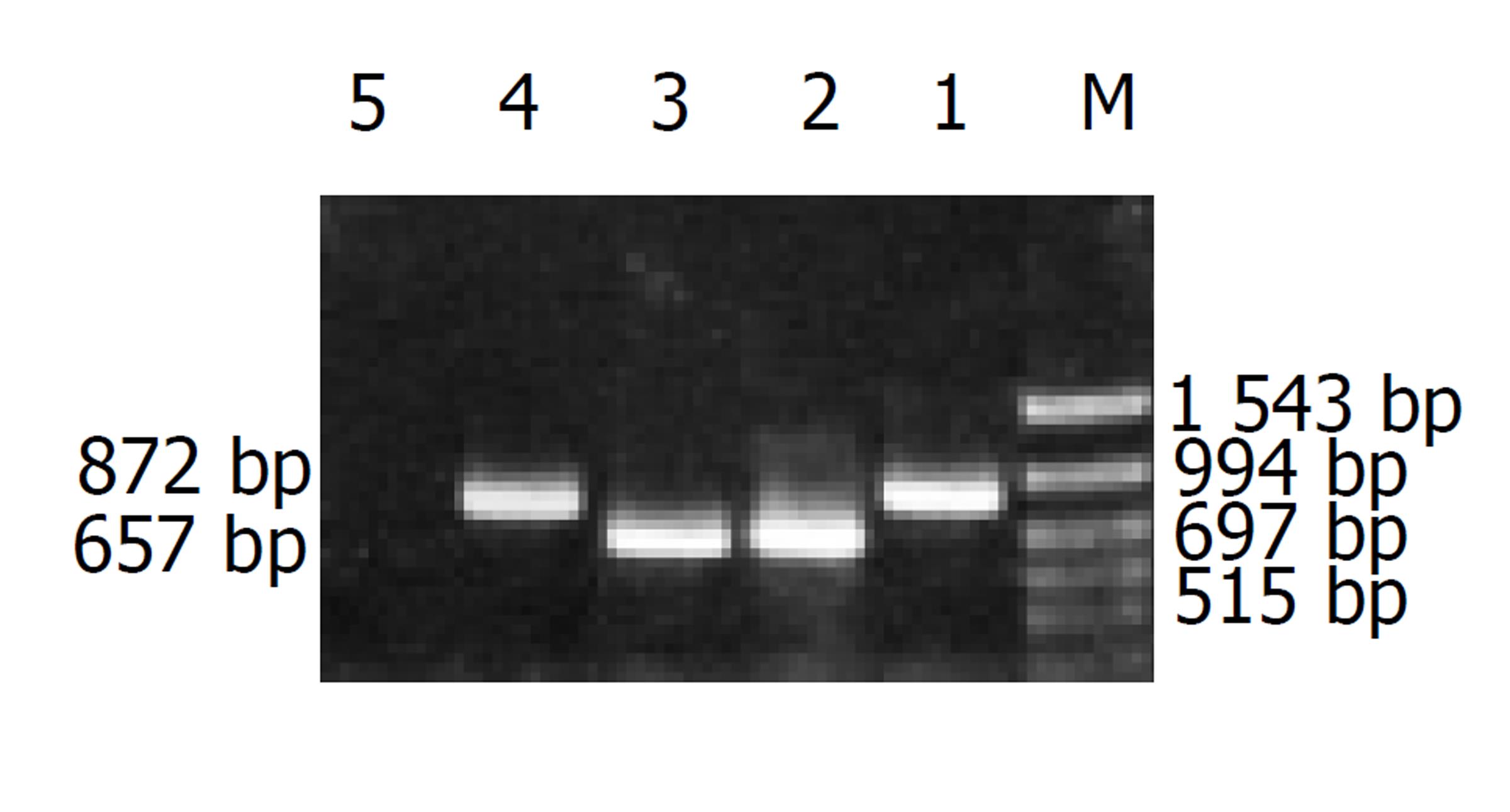
pAd-HBs和pAd-HBe PCR扩增pre-S2/S基因片段约872 bp, pre-C/C基因片段约657 bp, 重组到pBluscript KS(+)-T载体上进行测序, 测序结果未发现有突变情况. 双酶切后定向亚克隆到pAdTrack-CMV质粒上, 产生重组腺病毒穿梭质粒pAdTrack-CMV-HBs和pAdTrack-CMV-HBe, 与0.1 ug pAdEasy-1 共转化BJ 5 183菌, 获得数百个克隆, 挑选10-24个克隆经碱裂解法提质粒, 7 g/L琼脂糖凝胶电泳, 片段大小大于pAdEasy-1的质粒为阳性重组质粒; 用PacⅠ酶切, 阳性重组腺病毒质粒pAd-HBs或pAd-HBe出现一条大的片段(约35 kb)和一条小的片段(4.5 kb, 见图1).
取PacⅠ酶切后的质粒pAd-HBs或pAd-HBe, 用脂质体法转染293细胞, 18 h后荧光显微镜下可见293细胞内有EGFP的表达, 之后EGFP表达逐日增多, 于转染后5 d达高峰, 7-10 d后收种病毒; 取1/3-1/2病毒上清再转染T-25瓶50-70%汇合的293细胞, 转染18 h后, 1/3以上细胞可见EGFP的表达, 3-5 d出现明显细胞病变(CPE). 取第3代病毒进行滴度(pfu/L)测定, 病毒滴度达到5×1012 pfu/L.
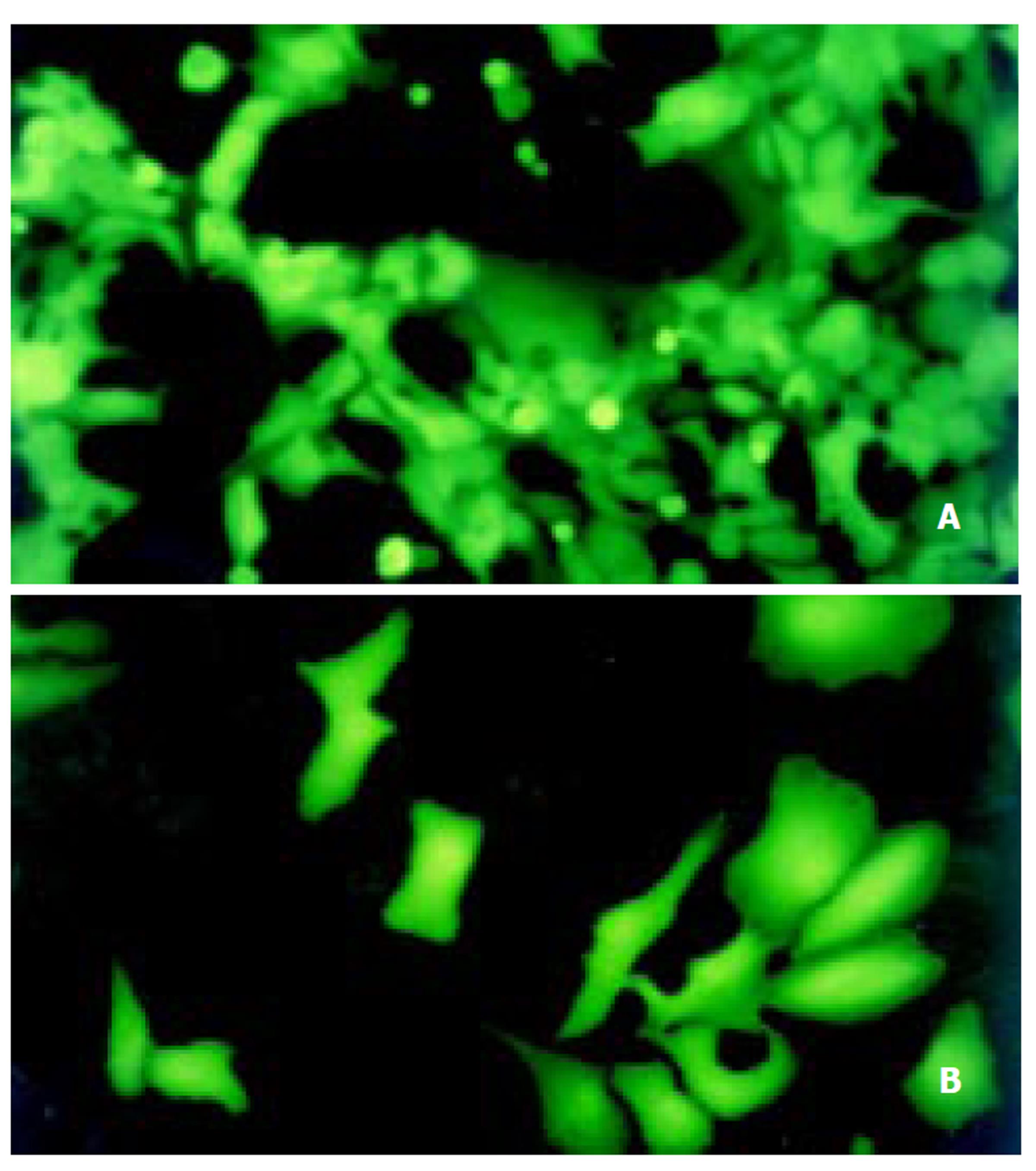
制备的Ad-HBs和Ad-HBe腺病毒带有2个独立的CMV启动子表达盒, 一个表达目的基因HBsAg或HBeAg, 一个表达EGFP. 18 h后在荧光显微镜下观察到293和Vero细胞中EGFP荧光, 可间接反映目的基因的表达(图2). 取第3代腺病毒转染293和Vero细胞, 经RT-PCR检测, 分别扩增出872 bp和657 bp预计大小的片段(图3), 表明重组腺病毒Ad-HBs和Ad-HBe在293和Vero细胞均能有效转录. 重组腺病毒Ad-HBs转染293和Vero细胞72 h, ELISA检测细胞培养上清中HBsAg A值均大于3.229 (C.O = 0.102); 重组腺病毒Ad-HBe转染293和Vero细胞72 h, ELISA检测细胞培养上清中HBeAg A值均分别为0.996和0.806(C.O = 0.105).
乙型肝炎病毒感染是当前危害人类健康的重要传染病之一[6,7], 虽然抗病毒药物如干扰素、核苷类似物治疗显示一定的效果, 但停药后易复发, 难于取得持久的疗效[8-11]. 基因疫苗和基因治疗作为近年发展的一种新的抗病毒途径, 在控制HBV感染方面已经显示其良好的应用前景[12-14]. 目前, HBV的基因治疗主要有反义寡核苷酸, 核酶和基因免疫(又称DNA疫苗)三个主要治疗策略[15-22]. 基因免疫是将编码抗原的外源基因插入合适的表达载体中, 再以载体免疫机体, 使目的基因在机体内高效表达, 达到基因治疗的目的[23]. 质粒表达载体是目前使用最多基因免疫的载体, 他具有诸多优点[24], 但也存在明显不足, 如质粒载体导入细胞效率低, 诱发免疫效果较弱, 安全性尚无定论等[25]. 腺病毒载体是目前更具前途的用于基因治疗的表达载体, 他具有基因组的结构简单, 分子背景比较清楚, 易于改造和操作, 载体制备较容易; 宿主广泛, 包装容量大, 感染率高, 又有较强的靶细胞特异性; 病毒基因不整合到宿主基因中, 安全性好; 既可以在肠道繁殖, 也可以在呼吸道繁殖, 便于疫苗制成后的使用和推广; 腺病毒载体感染宿主细胞表达的目的抗原, 较质粒载体更近似病原体感染, 易获得更强的免疫应答[26,27]. 因此, 腺病毒成为继逆转录病毒之后被广泛应用于基因免疫和基因治疗研究的病毒载体[28-33].
HBV S区基因编码的乙肝表面抗原(HBsAg), 具有潜在T细胞激活表位, 能介导CTL细胞发挥抗HBV作用[34]; 同时, 还可以能够刺激体内产生中和抗体抗-HBs, 具有清除病毒感染的作用[35], 因此, HBsAg可作为乙型肝炎基因免疫治疗的有效靶抗原. 我们构建的重组腺病毒Ad-HBs和Ad-HBe, 分别携带HBV S区基因和C区基因, 在真核细胞中可高效表达HBsAg和HBeAg. 另外, 我们制备的重组腺病毒Ad-HBs和Ad-HBe是E1, E3区缺失的复制缺陷5型腺病毒, 由于E1区基因为腺病毒复制所必需, 因此需要由转化了E1区基因的包装细胞系(293细胞)提供反式补偿, 重组腺病毒才能复制和扩增. 这种复制缺陷型重组腺病毒仍具有感染靶细胞的能力但不发生复制, 因而不会直接造成靶细胞的损害, 有利于其基因治疗研究中的应用[36]. 另外, 复制缺陷型重组腺病毒缺失的病毒早期基因E1区, 编码多种与病毒的免疫逃避有关的蛋白(如E1A, E1B-19K和E1B-55K)[37], 与复制型腺病毒相比, 复制缺陷型重组腺病毒不仅安全, 而且以低剂量方式产生抗原蛋白, 不裂解细胞, 故抗原蛋白表达持久, 有利于激发长期的免疫反应[38].
由于腺病毒基因组较大(约36 kb), 很难选择合适的限制性内切酶直接进行分子克隆, 因此, 构建腺病毒载体时, 通常将腺病毒基因组左端制备成含E1区缺失的穿梭质粒, 然后将目的基因插入穿梭质粒的多克隆位点, 再与含腺病毒基因组的质粒共转染至293或911细胞内进行同源重组, 再通过空斑筛选来鉴定扩增重组[39]. 这种传统构建重组腺病毒载体的方法虽然非常有效, 但由于在哺乳细胞293或911内同源重组的效率低, 需要多次空斑筛选, 因而制备出腺病毒的时间较长, 妨碍其广泛应用. 本研究采用一种新的腺病毒载体制备系统AdEasy[5], 该系统在高效的原核细胞的大肠杆菌中进行同源重组, 经抗生素培养板筛选重组, 极大简化载体的构建过程. 构建的腺病毒载体上携带有增强型绿色荧光蛋白(EGFP)示踪基因, 可以很方便通过荧光显微镜观察腺病毒的包装、检测病毒滴度和了解目的基因在真核细胞中的表达情况, 而不采用观察细胞病毒病变和空斑实验鉴定病毒包装成功以否, 以及采用空斑实验检测病毒的滴度等.采用本系统可以方便快速构建腺病毒载体, 大大节省时间.本研究成功制备表达HBsAg基因和HBeAg的重组腺病毒载体, 并能够在真核细胞中获得高效稳定的表达, 这一初步研究结果为乙肝病毒基因免疫和基因治疗的临床应用研究提供了理论依据.
| 1. | Xiang ZQ, Yang Y, Wilson JM, Ertl HC. A replication-defective human adenovirus recombinant serves as a highly efficacious vaccine carrier. i Virology. 1996;219:220-227. [PubMed] [DOI] |
| 2. | Magovern CJ, Mack CA, Zhang J, Rosengart TK, Isom OW, Crystal RG. Regional Angiogenesis induced in nonischemic tissure by an adenoviral vector expressing vascular endothelial growth factor. Hum Gene Ther. 1997;8:215. [PubMed] [DOI] |
| 3. | 郝 春秋, 周 永兴, 冯 志华, 李 谨革, 贾 战生, 王 平忠. HCV C基因腺病毒表达载体骨架质粒pAd.HCV-C的构建、鉴定及表达. 世界华人消化杂志. 2001;9:635-639]. |
| 5. | He TC, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci USA. 1998;95:2509-2514. [DOI] |
| 8. | 游 晶, 庄 林, 唐 宝璋, 杨 惠, 杨 微波, 李 武, 张 宏丽, 张 艳梅, 张 禄, 严 绍明. 干扰素联合胸腺肽治疗慢性乙型肝炎. 世界华人消化杂志. 2001;9:388-391. |
| 10. | Wolters LM, Hansen BE, Niesters HG, de Man RA. Viral dynamics in chronic hepatitis B patients treated with lamivudine, lamivudine-famciclovir or lamivudine-ganciclovir. Eur J Gastroenterol Hepatol. 2002;14:1007-1011. [PubMed] [DOI] |
| 11. | Yang SS, Hsu CT, Hu JT, Lai YC, Wu CH. Lamivudine does not increase the efficacy of interferon in the treatment of mutant type chronic viral heaptitis B. World J Gastroenterol. 2002;8:868-871. [DOI] |
| 12. | Chiou HC, Lucas MA, Coffin CC, Banaszczyk MG, Ill CR, Lollo CP. Gene therapy strategies for the treatment of chronic viral hepatitis. Expert Opin Biol Ther. 2001;1:629-639. [PubMed] [DOI] |
| 13. | Xu CT, Pan BR. Current status of gene therapy in gastroenterology. World J Gastroenterol. 1998;4:85-89. [DOI] |
| 14. | Dai WJ, Jiang HC. Advances in gene therapy of liver cirrhosis: a review. World J Gastroenterol. 2001;7:1-8. [PubMed] [DOI] |
| 15. | Wu CH, Zeng Z, Wang QH, Yu M. Experimental study of inhibition of hepatitis B by dual-target antisense RNA. Zhonghua Yixue Zazhi. 2001;25:605-608. |
| 16. | Robaczewska M, Guerret S, Remy JS, Chemin I, Offensperger WB, Chevallier M, Behr JP, Podhajska AJ, Blum HE, Trepo C. Inhibition of hepadnaviral replication by polyethylenimine-based intravenous delivery of antisense phosphodiester oligodeoxynucleotides to the liver. Gene Ther. 2001;8:874-881. [PubMed] [DOI] |
| 17. | Putlitz J, Wieland S, Blum HE, Wands JR. Antisense RNA complementary to hepatitis B virus specifically inhibits viral replication. Gastroenterology. 1998;115:702-713. [DOI] |
| 18. | Feng Y, Kong YY, Wang Y, Qi GR. Antiviral activity of a hammerhead ribozyme against HBV in HepG2.2.15 cells. Shengwu Huaxue Yu Shengwu Wuli Xuebao. 2002;34:204-208. |
| 19. | Song YH, Lin JS, Liu NZ, Kong XJ, Xie N, Wang NX, Jin YX, Liang KH. Anti-HBV hairpin ribozyme-mediated cleavage of target RNA in vitro. World J Gastroenterol. 2002;8:91-94. [DOI] |
| 20. | Wen SJ, Xiang KJ, Huang ZH, Zhou R, Qi XZ. Construction of HBV-specific ribozyme and its recombinant with HDV and their cleavage activity in vitro. World J Gastroenterol. 2000;6:377-380. [DOI] |
| 21. | Feng Y, Kong YY, Wang Y, Qi GR. Intracellular inhibition of the replication of hepatitis B virus by hammerheadribozymes. J Gastroenterol Hepatol. 2001;16:1125-1130. [DOI] |
| 22. | Sallberg M, Hughes J, Javadian A, Ronlov G, Hultgren C, Townsend K, Anderson CG, O扗ea J, Alfonso J, Eason R. Genetic immunization of chimpanzees chronically infected with the hepatitis B virus, using a recombinant retroviral vector encoding the hepatitis B virus core antigen. Hum Gene Ther. 1998;9:1719-1729. [PubMed] [DOI] |
| 23. | Ulmer JB, Donnelly JJ, Parker SE, Rhodes GH, Felgner PL, Dwarki VJ, Gromkowski SH, Deck RR, DeWitt CM, Friedman A. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science. 1993;259:1745-1749. [DOI] |
| 24. | Ertl HC, Xiang ZQ. Genetic Immunization. Viral Immunol. 1996;9:1-9. [PubMed] [DOI] |
| 25. | Mendez S, Belkaid Y, Seder RA, Sacks D. Optimization of DNA vaccination against cutaneous leishmaniasis. Vaccine. 2002;20:3702-3708. [DOI] |
| 26. | Mitani K, Graham FL, Caskey CT, Kochanek S. Rescue, propagation, and partial purification of a helper virus- dependent adenovirus vector. Proc Natl Acad Sci USA. 1995;92:3854-3858. [DOI] |
| 27. | Fisher KJ, Choi H, Burda J, Chen SJ, Wilson JM. Recombinant adenovirus deleted of all viral genes for gene therapy of cystic fibrosis. Virology. 1996;217:11-22. [PubMed] [DOI] |
| 28. | Wang L, Qi X, Sun Y, Liang L, Ju D. Adenovirus-mediated combined P16 gene and GM-CSF gene therapy for the treatment of established tumor and induction of antitumor immunity. Cancer Gene Ther. 2002;9:819-824. [PubMed] [DOI] |
| 29. | 陈 洁平, 林 晨, 徐 采朴, 张 雪艳, 付 明, 邓 友平, 隗 月, 吴 旻. 重组反义c-myc腺病毒对人胃癌细胞的体内及体外分子治疗. 世界华人消化杂志. 1999;7:482-486. |
| 30. | 陈 洁平, 林 晨, 徐 采朴, 张 雪艳, 付 明, 邓 友平, 隗 月, 吴 旻. 腺病毒介导RA538及反义c-myc在不同细胞系中作用及其机制. 世界华人消化杂志. 2000;8:266-270. |
| 31. | 鲁 建国, 林 晨, 黄 志强, 吴 金生, 付 明, 张 雪艳, 梁 萧, 要 秀, 吴 旻. 腺病毒介导的p16和顺铂的联合应用对胆管癌细胞系QBC939的生长抑制作用. 世界华人消化杂志. 2000;8:641-645. |
| 33. | Zhou Z, Zhang DF, Ren H. Humoral immunization and cell-mediated immunization evoked by HBsAg and B7-2 Ag co-expression recombinant adenovirus vector. Zhonghua Ganzangbing Zazhi. 2001;9:111-113. [PubMed] |
| 34. | Davis HL, Schirmbeck R, Reimann J, Whalen RG. DNA-mediated immunization in mice induces a potent MHC class I -restricted cytotoxic T lymphocyte response to the hepatitis B envelope protein. Hum Gene Ther. 1995;6:1447-1456. [PubMed] [DOI] |
| 35. | 洪 源, 成 军, 董 菁, 李 克, 王 琳, 王 刚, 刘 妍. 乙型肝炎病毒HBsAg重组疫苗与表面抗原DNA疫苗诱导H-2b小鼠免疫应答的实验研究. 世界华人消化杂志. 2002;10:137-140. |
| 36. | Bett AJ, Haddara W, Prevec L, Graham FL. An efficient and flexible system for construction of adenovirus vectors with insertions or deletions in early regions 1 and 3. Proc Natl Acad Sci USA. 1994;91:8802-8806. [DOI] |
| 37. | Barry M, McFadden G. Apoptosis regulators from DNA viruses. Current Opinion Immunol. 1998;10:422-430. [DOI] |
| 38. | Morsy MA, Gu M, Motzel S, Zhao J, Lin J, Su Q, Allen H, Franlin L, Parks RJ, Graham FL. An adenoviral vector deleted for all viral coding sequences results in enhanced safety and extended expression of a leptin transgene. Proc Natl Acad Sci USA. 1998;95:7866-7871. [DOI] |
| 39. | Krougliak V, Graham FL. Development of cell lines capable of complementing E1, E4 and protein IX defective adenovirus type 5 mutants. Human Gene Therapy. 1995;6:1575-1586. [PubMed] [DOI] |