修回日期: 2002-11-25
接受日期: 2002-11-29
在线出版日期: 2003-04-15
探讨肝硬变状态下肝部分切除术后肝细胞和KC TGF-α、HGF、PCNA 和IGFBP-1s 的mRNA表达, 进一步阐明KC在肝细胞再生中的作用.
复制我们建立的大鼠肝硬变肝切除模型, 分离肝细胞和KC, 提取RNA, 采用Northern杂交.
KC其HGF mRNA表达较肝细胞为早, 在术后6 h点达到高峰. 但肝细胞TGF-α mRNA表达含量明显高于KC的表达. 肝细胞IGFBP-1s mRNA的表达含量低, 术后6 h点相对较高.KC IGFBP-1s mRNA未见表达. 肝细胞PCNA mRNA的表达在术后6 h其含量达到最低点, 明显受抑制.
HGF和TGF-αmRNA表达与肝硬变大鼠的肝细胞再生密切相关, 而TGF-α 是肝细胞再生中最重要的物质.IGFBP-1s mRNA表达降低反应了肝硬变大鼠术后肝细胞代谢明显受损, 而PCNA mRNA表达可提示肝细胞增生能力.
引文著录: 陈平, 李昆, 董家鸿, 韩本立. 肝硬变大鼠肝部分切除术后残肝TGF-α、HGF、PCNA和IGFBP-1s mRNA的变化. 世界华人消化杂志 2003; 11(4): 434-437
Revised: November 25, 2002
Accepted: November 29, 2002
Published online: April 15, 2003
To explore expression of TGF-α, HGF, PCNA and IGFBP-1s mRNA in hepatocyte and Kuffer cell (KC) and to study the effects of KC on liver regeneration after partial hepatectomy in cirrhotic rats.
Using the model of partial hepatectomy in cirrhotic rats, we separated hepatocytes and KCs and employed Northern hybridization.
The expression of HGF mRNA in KC was earlier than that of hepatocyte, and peaked at 6 hr after operation. But the expression contents of TGF-α mRNA in hepatocyte was more than that of KC. The expression contents of IGFBP-1s mRNA in hepatocyte was lower and KC had no expressions. The expression of PCNA mRNA in hepatocyte was markedly depressed at 6h postoperation.
The expression of HGF and TGF-α mRNA is correlated with liver regeneration after operation in cirrhotic rats. TGF-α is very important for liver regeneration. The lower expression of IGFBP-1s mRNA shows the metabolic damage in cirrhotic rats postoperatively, but the expression of PCNA mRNA indicates the ability of liver regeneration.
- Citation: Chen P, Li K, Dong JH, Han BL. Changes of TGF-a, HGF, PCNA and IGFBP-1s mRNA after partial hepatectomy in rat liver. Shijie Huaren Xiaohua Zazhi 2003; 11(4): 434-437
- URL: https://www.wjgnet.com/1009-3079/full/v11/i4/434.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i4.434
正常状态下肝部分切除术后TGF-α(转化生长因子)、表皮生长因子(EGF)和HGF(肝细胞生长因子)等具有强力促进肝细胞再生作用[1-6]. 但在肝硬变状态下肝部分切除术后这些细胞因子mRNA表达的情况及在肝再生中的作用仍不清楚.我们研究肝硬变大鼠肝部分切除术后肝细胞和KC TGF-α, HGF, 增生细胞核抗原(PCNA) 和胰岛素样生长因子黏附蛋白(IGFBP-1s) 的mRNA表达, 结果如下.
皮下注射的四氯化碳(CCL4) 油溶液加口服乙醇的方法制作肝硬变模型[7], 在动物稳定1 wk后可进行实验. 肝部分切除采用乙醚麻醉, 腹部正中切口, 切除大鼠肝脏的左叶和中叶, 切除量占全肝的70%. 观察点为术后6, 24, 48, 72 h和术后1 wk. 采用Armbrus te al[8]的方法.
参照Promega公司试剂盒的技术操作手册提取总RNA. 分别收集1×108肝细胞和KC, 采用此法均可获得满意的RNA. RNA纯度的评价和定量: 用分光光度计在波长260 nm和280 nm下分别测定. HGF、TGF-α、PCNA和IGFBP-1细胞因子的cDNA探针的合成与纯化. 大鼠HGF DNA探针序列: 参照Webber设计的序列[9] : 5'-GCTGCAGCTGGGAAATGTTTAAGATCTGTTTGCG-3'. TGF-α DNA探针序列: 参照Lee设计的序列[10]: 5'-CCATGTAAACAATATTG-3'. PCNA DNA探针序列: 参照Morishita设计的序列[11]: 5'-TTTGAGGCACGCCTGATC-3'. IGFBP-1s DNA探针序列: 参照Lee设计的序列[12]: 5'-GCATGGATCAGGGAGGAAACAACTTTCAGT-3'. 按以上DNA序列在本校生物化学教研室DNA合成仪上合成. 合成后按分子克隆实验指南的方法进行纯化. 使探针浓度为200 mg/L. 用放射性同位素32P对HGF, TGF-α, PCNA和IGF细胞因子的cDNA探针的标记, 采用Boehringer公司提供的DNA 5'末端标记试剂盒. 参照J. 萨姆布鲁克分子克隆实验指南第2版科学出版社, 1996: 362进行[13].
将提取的RNA 2 ul + 998 ul 双蒸水, 在波长260 nm 和280 nm时用分光度计(BECKMAN DU-600)测定其吸光度. 结果260 nm/280 nm A值>1.6<2.0, 表明RNA提取纯度较高. 根据公式可计算出每个样品RNA含量: A值×40 ug/1 000 ug ×1 000/2 = mg/L(表1).
| 样品 | RNA含量 | ||||
| 6 h | 24 h | 48 h | 72 h | 1 wk | |
| C-PH组: | |||||
| HC | 8.186 | 7.170 | 6.884 | 6.734 | 4.302 |
| KC | 2.074 | 3.786 | 4.334 | 2.889 | 3.848 |
| SO组肝细胞 | 1.612 | ||||
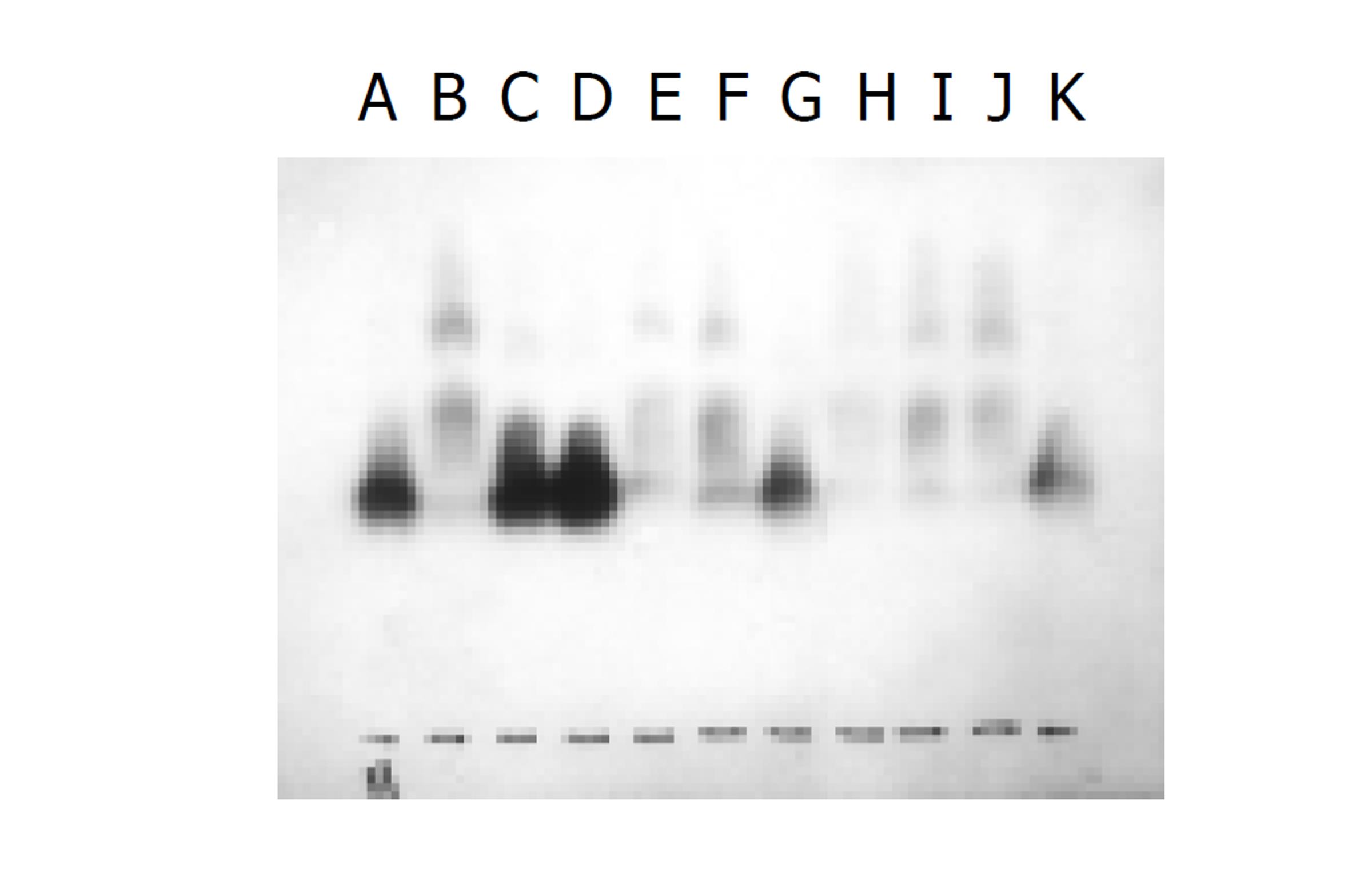
用rHGF cDNA探针检测到6.0 Kb的mRNA, 肝硬变大鼠的肝细胞rHGF有一定表达. KC其HGF mRNA表达较肝细胞为早, 在术后6 h点达到高峰. 而肝细胞HGF mRNA表达在术后6 h点含量最低, 以后逐渐升高, 在术后48 h点达到最高峰.(见图1).
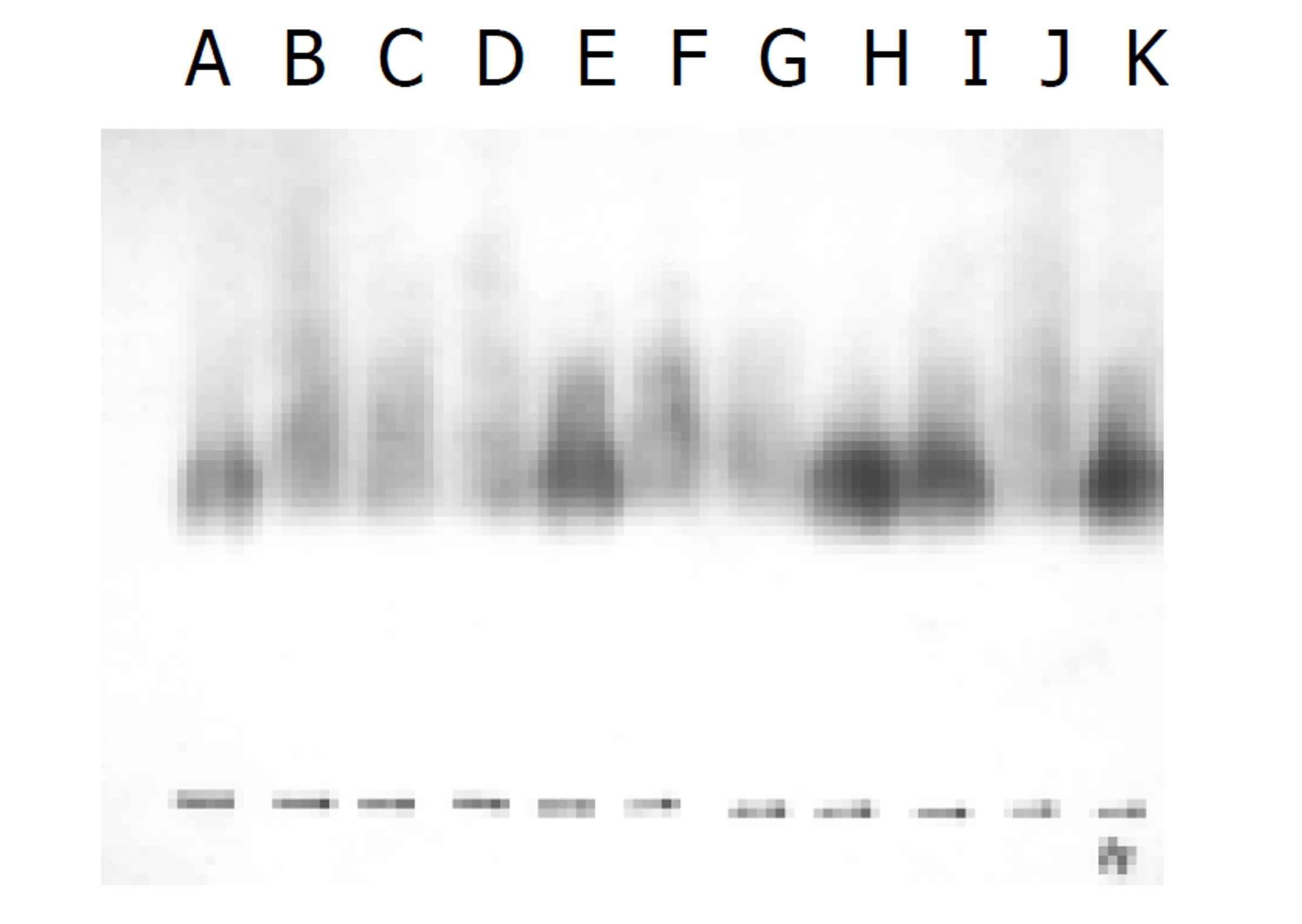
TGF-α mRNA的表达: 用TGF-α cDNA探针检测到4.5 Kb的mRNA.肝硬变大鼠的肝细胞有表达. 虽然KC其TGF-α mRNA表达较肝细胞为早, 在术后6 h点达到高峰. 但肝细胞TGF-α mRNA表达含量明显高于KC的表达, 提示肝细胞TGF-α mRNA在肝细胞再生中的作用可能大于KC. 另一方面, 肝细胞TGF-α mRNA高表达持续时间长, 从术后24 h至术后1 wk, 但高峰是术后24-48 h(见图2).
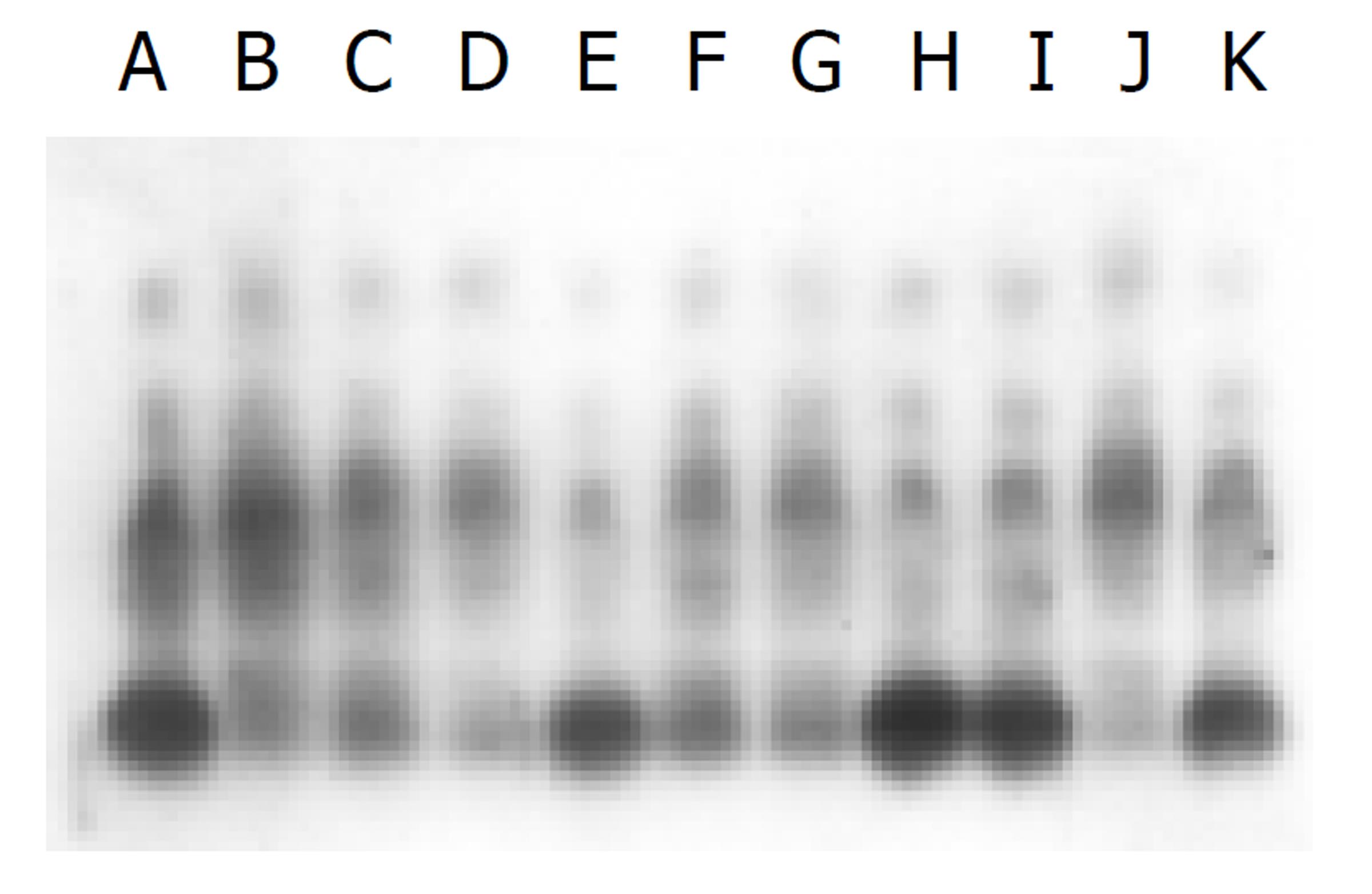
IGFBP-1s mRNA的表达: 与对照组比较, 肝细胞IGFBP-1s mRNA的表达含量低, 从片上来看, 隐约可见, 术后6 h点相对较高. KC IGFBP-1s mRNA未见表达. 说明肝硬变大鼠术后肝细胞IGFBP-1s mRNA的表达抑制(见图3).
PCNA mRNA的表达: 与对照组比较, 肝细胞PCNA mRNA的表达在术后6 h其含量达到最低点, 明显受抑制, 在术后24-48 h期间达到高峰. 与肝细胞有所不同, KC其PCNA mRNA的表达轻度增高后, 逐渐下降, 至术后1 wk时达到高峰(见图4).
人们最早认识到HGF是促进肝细胞再生最重要的物质, Grunnet et al [14-16]对肝损伤和修复时细胞生长因子的mRNA表达的研究发现, 大鼠肝部分切除术后与假手术组比较, 大鼠肝、脾和肾的HGF mRNA表达无明显增高, 我们的结果可以看出, KC其HGF mRNA表达较肝细胞为早, 在术后6 h点达到高峰.而肝细胞HGF mRNA表达在术后6 h点含量最低, 以后逐渐升高, 在术后48 h点达到最高峰, 但其峰值的表达低于KC. 单纯CCl4诱导组(对照组)肝细胞有一定的HGF mRNA表达, 相似于Tomiya et al [17,18]的结果. 说明KC在应激状态下作出的反应快于肝细胞, HGF主要来源于肝脏非实质肝细胞, 如KC, 但作用于肝细胞, 说明HGF参与了肝细胞再生[19-22].
TGF-α和HGF一样, 是刺激肝细胞生长非常重要的细胞因子[25-27]. 在CCl4肝损伤时, TGF-α mRNA表达的高峰在实验的48-72 h, 相当于同期的DNA的合成[23,24]. 我们应用TGF-α cDNA探针采用Northern印迹杂交技术来分析肝硬变大鼠术后肝细胞和KC的TGF-α mRNA的表达. 结果显示, 虽然KC其TGF-α mRNA表达较肝细胞为早, 在术后6 h点达到高峰. 但肝细胞TGF-α mRNA表达含量明显高于KC的表达, 提示肝细胞TGF-α mRNA在肝细胞再生中的作用可能大于KC. 另一方面, 肝细胞TGF-α mRNA高表达持续时间长, 从术后24 h-1 wk, 但高峰是术后24-48 h. 结果表明, TGF-α很可能是肝细胞再生过程中最重要的因子, 因为肝细胞表达其mRNA的量大且早, 提示TGF-α很可能参与肝细胞再生启动.
IGFBP-1s对胰岛素样生长因子有重要的调节作用, 对肝细胞再生有正负两方面的调节作用[28]. Lee et al[12]认为IGFBP-1s mRNA的表达与肝细胞蛋白质合成功能相一致, mRNA表达的峰值在部分肝切除术后2-3 h, IGFBP-1s表达的增加对于调节胰岛素样生长因子对肝细胞代谢和生长的影响将起重要作用. 我们的结果显示: 与对照组比较, 肝细胞IGFBP-1s mRNA的表达含量低, 从片上来看, 隐约可见, 术后6 h点相对较高. KC IGFBP-1s mRNA未见表达. 说明肝硬变大鼠术后肝细胞IGFBP-1s mRNA的表达抑制, 肝细胞代谢功能明显受损.
在细胞增生过程中, PCNA主要出现在细胞周期的S期, 他与DNA合成, 胸腺嘧啶激酶活性有密切关系[29-31]. 与对照组比较, 肝细胞PCNA mRNA的表达在术后6 h其含量达到最低点, 明显受抑制, 在术后24-48 h期间达到高峰.与肝细胞有所不同, KC其PCNA mRNA的表达轻度增高后, 逐渐下降, 至术后1 wk达到高峰.
我们认为, HGF和TGF-αmRNA表达与肝硬变大鼠的肝细胞再生密切相关, 而TGF-α 是肝细胞再生中最重要的物质. IGFBP-1s mRNA表达降低反应了肝硬变大鼠术后肝细胞代谢明显受损, 而PCNA mRNA表达可提示肝细胞增生能力. 在肝细胞再生过程中, 细胞因子相互依赖, 相互作用, 共同推动肝细胞再生.
| 3. | Court FG, Wemyss-Holden SA, Dennison AR, Maddern GJ. The mystery of liver regeneration. Br J Surg. 2002;89:1089-1095. [PubMed] [DOI] |
| 5. | Kountouras J, Boura P, Lygidakis NJ. Liver regeneration after hepatectomy. Hepatogastroenterology. 2001;48:556-562. [PubMed] |
| 6. | Tilg H. Cytokines and liver diseases. Can J Gastroenterol. 2001;15:661-668. [DOI] |
| 8. | Armbrust T, Nordmann B, Kreissig M, Ramadori G. C1Q synthesis by tissue mononuclear phagocytes from normal and from damaged rat liver: up-regulation by dexamethasone, down-regulation by interferon gamma, and lipopolysaccharide. Hepatology. 1997;26:98-106. [DOI] |
| 9. | Webber EM, FitzGerald MJ, Brown PI, Bartlett MH, Fausto N. Transforming growth factor-alpha expression during liver regeneration after partial hepatectomy and toxic injury, and potential interactions between transforming growth factor-alpha and hepatocyte growth factor. Hepatology. 1993;18:1422-1431. [DOI] |
| 10. | Lee DC, Rose TM, Webb NR, Todaro GJ. Cloning and sequence analysis of a cDNA for rat transforming growth factor-alpha. Nature. 1985;313:489-491. [DOI] |
| 11. | Morishita R, Gibbons GH, Ellison KE, Nakajima M, Zhang L, Kaneda Y, Ogihara T, Dzau VJ. Single intraluminal delivery of antisense cdc2 kinase and proliferating-cell nuclear antigen oligonucleotides results in chronic inhibition of neointimal hyperplasia. Proc Natl Acad Sci USA. 1993;90:8474-8478. [DOI] |
| 12. | Lee J, Greenbaum L, Haber BA, Nagle D, Lee V, Miles V, Mohn KL, Bucan M, Taub R. Structure and localization of the IGFBP-1 gene and its expression during liver regeneration. Hepatology. 1994;19:656-665. [DOI] |
| 14. | Grunnet N, Peng X, Tygstrup N. Growth factors and gene expression in cultured rat hepatocytes. J Hepatol. 1999;31:117-122. [DOI] |
| 15. | Diehl AM. Liver regeneration. Front Biosci. 2002;7:301-314. [DOI] |
| 16. | Kaibori M, Inoue T, Sakakura Y, Oda M, Nagahama T, Kwon AH, Kamiyama Y, Miyazawa K, Okumura T. Impairment of activation of hepatocyte growth factor precursor into its mature form in rats with liver cirrhosis. J Surg Res. 2002;106:108-114. [DOI] |
| 17. | Tomiya T, Ogata I, Fujiwara K. Transforming growth factor alpha levels in liver and blood correlate better than hepatocyte growth factor with hepatocyte proliferation during liver regeneration. Am J Pathol. 1998;153:955-961. [DOI] |
| 18. | Takeishi T, Hirano K, Kobayashi T, Hasegawa G, Hatakeyama K, Naito M. The role of Kupffer cells in liver regeneration. Arch Histol Cytol. 1999;62:413-422. [DOI] |
| 19. | Pediaditakis P, Lopez-Talavera JC, Petersen B, Monga SP, Michalopoulos GK. The processing and utilization of hepatocyte growth factor/scatter factor following partial hepatectomy in the rat. Hepatology. 2001;34:688-693. [PubMed] [DOI] |
| 20. | Masson S, Daveau M, Francois A, Bodenant C, Hiron M, Teniere P, Salier JP, Scotte M. Up-regulated expression of HGF in rat liver cells after experimental endotoxemia: a potential pathway for enhancement of liver regeneration. Growth Factors. 2001;18:237-250. [DOI] |
| 21. | Wang X, DeFrances MC, Dai Y, Pediaditakis P, Johnson C, Bell A, Michalopoulos GK, Zarnegar R. A mechanism of cell survival: sequestration of Fas by the HGF receptor Met. Mol Cell. 2002;9:411-421. [DOI] |
| 22. | Ogura Y, Hamanoue M, Tanabe G, Mitsue S, Yoshidome S, Nuruki K, Aikou T. Hepatocyte growth factor promotes liver regeneration and protein synthesis after hepatectomy in cirrhotic rats. Hepatogastroenterology. 2001;48:545-549. [PubMed] |
| 23. | Enami Y, Kato H, Murakami M, Fujioka T, Aoki T, Niiya T, Murai N, Ohtsuka K, Kusano M. Anti-transforming growth factor-beta1 antibody transiently enhances DNA synthesis during liver regeneration after partial hepatectomy in rats. J Hepatobil Pancreat Surg. 2001;8:250-258. [DOI] |
| 24. | Tomiya T, Hayashi S, Yanase M, Umeda N, Tani M, Yamada S, Masaki N, Ogata I, Fujiwara K. Serum transforming growth factor-alpha level can be a parameter for evaluating liver regeneration after partial hepatectomy in patients with liver cancer. Semin Oncol. 1997;24:S6-14-S6-17. |
| 25. | Stolz DB, Mars WM, Petersen BE, Kim TH, Michalopoulos GK. Growth factor signal transduction immediately after two-thirds partial hepatectomy in the rat. Cancer Res. 1999;59:3954-3960. [PubMed] |
| 26. | Hashimoto M, Kothary PC, Eckhauser FE, Raper SE. Treatment of cirrhotic rats with epidermal growth factor and insulin accelerates liver DNA synthesis after partial hepatectomy. J Gastroenterol Hepatol. 1998;13:1259-1265. [DOI] |
| 27. | Masson S, Daveau M, Hiron M, Lyoumi S, Lebreton JP, Teniere P, Scotte M. Differential regenerative response and expression of growth factors following hepatectomy of variable extent in rats. Liver. 1999;19:312-317. [DOI] |
| 28. | Skrtic S, Wallenius K, Sjogren K, Isaksson OG, Ohlsson C, Jansson JO. Possible roles of insulin-like growth factor in regulation of physiological and pathophysiological liver growth. Horm Res. 2001;55:1-6. [DOI] |
| 29. | Moriuchi A, Hirono S, Ido A, Ochiai T, Nakama T, Uto H, Hori T, Hayashi K, Tsubouchi H. Additive and inhibitory effects of simultaneous treatment with growth factors on DNA synthesis through MAPK pathway and G1 cyclins in rat hepatocytes. Biochem Biophys Res Commun. 2001;280:368-373. [PubMed] [DOI] |
| 30. | Alhonen L, Rasanen TL, Sinervirta R, Parkkinen JJ, Korhonen VP, Pietila M, Janne J. Polyamines are required for the initiation of rat liver regeneration. Biochem J. 2002;362:149-153. [DOI] |
| 31. | Takasaki Y, Kogure T, Takeuchi K, Kaneda K, Yano T, Hirokawa K, Hirose S, Shirai T, Hashimoto H. Reactivity of anti-proliferating cell nuclear antigen (PCNA) murine monoclonal antibodies and human autoantibodies to the PCNA multiprotein complexes involved in cell proliferation. J Immunol. 2001;166:4780-4787. [DOI] |