修回日期: 2002-11-15
接受日期: 2002-11-28
在线出版日期: 2003-04-15
本研究探讨肝癌DC疫苗活化的CTL对人肝癌裸鼠皮下抑制瘤的抑制作用.
将负载肝癌相关抗原DC经BCG HSP70活化后制成肝癌DC疫苗, 用此肝癌DC疫苗诱导的肝癌特异性淋巴细胞预防和治疗人肝癌裸鼠皮下移植瘤, 同时观察DC对人肝癌裸鼠皮下移植瘤的直接预防作用和冷冻复苏后肝癌特异性淋巴细胞对人肝癌裸鼠皮下移植瘤的预防和治疗作用.
DC对肝癌细胞的抑制率为97%, 用冷冻复苏后的CTL预防人肝癌裸鼠皮下移植瘤, 对肝癌细胞的平均抑制率为96%; 冷冻复苏后的CTL治疗人肝癌裸鼠皮下移植瘤, 对肝癌细胞的抑制率为98 %.
本研究结果为肝癌DC疫苗的进一步深入研究及今后的临床应用奠定良好的基础.
引文著录: 郭建巍, 秦力维, 蔡美英. 肝癌DC疫苗活化的CTL对人肝癌裸鼠皮下移植瘤的抑制作用. 世界华人消化杂志 2003; 11(4): 419-421
Revised: November 15, 2002
Accepted: November 28, 2002
Published online: April 15, 2003
To investigate the cytotoxic lymphocyte (CTL) primed by DC based hepatocellular carcinoma (HCC) vaccine against the growth of the carcinoma xenograft on nude mice.
High purity of dendritic cells (DCs) were obtained and the immune responses of lymphocytes primed by BCG HSP70 activated DCs were loaded with HCC associated antigens to prepare DC based HCC vaccine. The nude mouse model bearing human HCC xenografts was established and the characteristics of the tumor were identified with immunohistochemical techniques. Transplanted human HCC on nude mouse was treated with freezing and anabiotic HCC specific lymphocytes.
Lymphocytes primed by DCs based HC vaccine had the specific cytotoxicity against HCC lines. The CTL after freezing and anabiotics could prevent and treat HCC xenograft on nude mice with a preventive rate of 97 %.
DCs not only inhibit the growth of human HCC and other cancer cells in vitro, but also prevent the growth of HCC xenograft on nude mice in vivo.
- Citation: Guo JW, Qin LW, Cai MY. Cytotoxic lymphocytes primed by DC based hepatocellular carcinoma vaccine against growth of carcinoma xenograft on nude mice. Shijie Huaren Xiaohua Zazhi 2003; 11(4): 419-421
- URL: https://www.wjgnet.com/1009-3079/full/v11/i4/419.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i4.419
树突状细胞(DC)是体内功能最强的抗原提呈细胞(APC), 也是天然免疫和获得性免疫的重要调节剂[1]. 我们的前期研究结果表明: 在体外, DC负载肝癌细胞溶解物[2]、hAFP218-226位LLNQHACAV HLA-A2限制性九肽[3]和凋亡的肝癌细胞均可诱导出肝癌特异性CTL, 并特异性杀伤肝癌细胞.现将进一步探讨体外培养的、负载肝癌相关抗原DC诱导的肝癌特异性淋巴细胞预防和治疗人肝癌裸鼠皮下移植瘤, 及DC对人肝癌裸鼠皮下移植瘤的直接预防作用, 并观察冷冻复苏后肝癌特异性淋巴细胞对人肝癌裸鼠皮下移植瘤的预防和治疗作用如下.
重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF Pepro Tech); 重组人白介素-4(rhIL-4 Pepro Tech); 鼠抗人DC单克隆抗体(镇江医学院许化溪教授馈赠); 兔抗鼠FITC标记二抗(华美生物工程公司); RPMI1 640(Gibco); 淋巴细胞分离液(上海试剂二厂); 生物素化羊抗鼠IgG、HRP标记链亲和素(streptoavidin), 北京中山生物技术有限公司; 内源性生物素封闭试剂(avidin biotin blocking system, 武汉博士德生物有限公司); 鼠抗人肝癌单克隆抗体mcAb18(由本研究室刘小波博士馈赠); 新生小牛血清(杭州四季青生物工程材料研究所); BCG HSP 70和肝癌细胞可溶性抗原(本实验室自己制备); 四周龄Balb/c裸鼠, 雌雄各半(由华西医科大学实验动物中心提供); 正常人外周血源于18-25岁健康志愿者. SPF级动物实验室(华西医科大学实验动物中心提供); SPSS10.0 for Windows统计软件.
收集诱导7 d的DC[4] , 调整细胞密度为5×108/L, 加入24孔细胞培养板, 每孔1 mL, 同时每孔加入肝癌可溶性抗原120 g/L , BCG HSP70 10 g/L, 于37 ℃培养4 h, 用不完全RPMI1640洗涤3次, 将负载肝癌可溶性抗原后的DC与自身淋巴细胞以1:6混合后用含300 KU/L基因重组IL-2的完全RPMI 1640分瓶培养, 分别在培养的第3, 5天换液, 7 d收集淋巴细胞备用. 人肝癌裸鼠皮下移植瘤的普通石蜡切片用Triton-X-100, 1 g/L柠檬酸三钠处理10 min, PBS洗2次各5 min, 用7.5 mL/L H2O2阻断内源性过氧化物酶15 min, PBS洗两次各3 min, 加1: 20稀释的正常羊血清100 mL, 置湿盒内37 ℃, 30 min, 滤纸吸去血清; 分别加20 g/L 100 ml鼠抗人肝癌单克隆抗体和PBS(作空白对照), 置湿盒内37 ℃, 1 h, 取出4 ℃过夜, PBS洗2次各5 min, 滴加1:200稀释的生物素化羊抗鼠IgG抗体50 ml, 置湿盒内37 ℃, 30 min, PBS泡洗2次各5 min, 滴加1:200稀释的HRP标记链亲和素, 置湿盒内37 ℃, 30 min, PBS泡洗2次各5 min; 加DAB工作液50 ml, 镜下观察适时终止, 自来水充分冲洗, 最后苏木精复染、脱色、返蓝、逐级脱水、透明、封片, 普通光学显微镜观察.
1.2.1 DC预防人肝癌裸鼠皮下移植瘤 收集诱导7 d的DC, PBS洗3次后, 调整细胞浓度为1×109 /L, 于裸鼠左侧背部皮下注射, 每只1 mL, 共6只; 另取6只裸鼠, 每只背部皮下注射1 mL生理盐水作阴性对照. 同时于裸鼠右侧腋窝皮下接种人肝癌SMMC-7 721细胞5×106/只, 每只液体总量为0.2 mL, 每3 d观察移植肿瘤生长情况, 共观察30 d. 在无菌条件下取裸鼠移植瘤称质量, 按公式: 抑制率 = [(对照组平均瘤质量-实验组平均瘤质量)/对照组平均瘤质量]×100% 计算肿瘤抑制率.
1.2.2 肝癌特异性淋巴细胞预防肝癌裸鼠皮下移植瘤[5] 收集肝癌特异性淋巴细胞, PBS洗3次, 调整细胞浓度为1×109/ L, 于裸鼠左侧背部皮下注射, 每只1 mL, 共6只; 另取6只裸鼠, 每只左侧背部皮下注射1 mL生理盐水作阴性对照. 同时于裸鼠右侧腋窝皮下接种SMMC-7721细胞5×106/只, 每只液体总量为0.2 mL, 每3 d观察移植肿瘤生长情况, 共观察3 0d, 取裸鼠移植瘤称质量后按上述公式计算肿瘤抑制率.
1.2.3 冻存和复苏后肝癌特异性淋巴细胞预防和治疗人肝癌裸鼠皮下移植瘤 收集肝癌特异性淋巴细胞, 用不完全RPMI 1 640洗涤3次, 用1 mL冻存液(含100 g/L DMSO的FCS)调整细胞密度为2×106 /mL, 加入冻存管中. 置-20 ℃冰箱4 h后移入液氮气态4 h, 最后转入液态, 保存30 d. 使用时将冻存管迅速取出, 放入37 ℃水浴箱, 待完全融化后加入含预热RPMI 1640的离心管中, 1 500 r/min离心5 min, 用不完全RPMI 1 640洗涤3次, 苔盼蓝染色检查细胞活力后备用. 预防组: 收集冻存复苏后肝癌特异性淋巴细胞, PBS洗3次, 苔盼蓝染色调整活细胞浓度为1×109 /L. 取6只裸鼠, 于每只左侧背部皮下注射复苏后的肝癌特异性淋巴细胞, 每只1 mL; 另取6只裸鼠, 每只左侧背部皮下注射1 mL生理盐水作阴性对照.于裸鼠右侧腋窝皮下接种SMMC-7 721细胞5×106/只, 每只液体总量为0.2 mL, 每3 d观察移植肿瘤生长情况, 共观察30 d. 取裸鼠移植瘤称质量, 按1.2.1中的公式计算肿瘤抑制率. 治疗组: 先于12只裸鼠右侧腋窝皮下接种SMMC-7 721细胞5×106/只, 每只液体总量0.2 mL, 7 d后于6只裸鼠左侧背部皮下分别注射浓度为1×109 /L冻存复苏后肝癌特异性淋巴细胞1 mL; 在另6只裸鼠左侧背部皮下注射1 mL生理盐水作阴性对照. 每3 d观察移植肿瘤生长情况, 共观察30 d. 取裸鼠移植瘤称质量, 按1.2.1中的公式计算肿瘤抑制率.
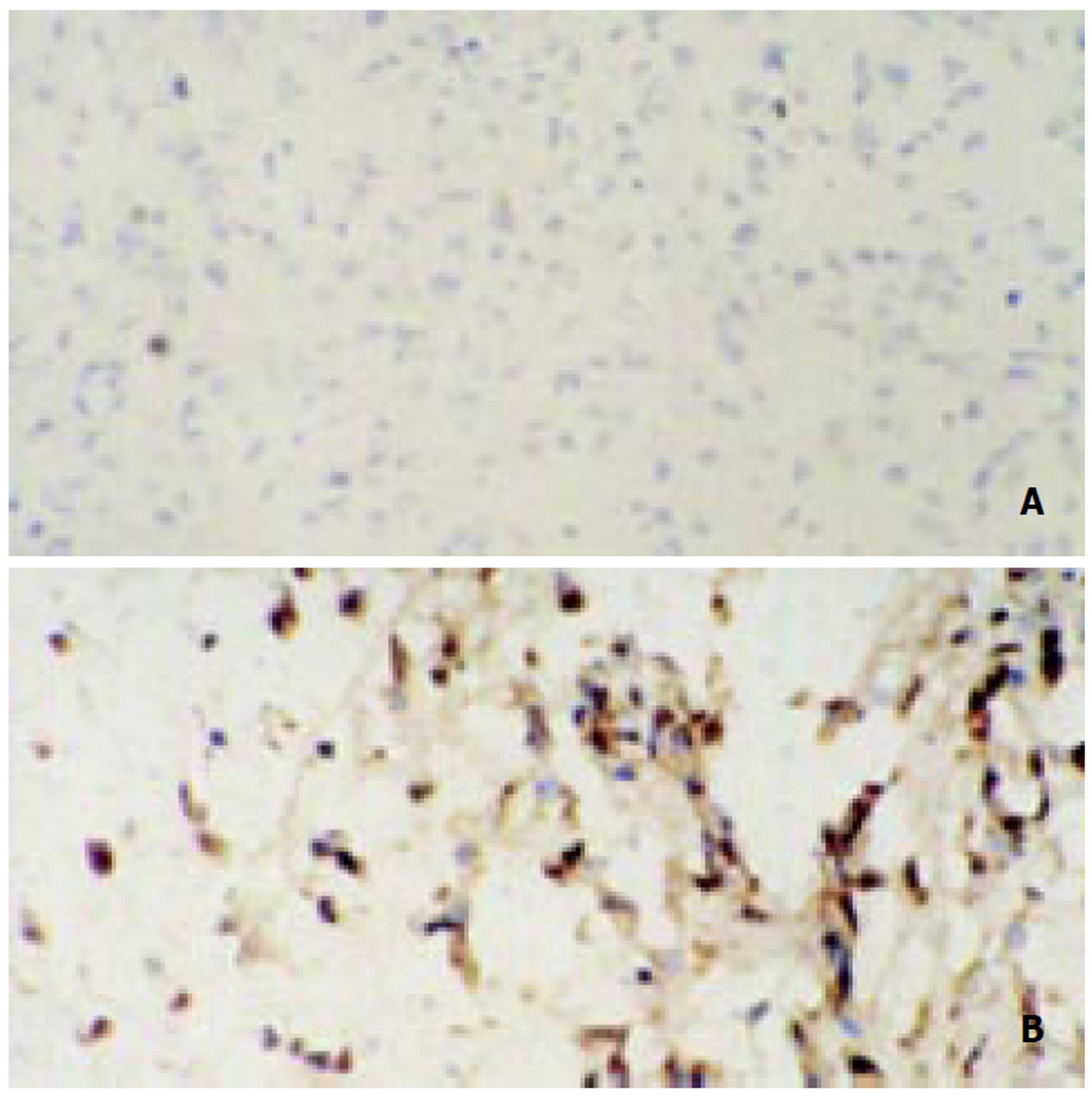
于裸鼠腋窝皮下接种5×106/只人肝癌细胞SMMC-7 721后, 6只裸鼠 均有肿瘤生长, 解剖后平均瘤重大于1 g. 免疫细胞组化LSAB法结果 阳性染色呈棕黄色. 大多数分裂及非分裂细胞都有着强弱不一阳性着色, 阳性染色分布于胞质、核周及胞膜, 相应的空白对照均未见阳性染色(图1).
DC预防人肝癌裸鼠皮下移植瘤, 对肝癌细胞的抑制率为97%, 而IL-2条件下培养的淋巴细胞(即LAK细胞)对肝癌细胞的抑制率仅为70%, 说明DC预防人肝癌裸鼠皮下移植瘤有效(P<0.05).
肝癌特异性淋巴细胞预防人肝癌裸鼠皮下移植瘤, 对肝癌细胞的抑制率均为96%, IL-2条件下条件下培养的淋巴细胞(即LAK细胞)预防人肝癌裸鼠皮下移植瘤抑制率仅为70%, 说明肝癌特异性淋巴细胞预防人肝癌裸鼠皮下移植瘤有效(P<0.05).
用冷冻复苏后的CTL预防人肝癌裸鼠皮下移植瘤, 对肝癌细胞的平均抑制率为96%; 冷冻复苏后的CTL治疗人肝癌裸鼠皮下移植瘤, 对肝癌细胞的抑制率为98%, 相同条件下培养的淋巴细胞对人肝癌裸鼠皮下移植瘤抑制率仅为70 %, 说明冷冻复苏后的CTL预防和治疗人肝癌裸鼠皮下移植瘤均有效(P<0.05).
肿瘤生物治疗中存在的一个主要问题, 即大多数人类肿瘤细胞抗原类型仍未得到明确的鉴定, 而已知的肿瘤相关抗原是否真正代表肿瘤排斥抗原缺乏体内实验证据[6]. 前期研究表明: 在体外负载肝癌细胞可溶性抗原的DC活化的自身淋巴细胞主要为CD4+T细胞同时还有部分CD8+T细胞, 可有效杀伤肝癌细胞; 同时, 活化细胞培养上清和细胞中可分别检测到Th1型细胞因子TNF和IEN-γ也能抑制肝癌细胞生长[2]. 因此, 用DC负载已建株的肝癌细胞可溶性抗原诱导肝癌特异性免疫应答意义深远. 用BCG预防和治疗膀胱和泌尿道转移癌已有20多年的历史, 并显示出良好的效果[7,8]HSP是BCG细胞质的一种重要成分, 存在于BCG培养物中, 是一种高度保守的胞内蛋白, 其合成在受到一系列应急刺激后(温度增加、营养缺乏、有毒刺激等)显著增加. 除此之外, 肿瘤细胞转染分枝杆菌HSP基因后也可以使宿主免于肿瘤的攻击[9]. 鉴于BCG HSP70独特的生物学特性, 本研究首次用其活化负肝癌相关抗原后的DC, 制成肝癌DC疫苗, 以更有效激发针对肝癌特异性的免疫应答[10-16].
目前, 国内仅有个别DC肿瘤疫苗临床应用的研究报告[17], 大部分工作仍主要集中于基础研究和临床前准备阶段. 李明松et al [18,19]研究表明: 胃癌、大肠癌、肝癌、卵巢癌患者外周血DC体外诱导的抗肿瘤细胞免疫反应不仅能预防而且能抑制人裸鼠移植瘤生长; DCs能从凋亡胆管癌细胞有效提呈肿瘤抗原并诱导出显著的杀伤胆管癌细胞的免疫反应[20]; 从外周血单核细胞中诱导出大批量的DCs, 这些DCs可被低温保存而不改变其功能. 在以上研究的基础上, 本研究改进传统DC诱导方法, 获得高纯度DC后, 在体外负载中国人自己建株的国人肝癌细胞SMMC-7 721可溶性抗原, 经BCG HSP70活化后制成肝癌DC疫苗, 并诱导具有生物学活性的肝癌特异性CTL. 冷冻复苏后的CTL不但可预防人肝癌裸鼠皮下移植瘤, 而且可抑制人肝癌裸鼠皮下移植瘤生长. 由于肝癌DC疫苗是以活细胞的形式进入机体、并活化机体免疫系统, 因此我们也评价了DC在体内对人肝癌裸鼠皮下移植瘤的直接作用, 研究证明DC对人肝癌裸鼠皮下移植瘤的直接抑制率为97%. 表明DC疫苗进入机体后可以非特异性抑制和特异性免疫应答两种方式发挥作用, 丰富了和扩展了肝癌DC疫苗的内容, 为今后肝癌DC疫苗的临床研究及应用奠定了重要基础.
| 1. | Mule JJ. Dendritic cells: at the clinical crossroads. J Clin Invest. 2000;105:707-708. [DOI] |
| 6. | Nouri-Shirazi M, Banchereau J, Bell D, Burkeholder S, Kraus ET, Davoust J, Palucka KA. Dendritic cells capture killed tumor cells and present their antigens to elicit tumor-specific immune responses. J Immunol. 2000;165:3797-3803. [DOI] |
| 7. | Lamm DL. Long-term results of intravesical therapy for superficial bladder cancer. Urol Clinics N Am. 1992;19:573-579. |
| 8. | Kamat AM, Lamm DL. Immunotherapy for bladder cancer. Curr Urol Rep. 2001;2:62-69. [DOI] |
| 9. | Lukacs KV, Lowrie DB, Stokes RW, Colston MJ. Tumor cells transfected with a bacterial heat-shock gene lose tumorigenicity and induce protection against tumors. J Exp Med. 1993;178:343-348. [DOI] |
| 10. | Tsuji S, Matsumoto M, Takeuchi O, Akira S, Azuma I, Hayashi A, Toyoshima K, Seya T. Maturation of human dendritic cells by cell wall skeleton of Mycobacterium bovis bacillus Calmette-Guerin: involvement of toll-like receptors. Infect Immun. 2000;68:6883-6890. [DOI] |
| 11. | Kim KD, Lee HG, Kim JK, Park SN, Choe IS, Choe YK, Kim SJ, Lee E, Lim JS. Enhanced antigen-presenting activity and tumour necrosis factor-alpha-independent activation of dendritic cells following treatment with Mycobacterium bovis bacillus Calmette-Guerin. Immunology. 1999;97:626-633. [DOI] |
| 12. | Jiao X, Lo-Man R, Guermonprez P, Fiette L, Deriaud E, Burgaud S, Gicquel B, Winter N, Leclerc C. Dendritic cells are host cells for mycobacteria in vivo that trigger innate and acquired immunity. J Immunol. 2002;168:1294-1301. [DOI] |
| 13. | Tsuji S, Matsumoto M, Takeuchi O, Akira S, Azuma I, Hayashi A, Toyoshima K, Seya T. Maturation of human dendritic cells by cell wall skeleton of Mycobacterium bovis bacillus Calmette-Guerin: involvement of toll-like receptors. Infect Immun. 2000;68:6883-6890. [DOI] |
| 14. | Demangel C, Britton WJ. Interaction of dendritic cells with mycobacteria: where the action starts. Immunol Cell Biol. 2000;78:318-324. [DOI] |
| 15. | Hashimoto K, Maeda Y, Kimura H, Suzuki K, Masuda A, Matsuoka M, Makino M. Mycobacterium leprae infection in monocyte-derived dendritic cells and its influence on antigen-presenting function. Infect Immun. 2002;70:5167-5176. [DOI] |
| 16. | Demangel C, Bean AG, Martin E, Feng CG, Kamath AT, Britton WJ. Protection against aerosol Mycobacterium tuberculosis infection using Mycobacterium bovis Bacillus Calmette Guerin-infected dendritic cells. Eur J Immunol. 1999;29:1972-1979. [DOI] |