修回日期: 2002-10-11
接受日期: 2002-10-21
在线出版日期: 2003-03-15
目的: 研究丙型肝炎病毒核心区(HCV-C)蛋白和细胞凋亡对肝癌细胞HepG2细胞周期的影响.
方法: 首先运用基因重组技术构建包含HCV-C基因的真核表达质粒pcDNA3. 1, 然后利用脂质体介导将重组真核表达质粒转染肝癌细胞HepG2, 经G418筛选获得稳定转染HepG2 细胞(HCV-C转染HepG2细胞), 经RT-PCR和间接免疫荧光法证实其中有HCV-C蛋白表达. 然后进行如下实验: (1)MTT法检测HCV-C转染HepG2细胞、空白质粒转染HepG2细胞和未转染HepG2细胞生长增生率; (2)流式细胞术(FACS)检测三组细胞凋亡率和细胞周期, 以及HCV-C转染HepG2细胞经Fas抗体诱导凋亡后的细胞周期变化.
结果: (1)HCV-C转染HepG2细胞增生率显著高于空白质粒转染HepG2和未转染HepG2细胞增生率; (2)细胞未经Fas抗体诱导凋亡时, HCV-C转染HepG2细胞S期所占百分率高于未转染HepG2细胞S期所占百分率, HCV-C转染HepG2细胞凋亡率低于无HCV-C转染HepG2细胞凋亡率; HCV-C转染HepG2细胞经Fas抗体诱导凋亡时, 细胞S期所占百分率低于未经诱导凋亡细胞S期所占百分率.
结论: (1)HCV-C蛋白具有抑制HepG2细胞凋亡的作用; (2)HCV-C蛋白促进HepG2细胞从G0/1期进入S期, 从而可能促进细胞生长增生, 抑制细胞凋亡; Fas抗体诱导细胞凋亡时细胞被阻滞于G0/1期.
引文著录: 全俊, 胡国龄, 范学工, 谭德明. 丙型肝炎病毒核心区蛋白和细胞凋亡对HepG2细胞周期的影响. 世界华人消化杂志 2003; 11(3): 350-352
Revised: October 11, 2002
Accepted: October 21, 2002
Published online: March 15, 2003
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2003; 11(3): 350-352
- URL: https://www.wjgnet.com/1009-3079/full/v11/i3/350.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i3.350
丙型肝炎病毒(HCV)感染是引起输血后肝炎的主要病原体, 且HCV感染后大部分会导致感染慢性化, 可引起慢性丙型肝炎、肝炎后肝硬化及肝细胞癌(HCC)等严重后果. 目前对丙型肝炎的发病机制尚不清楚, 免疫损伤可能是其主要致病机制, 但HCV对肝细胞的直接作用也起着一定作用, 其中包括HCV对肝细胞增生和细胞周期的影响[1-3]. Kalkeri et al[4,5]发现转染了HCV全基因的细胞增生受到抑制; Werling et al[6]报道慢性丙型肝炎患者肝细胞增生率低于非HCV所致慢性肝炎的肝细胞增生率, 说明HCV具有抑制肝细胞增生的能力. 丙型肝炎病毒核心区(HCV-C)蛋白对细胞增生和细胞周期的影响还不清楚. 部分认为HCV-C蛋白抑制细胞凋亡促进细胞增生[7-9], 部分认为HCV-C蛋白抑制细胞增生[10]. 细胞周期分为G0/1期、S期和G2/M期, 细胞周期在不同时相的多个调控点上受到调控, 其中以G1/S和G2/M期转换调控点最为重要[11,12]. 细胞周期阻断与细胞凋亡关系不明确, 细胞周期阻断并不是越完全越促使细胞凋亡[13]. 本实验旨在研究HCV-C和细胞凋亡对细胞周期的影响.
DNA纯化试剂盒(QIAGEN), 培养基DMEM, 脂质体Lipofectamine2000、抗生素G418(GIBCO), RT-PCR逆转录试剂盒(Promega), FITC标记山羊抗人IgG(武汉博士德), 兔抗人Fas多克隆抗体(Santa Cruz). 含有HCV-C, E1, E2区的质粒puc118由本所谭德明教授构建并赠送; 质粒pcDNA3. 1(+)、大肠杆菌JM109及肝癌细胞系HepG2由我科保存; 流式细胞仪(FACS420).
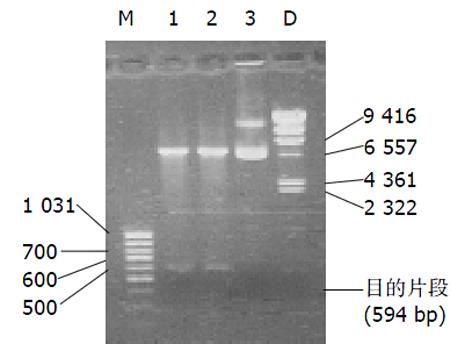
1.2.1 PCR引物: 根据HCV1a序列(AF009606)设计能扩增全长HCV-C的引物(分别在两端引入酶切位点HindⅢ及EcoRⅠ, 并在下游设计终止密码), 上游引物: ACAAGCTTCCCATGAGCACGAATCCTAAAC, 下游引物 AGAATTCCTAGGCTGAAGCGGGCACAGTC, 预计扩增片段长度为594 bp.
1.2.2 构建包括目的基因HCV-C的重组真核表达质粒[14,15] 首先以包括HCV-C、E1和E2区的重组质粒Puc118为模板进行PCR扩增目的片段HCV-C, 将纯化的PCR产物与T载体(3 000 bp)经T4 DNA连接酶4℃连接过夜, 经氨苄青霉素筛选阳性克隆, 并经HindⅢ、EcoRⅠ双酶切和PCR鉴定证实. 然后利用基因重组技术构建包括目的片段HCV-C的重组真核表达质粒pcDNA3. 1(约5 400 bp), 经抗生素筛选, PCR扩增、HindIII和EcoRI双酶切以及重组质粒DNA序列测定证实重组真核表达质粒中包含目的片段HCV-C, 说明含有目的基因HCV-C的重组真核表达质粒构建成功.
1.2.3 重组真核表达质粒转染肝癌细胞HepG2: 提取的重组真核表达质粒及空白质粒pcDNA3. 1经脂质体介导转染肝癌细胞HepG2, 经G418筛选获得稳定转染重组真核表达质粒的HepG2细胞(分别称为HCV-C转染HepG2和空白质粒转染HepG2).
1.2.4 RT-PCR和间接免疫荧光法检测HCV-C转染HepG2中HCV-C表达: 按Trizol RNA提取试剂盒说明提取细胞RNA, 行RT-PCR检测HCV-C转染HepG2细胞中有无HCV-C mRNA表达. 将细胞置于放有盖玻片的6孔细胞培养板中培养48 h后, 细胞经冷丙酮固定30 min, 滴加山羊血清室温孵育20 min封闭; 以丙型肝炎抗体阳性患者血清(1: 8)作为一抗孵育2 h, FITC标记的山羊抗人IgG(1: 32)为二抗37℃孵育1 h, 然后经PBS漂洗3次×5 min; 于荧光显微镜下观察HCV-C转染HepG2细胞中有无HCV-C 表达.
1.2.5 MTT法检测HCV-C蛋白对HepG2细胞增生率的影响[15]: 分别接种2×104个 HCV-C转染HepG2、空白质粒转染HepG2和未转染HepG2细胞于96孔细胞培养板中培养48 h后, 使用MTT(四甲基偶氮唑蓝)法检测细胞生长率.
1.2.6 流式细胞术检测细胞周期和细胞凋亡情况: 分别传代2×105个HCV-C转染HepG2、空白质粒转染HepG2和未转染HepG2细胞至6孔细胞培养板中培养72 h, 细胞经胰酶消化后用冷70 ml/L乙醇固定细胞于4℃保存, 细胞经流式细胞术检测细胞凋亡及细胞周期情况. Fas抗体诱导HepG2细胞凋亡: HCV-C转染HepG2首先培养48 h后加入Fas抗体(200 ng/mL)后再培养24 h[16-20].
统计学处理 利用SPSS10.0软件进行统计分析: 数据用表示, 多组之间进行比较采用方差分析, 当P<0.05时, 采用LSD法分别进行两两比较; 两组之间进行比较采用成组设计t检验, 并以P<0.05确定差异是否具有显著性.
2.1 重组真核表达质粒经PCR扩增可见600 bp左右的目的片段条带, HindIII 和EcoRI双酶切(图1), DNA序列测定说明包括HCV-C序列的重组真核表达质粒构建成功, 与HCV1a基因进行同源性比较符合率为98. 6%, 无移码突变.
2.2 经RT-PCR和间接免疫荧光法检测证实HCV-C转染HepG2细胞中有HCV-C mRNA和蛋白质表达, 而未转染HepG2 细胞和空白质粒转染HepG2细胞中无HCV-C表达.
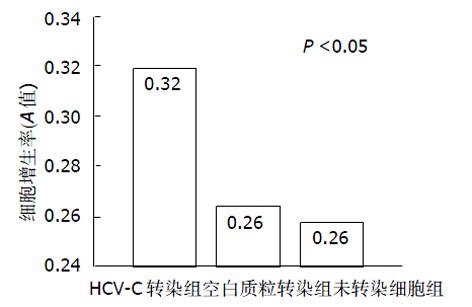
2.3 图2结果显示HCV-C转染HepG2细胞组生长增生率(0.32±0.04)高于空白质粒转染HepG2组(0.26±0.06)和未转染细胞组(0.26±0.05)(P<0.05), 说明HCV-C蛋白促进HepG2细胞生长增生.
2.4 表1结果说明细胞未经Fas抗体诱导凋亡时, HCV-C转染HepG2细胞凋亡率低于未转染HepG2细胞凋亡率, 同时HCV-C转染HepG2细胞S期所占百分率高于未转染细胞HepG2细胞S期所占百分率(P<0. 05); 二组细胞之间G0/1期所占百分率比较没有统计学差异(P>0.05), 但HCV-C转染HepG2细胞仍低于未转染HepG2细胞; 二组细胞之间G2/M期所占百分率没有显著性差别(P>0.05). 以上结果说明HCV-C蛋白促进HepG2细胞从G0/1期向S期转化, 而对G2/M期没有影响. 表2结果显示HCV-C转染HepG2细胞经Fas抗体(200 ng/mL)作用后凋亡率显著增加(P<0.001), 并且细胞凋亡增加时S期所占百分率少于未经Fas抗体诱导凋亡对照组S期所占百分率(P<0.05); G0/1期所占百分率与未经Fas抗体诱导凋亡对照组比较虽统计学上没有差异(P>0.05), 但经Fas抗体诱导凋亡组仍高于未经Fas抗体诱导凋亡组; 二组细胞之间G2/M期所占百分率没有显著性差异(P>0.05). 说明Fas抗体诱导细胞凋亡时也是作用于G1/S调控点, 使HCV-C转染HepG2细胞阻滞于G0/1期, 而对G2/M期没有影响.
目前公认HCV-NS5和NS3蛋白具有促进细胞增生、抑制细胞凋亡的功能[21-24]; 而HCV-C蛋白对细胞增生的影响还没有定论. 细胞增生、死亡是受细胞周期调控的, 细胞周期分为G0/1期、S期和G2/M期, 其中最关键的两期为S期和M期. 不同生物细胞增生周期时间不同, 主要是由G1期持续时间所决定的, 而且G1启动是细胞周期启动的关键, 因此G1/S期的调控尤为重要. 本实验结果表明HCV-C蛋白主要作用于G1/S调控点, 促进HepG2细胞由G1期进入S期, 由此可能启动并加速细胞周期进程, 促进细胞增生和抑制细胞凋亡. 但HCV-C蛋白作用于G1/S调控点的机制有待进一步研究. Cho et al[8]发现HCV-C蛋白通过上调细胞中cyclin E促进细胞增生; Kwun et al[22]发现HCV-C蛋白通过抑制P21促进细胞增生. 当HCV-C转染HepG2细胞经Fas抗体诱导凋亡时S期百分率减少, 细胞被阻滞于G1期. 增生细胞对某些凋亡诱因的敏感性常依赖于细胞周期, 本实验结果表明不管是HCV-C蛋白抑制细胞凋亡, 还是由Fas抗体诱导细胞凋亡增加时都不是作用于G2/M期. 细胞周期阻断与细胞凋亡关系不明确, 并不是细胞周期阻断越完全越促使细胞凋亡; 细胞周期阻断并不直接诱导细胞凋亡, 他可能是细胞凋亡的重要前提[25]. 细胞凋亡和增生分化是独立的两种方式, 但细胞凋亡和增生分化可同时存在; 细胞凋亡可发生在细胞周期不同时相. 细胞凋亡与细胞增生并非一定成负相关, 许多研究证明肿瘤组织含有激活的癌基因, 但细胞却出现大量死亡; 在慢性丙型肝炎患者肝细胞凋亡率和增生率可能同时升高, 但存在增生/凋亡失衡[26]. 目前已知具有致凋亡作用的C-myc和腺病毒蛋白E1A都是细胞增生的诱导物.
编辑: N/A
| 1. | Alter MJ. Epidemiology of hepatitis C. Hepatology. 1997;26:62S-65S. [PubMed] [DOI] |
| 4. | Kalkeri G, Khalap N, Akhter S, Garry RF, Fermin CD, Dash S. Hepatitis C viral proteins affect cell viability and membrane permeability. Exp Mol Pathol. 2001;71:194-208. [PubMed] [DOI] |
| 5. | Kalkeri G, Khalap N, Garry RF, Fermin CD, Dash S. Hepatitis C virus protein expression induces apoptosis in HepG2 cells. Virology. 2001;282:26-37. [PubMed] [DOI] |
| 6. | Werling K, Szentirmay Z, Szepesi A, Schaff Z, Szalay F, Szabó Z, Telegdy L, Dávid K, Stotz G, Tulassay Z. Hepatocyte proliferation and cell cycle phase fractions in chronic viral hepatitis C by image analysis method. Eur J Gastroenterol Hepatol. 2001;13:489-493. [PubMed] [DOI] |
| 7. | Ray RB, Meyer K, Ray R. Hepatitis C virus core protein promotes immortalization of primary human hepatocytes. Virology. 2000;271:197-204. [PubMed] [DOI] |
| 8. | Cho JW, Baek WK, Suh SI, Yang SH, Chang J, Sung YC, Suh MH. Hepatitis C virus core protein promotes cell proliferation through the upregulation of cyclin E expression levels. Liver. 2001;21:137-142. [PubMed] [DOI] |
| 10. | Kittlesen DJ, Chianese-Bullock KA, Yao ZQ, Braciale TJ, Hahn YS. Interaction between complement receptor gC1qR and hepatitis C virus core protein inhibits T-lymphocyte proliferation. J Clin Invest. 2000;106:1239-1249. [PubMed] [DOI] |
| 17. | Taya N, Torimoto Y, Shindo M, Hirai K, Hasebe C, Kohgo Y. Fas-mediated apoptosis of peripheral blood mononuclear cells in patients with hepatitis C. Br J Haematol. 2000;110:89-97. [PubMed] [DOI] |
| 18. | Zhang XD, Nguyen T, Thomas WD, Sanders JE, Hersey P. Mechanisms of resistance of normal cells to TRAIL induced apoptosis vary between different cell types. FEBS Lett. 2000;482:193-199. [PubMed] [DOI] |
| 21. | Ghosh AK, Steele R, Meyer K, Ray R, Ray RB. Hepatitis C virus NS5A protein modulates cell cycle regulatory genes and promotes cell growth. J Gen Virol. 1999;80:1179-1183. [PubMed] [DOI] |
| 22. | Kwun HJ, Jung EY, Ahn JY, Lee MN, Jang KL. p53-dependent transcriptional repression of p21(waf1) by hepatitis C virus NS3. J Gen Virol. 2001;82:2235-2241. [PubMed] [DOI] |
| 23. | Sakamuro D, Furukawa T, Takegami T. Hepatitis C virus nonstructural protein NS3 transforms NIH 3T3 cells. J Virol. 1995;69:3893-3896. [PubMed] |
| 24. | Gale M Jr, Kwieciszewski B, Dossett M, Nakao H, Katze MG. Antiapoptotic and oncogenic potentials of hepatitis C virus are linked to interferon resistance by viral repression of the PKR protein kinase. J Virol. 1999;73:6506-6516. [PubMed] |
| 26. | Farinati F, Cardin R, Fiorentino M, D'errico A, Grigioni W, Cecchetto A, Naccarato R. Imbalance between cytoproliferation and apoptosis in hepatitis C virus related chronic liver disease. J Viral Hepat. 2001;8:34-40. [PubMed] [DOI] |